دراسة السمية الجينية التي تسببها صبغات الشعر الدائمة الحاوية على بارافينيلين دي أمين في الزجاج
2023-01-01 | المجلد السابع العدد الأول - المجلد السابع | مقالات بحثيةوفاء اليونس | صوفي بركيل | شادي سكريه
الملخص
مركب البارافينيلين دي أمين عبارة عن مركب أمين عطري يحتوي في صيغته الكيميائية على مجموعة أمين في الموقع بارا وهو واحد من المركبات المعروفة الاستخدام في صبغات الشعر الدائمة كعامل طليعة مع مكون آخر يدعى العامل الرابط لتشكيل منتجات التفاعل التي تملك مجموعة أمين أيضاً. إن اختلاف سمية مركبات الأمينات العطرية تتطلب اختبار كل منها على حدة لتحديد خطورتها. لتقدير سلامة صبغات الشعر الدائمة الحاوية على مركب البارافينيلين دي أمين تم اختيار أربع صيغ منها ورُمزت بأرقام واختُبر تأثيرها السمي على خط خلوي لخلايا كلية جنين بشري HEK293T من خلال اختبار النوية الصغيرة Micronucleus (MN) test. حُضرت محاليل الصبغات بالاستعانة بخلية فرانز Franz بحيث طُبقت كل من صبغات الشعر المدروسة على الغشاء وأُخذ المحلول الموجود في حجرة الاستقبال لاستعماله في الاختبار من خلال تطبيق أربعة تراكيز منه على عدد محدد من الخلايا المستنبتة. أظهرت النتائج زيادة في عدد الخلايا الحاوية على النوية الصغيرة بعد المعالجة في الصبغتين 1 و2 حيث تراوحت نسبة هذه الخلايا 1.2-3% بينما الصبغات 3 و4 لم تظهر أي زيادة معنوية في الخلايا الحاوية على نوية صغيرة. تخلص هذه الدراسة إلى أن صيغة صبغات الشعر 1 و2 لها سمية جينية على الخلايا الثديية في الزجاج، بينما صيغ الصبغات 3 و4 ليس لها تأثير سام للجينات وهي آمنة للاستعمال.
كلمات مفتاحية : الأمين العطري، بارافينيلين دي أمين، صبغات الشعر الدائمة، اختبار النوية الصغيرة، السمية الجينية، الخلايا الثديية.
المقدمة Introduction:
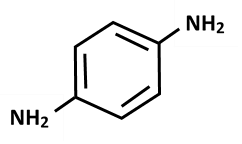
تعد الأمينات العطرية واحدة من أهم المركبات الكيميائية التي تدخل في العديد من الصناعات ومنها صبغات الشعر على الرغم من أنها تمثل إحدى الصفوف الكيميائية التي تنذر بحدوث السمية الجينية[1]، فصبغات الشعر الدائمة تحوي مكونين رئيسيين لهما صيغة الأمين العطري إلا أن أحدهما يحوي متبادل أو أكثر من مجموعات الأمين أو الهيدروكسيل في الموقع أورتو أو بارا ويدعى عامل الطليعة، والآخر تتوضع متبادلاته على الموقع ميتا من الصيغة ويدعى العامل الرابط. يتفاعل هذان المكونان مع بعضهما بوجود عامل مؤكسد في وسط قلوي قوي للحصول على مركب جديد والذي هو عبارة عن البلمر الملون [2], [3]. البارافينيلين دي أمين عبارة عن حلقة عطرية تحوي متبادلين من مجموعات الأمين كما يظهر في الشكل(1)، يتميز هذا المركب بوزنه الجزيئي الصغير وقدرته على الارتباط مع بروتين الشعر بشكل محكم ما يجعل منه أحد أهم عوامل الطليعة التي تستعمل في صبغات الشعر الدائمة[4], [5].
إن استقلاب مركب PPD يمكن أن تحدث في الجلد بواسطة أنزيم NAT1 (N-acetyltransferase) الموجود في الخلايا الكيراتينية مؤدياً إلى تشكيل أحادي أستيل بارا فينيلين دي أمين mono-acetyl-PPD (MAPPD) وثنائي أستيل بارا فينيلين دي أمين (DAPPD) N,N-diacetyl-PPD منزوعة السمية بحسب ما أشار كين وزملاؤه [6]، كما يمكن أن يُمتص كميات صغيرة من الصبغات المطبقة موضعياً إلى الدوران العام دون استقلاب وتصل إلى الكبد وتخضع للاستقلاب بأنزيم الأكسيجيناز الأحادي CYP1A2 monooxygenase معطيةً مشتقات البروكسيمات proximate المسرطنة[7] ، أو أن يحدث له اقتران غلوكوروني ويطرح عن طريق الكلية إلى المثانة حيث يحدث حلمهة وانفصال لحمض الغلوكوروني في الوسط الحمضي للمعة المثانة، وإذا ما تبع ذلك تفعيل حيوي لهذا المركب بواسطة أنزيم NAT1 يتشكل مشتق ذو ألفة عالية للالكترونات يمكنه الارتباط مع دنا DNA خلايا الجهاز البولي مؤدياً لحدوث السرطان في حال عدم اصلاح الدنا [8]. إن تكرار استعمال صبغات الشعر الحاوية على مركب البارافينيلين دي الأمين PPD يتسبب في العديد من التأثيرات السمية وأهمها حدوث التهاب جلد dermatitis إذ أنها تسبب اجهاد تأكسديoxidative stress [9]، بالإضافة إلى أن أكسدة مركب PPD يمكن أن ينتج عنه تشكل أساس باندروسكي Bandrowski’s base المعروف بتأثيره المسرطن. وعلى الرغم من كل ما ذكر حول سمية هذا النوع من الصبغات إلا أنه ما تزال صبغات الشعر الدائمة الحاوية على مركب PPD تشكل ثلثي الصبغات المنتشرة عالميا[10]. لذلك فقد حظيت صبغات الشعر بالعديد من الدراسات سواء أكان ذلك على مركب PPD لوحده أم على المستحضرات التي يتواجد فيها، بدءا من الدراسات التي أجريت على السلالات الجرثومية والتي أظهرت تأثيرات مسرطنة باستخدام اختبار Ames test [11] إلى الدراسات على حيوانات التجربة من خلال التطبيق الجلدي أو حتى الهضمي [12] وعلى عينات بشرية متنوعة مثل لمفاويات الدم المحيطية أو خلايا الظهارة البولية أو الخلايا الظهارية لمخاطية الفم [13]–[15] لتخلص الوكالة الدولية لأبحاث السرطانThe International Agency for Research on Cancer (IARC) بعد ذلك إلى القرار النهائي والذي ذكر أن صبغات الشعر الحاوية على الأمينات العطرية من الممكن أن تكون مسرطنة على العاملين في المهنة بالعودة إلى ما سمته أدلة محدودة من زيادة خطورة الإصابة بسرطان المثانة استناداً إلى دراسات وبائية، ذلك أن هؤلاء العاملين من الممكن أنهم يتعرضون للعديد من عوامل الخطورة أثناء قيامهم بعملهم وليس فقط لصبغات الشعر [16]، إضافة إلى ذلك فإن الاختلاف في الخواص الفيزيائية والكيميائية لمركبات الأمين العطرية منعت من الوصول إلى علاقة تربط البنية بالتأثير وهذا يسبب اختلاف في السمية الناتجة [17]–[19]، ما يتطلب فحص كل مركب على حدة للوصول إلى التقييم السمي له، علما أن تفاعل مكونات الصبغة مع بعضها ينتج عنها مركبات جديدة لها صيغة الأمين العطري والتي تملك خواص مختلفة يتوقف تقييمها على الاختبارات التي أجريت عليها. هنالك العديد من المقايسات التي تقيم السمية الجينية للمواد الغريبة الداخلة إلى العضوية الحية ومن بينها اختبار النوية الصغيرة والتي تم تضمينها في منظمة التعاون الاقتصادي والتنمية Organization for Economic Co-operation and Development (OECD) لمقايسة السمية الجينية في الزجاج للتنبؤ بخطورة المركبات ولجمع معلومات حول سلامتها، حيث تمثل هذه المقايسة أداة دقيقة وفعالة للتحري عن شذوذات الصبغيات التي يمكن أن تنتج عن المعالجة بمواد ذات سمية جينية محتملة كمركب PPD [20]. إن أهم الطرق التي يتم من خلالها التعرض لصبغات الشعر هو الطريق الجلدي عند حدوث الامتصاص أثناء التطبيق، حيث يحدث تعرض إلى نواتج تفاعل مكونات الصبغة [21]، لذلك هدفت الدراسة إلى التحري عن السمية الجينية للجزء الممتص من صبغة الشعر الدائمة الحاوية على مركب البارافينيلين دي أمين على خلايا الخط الخلوي HEK293T باستخدام اختبار النوية الصغيرة.
المواد والطرائق Material and Methods
1- المواد المستخدمة
وسط الاستنبات الخلوي Dulbecco’s Modified Eagle Medium (DMEM ) ومصل الجنين البقري fetal bovine serum(FBS) منزوع المتممة وصادات حيوية من بنسللين وستربتومايسينpenicillin/streptomycin ، محلول وقاء الفوسفات الخالي من المغنزيوم والكالسيوم Phosphate-buffered saline (PBS) (شركة بيوسيرا Biosera INC، الفيليبينPhilippines)، ومحلول أزرق التريبان Trypan Blue 0.5% (شركة سيغماSigma ، الولايات المتحدة الأمريكيةUnited States )، والميتانول Methanol 99.9% (شركة PanReac AppliChem ITW Reagents، اسبانيا Spain)، وملون غيمزا Giemsa”s solution (شركة SCP SCP Group، ماليزيا).

2- المواد المدروسة
أربع صبغات شعر دائمة تحوي على البارافينيلين دي أمين كعامل طليعة أساسي وبارا أمينو فينول كعامل طليعة إضافي يدخل في تركيب بعض الصبغات مع واحد أو أكثر من العوامل الرابطة تم ذكرها في الجدول (1). علماً بأن الصيغة (1) تعطي اللون أشقر والصيغة (2) تعطي اللون الأسود والصيغة (3) تعطي اللون الأحمر والصيغة (4) تعطي اللون البني.
3– الخط الخلوي:
تم العمل على خلايا الخط الخلوي HEK293T المشتق من كلية جنين بشري، والتي تم استنباتها في وسط من DMEM المضاف له مصل جنين بقريFBS بنسبة (10%) وصادات حيوية بنسبة (1%) وذلك ضمن حاضنة تؤمن درجة حرارة تصل إلى 37 درجة مئوية وغاز ثنائي أكسيد الكربون بنسبة (5%).
4- محاليل الصبغات المستخدمة للمعالجة:
تم تحضيرها باستخدام خلية فرانزFranz محلية الصنع [22] للحصول على الجزء الممتص من الصبغة، وذلك باستخدام غشاء طبيعي من جلد الجرذ ووضع وسط الاستنبات DMEM في حجرة الاستقبال للخلية. حيث طُبقت كل من صبغات الشعر على الغشاء مدة 45 دقيقة وترك الغشاء على الخلية مدة 24 ساعة بعد إزالة الصبغة، ليرشح بعد ذلك المحلول المستقبل بفلاتر جرثومية (0.2 ميكرون) ويُجمع في عبوات عقيمة ويحفظ لحين المقايسة بدرجة حرارة -20 درجة مئوية. حُضرت أربعة تراكيز لمعالجة الخلايا وهيµL/100µL 2.5,10,25,50 من محلول الصبغة نسبة إلى وسط الاستنبات .
5- اختبار النوية الصغيرة Micronucleus test (MN)
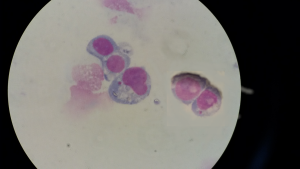
يقوم هذا الاختبار على حضن الخلايا المعالجة بالمادة المدروسة فترة زمنية تعادل 1.5 الفترة الزمنية اللازمة لإتمام الدورة الخلوية الطبيعية ثم تثبيت الخلايا وتلوينها بملون متألق ومن ثم تسجيل عدد الخلايا الحاوية على نوية صغيرة من أصل 1000 خلية أحادية النواة mononucleate cells وثنائية النواة binucleate cells [23]. إن هذ الاختبار يتمتع بدقة وفعالية في التحري عن شذوذات الصبغيات بموثوقية عالية وهو كما أشارت OECD يمثل أداة تحري سهلة وحساسة للتنبؤ عن تعرض الخلايا لمادة مطفرة. أُنجز هذا الاختبار بالاعتماد على بروتوكول OECD487 [24] مع بعض التعديلات. حيث تمً استنبات خلايا HEK293T في صفيحة 6 آبار بحيث وضع 0.3×106 خلية في كل بئر وكان الحجم النهائي للبئر هو 2ml من وسط الاستنبات DMEM المدعم بمصل الجنين البقري FBS وحضنت الصفيحة 24 ساعة. عولجت بعد ذلك الخلايا بالتراكيز المُحضرة سابقاً من محاليل صبغات الشعر مدة 45 ساعة في حاضنة CO2 وبدرجة حرارة 37 درجة مئوية مع شاهد سلبي عبارة عن خلايا مزروعة بنفس العدد في وسط الاستنبات وبدون أي معالجة وشاهد إيجابي عبارة عن خلايا مزروعة بنفس العدد ومعالجة بالكولشسين بتركيز 5µg/ml. ليجري بعدها فك التصاق الخلايا وغسلها بوقاء الفوسفات ثم تنبيذها بسرعة 790rpm مدة ثلاث دقائق وإزالة الطافي. ثُبتت الخلايا على شرائح زجاجية باستخدام الميتانول 99.9% وتُركت حتى تجف بدرجة حرارة الغرفة ثم صُبغت بملون غيمزا بتركيز 4% مدة 25 دقيقة ثم غُسلت بالماء الجاري وتٌركت حتى تجف بالهواء. وأخيراً فُحصت باستعمال المجهر العادي (Olympus ، اليابانJapan ) بتكبير×100 وحسب عدد الخلايا التي تحتوي على النوية الصغيرة كما يظهر في الشكل (2) بعد فحص 1000 خلية وعُرضت النتائج كنسب مئوية.
الدراسة الإحصائية Statistical study
تم التعبير عن النتائج باستخدام المتوسطات ± الانحراف المعياريStandard deviation ((SD، ودرست الفروق المعنوية للمقارنة بين أكثر من مجموعتين في اختبار النوية الصغيرة باستخدام one way ANOVA وذلك عند مستوى دلالة P <0.05 باستخدام برنامج التحليل الإحصائيGraphPad الإصدار 8.0.
النتائج Results
إن تصميم التجربة يقتضي أن تكون نتائج الاختبار التي تم الحصول عليها تمثل تأثير الجزء الممتص من صبغات الشعر على خلايا الخط الخلوي HEK293T. ولأن مقايسة النوية الصغيرة تعطي فكرة عن تأثير المادة المدروسة على المادة الوراثية للخلايا كانت نتائجها معبرة عن السمية الجينية المحتملة على الخلايا البشرية. أظهرت نتائج الدراسة أن النسبة المئوية لعدد الخلايا الحاوية على النوية الصغيرة تراوحت بين 1.2-3% وذلك بحسب نوع الصبغة وبحسب التركيز المستعمل علماً أن هذه النسبة بلغت 1.3% في الشاهد السلبي و8.3% في الشاهد الإيجابي. بينت النتائج أن الصبغة رقم 2 قد أبدت أكبر سمية جينية بين الصبغات الأربع المستعملة، إذ كانت نسبة الخلايا الحاوية على النويات الصغيرة عند أدنى تركيز مستعمل (2.5µl/100µl) أكبر من نسبتها في الشاهد بفارق معنوي حيث كانت قيمة P value= 80.001. فيما ظهر التأثير الجوهري السمي للصبغة رقم 1 عند التركيز 10µl/100µl حيث كانت قيمة P value= 20.001، ليتناقص عدد الخلايا الحاوية على النوية الصغيرة بعد ذلك في التراكيز الأعلى من كلتا الصبغتين. فيما لم تكن الزيادة في عدد الخلايا الحاوية على نوية صغيرة عند تطبيق الصبغتين رقم 3 و4 ذات فارق جوهري بالمقارنة مع الشاهد حيث كانت قيمة P value مساوية 0.76 و0.19 على الترتيب، كما يظهر في الشكل (2). تمثل المخططات النسب المئوية للخلايا الحاوية على النويات الصغيرة بعد المعالجة بأربع تراكيز 2.5، 10، 25، 50 µl لكل 100µl من وسط الزرع وذلك لكل صبغة من الصبغات الأربع على حدة الأعمدة من 2 إلى 5 بالإضافة إلى الشاهد السلبي (الخلايا غير المعالجة) العمود الأول والإيجابي العمود الأخير (الخلايا المعالجة بالكولشسين). عُرضت النتائج كمتوسطات لثلاث تجارب منفصلة ± الانحراف المعياري.
المناقشة Discussion
إن عدم اتخاذ الوكالات الدولية المهتمة بحماية المستهلك قراراً بحظر استخدام صبغات الشعر الدائمة يعود إلى عدم وجود أدلة حاسمة على خطورة استعمالها، حيث أن النتائج التي تظهر في الزجاج in vitro قد لا تنطبق على العضوية الحية in vivo وأن الأفراد الذين تمت عليهم الدراسة الوبائية متعرضون لعوامل بيئية مختلفة إضافة إلى صبغات الشعر، فضلاً عن أن الدراسات الوبائية تعطي دلائل دون أي تأكيد، وتتطلب العديد من الدراسات المخبرية لتأكيد أو لنفي نتائجها، وقد صممت هذه الدراسة لتكون دراسة مخبرية تجرى في الزجاج لتحري الأثر السمي الجيني للجزء الممتص عبر الجلد لعدد من صبغات الشعر الأكثر استعمالاً محلياً. لقد أوضحت نتائج الدراسة أن الجزء الممتص من صبغات الشعر (العابر لجلد الجرذ في خلية فرانز) والمطبق على الخلايا البشرية (خلايا الخط HEK293T ( يمكن أن يؤدي إلى زيادة في عدد الخلايا الحاوية على نوية صغيرة كما في الصبغة 1 و2 مما يدل على قدرتها على إحداث شذوذات في المادة الجينية للخلايا المعالجة بتراكيز هي فعلياً أقل بكثير من التراكيز التي يتم التعرض لها عند تطبيق صبغة الشعر، وهذا يتوافق مع التأثيرات التي ظهرت على خطوط خلوية أخرى تم تطبيق صبغات الشعر عليها كالخطوط الخلوي HDF وHaCaT التي استخدمت في الدراسة التي قام بها جي يونغ وزملاؤه Jae-Young et al. و HaCaTالتي استخدمها فينكاتيسان وزملاؤه Venkatesan et al. ومع ما توصل إليه مايتي وزملاؤه عند التطبيق على اللمفاويات المعزولة [25] [4] [10]، إضافة إلى ذلك فإن السمية الجينية قد ظهرت لدى فحص اللمفاويات لأفراد متعرضين لصبغات الشعر كما أشار Sunil et al. and Swati et al في دراستهما على خلايا الدم [25], [26]، وعلى خلايا نبات البصل المروي بمياه ملوثة بصبغات الشعر وعلى جراثيم E.coli أيضاً [25]، كما أن هذه التأثيرات قد ظهرت على خلايا الظهارة الفموية للعاملين في مهنة صبغ الشعر فيما أشار إليه Ozlem Sultan et al. في دراسته عام 2017 [13] وعلى خلايا الظهارة البولية لنساء يستعملن صبغات الشعر كما أشار اسبينوزا وزملاؤه Espinoza et al في دراستهم الوبائية عام 2008 [15]. أما عن تناقص عدد الخلايا الشاذة عند التعرض للتراكيز الأعلى من محاليل الصبغات فيمكن تفسيره من خلال المصير الذي تؤول إليه الخلية الشاذة بعد إصابتها من تخرب للنوية الصغيرة أو اندماجها مرة أخرى مع DNA الكلي أو قذف النوية الصغيرة إلى خارج الخلية أو تموت الخلية الشاذة من خلال الموت الخلوي المبرمج [27]. بالنسبة للصبغتين 3 و4 اللتين لم تبديا زيادة معنوية في عدد الخلايا الحاوية على النوية الصغيرة فلابد من أن طبيعة المكونات والتراكيز المستخدمة من كل منها قد ساهمت في مأمونية هذه الصبغات. بالنظر إلى مكونات صبغات الشعر المدروسة في ضوء النتائج التي تمّ الحصول عليها يلاحظ بأن ازدياد عدد المركبات الفعّالة المكوّنة لصبغات الشعر تؤدي إلى نقصان التركيز اللازم للحصول على اللون وبالتالي تقليل التأثيرات السمية، فبالنسبة للصبغة 2 تم استخدام مكونين فقط هما PPD كعامل طليعة والريزورسينول كعامل رابط ما يعني استخدام تراكيز مرتفعة نسبياً من كل منهما للحصول عل اللون المطلوب مقارنة مع الصيغ الأخرى للصبغات التي استُخدم فيها أكثر من عامل طليعة وأكثر من عامل رابط وأبدت سمية جينية أقل أو حتى لم تبد سمية ذات دلالة معنوية، وهنالك العديد من الدراسات التي أشارت إلى التأثير السام للجينات لمركب PPD كالدراسة التي قام بها Meirong et al. على الجرذ [6] بالإضافة إلى أن مركب الريزورسينول هو مركب سام للجينات في الزجاج والأحياء بحسب ما أشار هارفي وزملاؤه في دراستهم عام 2005 [28]. أما الصبغة 1 فقد استُخدم فيها البارا أمينو فينول كعامل طليعة إلى جانب PPD وهذا قلل من السمية الناتجة عن استعمال تراكيز مرتفعة من المركبات الداخلة بالتركيب، إلا أن احتواء هذه الصبغة على مركب بارا أمينو أورتو كريزول الذي أظهر تأثيراً مطفراً في الزجاج على السلالات TA97, TA98, TA100 [29] وتآزر هذا التأثير مع التأثير السام للجينات الذي تسبب به الريزورسينول فقد أدى ذلك إلى ظهور فارق يعتد به إحصائياً في عدد الخلايا الحاوية على نوية صغيرة إلا أنها مع ذلك تعتبر أقل سمية من الصبغة 2 إذ أن التأثير ظهر بتركيز أعلى وهو 10 مكرولتر/100مكرولتر. بالنسبة للصبغة 3 وعلى الرغم من أنها احتوت على مركب بارا أمينو أورتو كريزول إلا أنها لم تحتو على الريزورسينول وإنما مركب النافتول الذي لم يسجل له تأثير سام على الجينات في دراسات سابقة مما أدى إلى عدم ظهور تأثير سام للجينات لهذه الصيغة. كما أن الصبغة 4 احتوت على مركب ميتا أمينو فينول والذي لم يسجل له تأثير سمي على الجينات في دراسات سابقة مما جعلها صيغة آمنة للاستخدام. إن إظهار الألوان الفاتحة للصبغات كاللون الأشقر تتطلب استخدام عوامل مؤكسدة وقلوية قوية لإزالة اللون الطبيعي للشعر مما يؤدي إلى إجهاد تأكسدي ينتج عنه جذور حرة تهاجم المادة الوراثية [30]، كما أن الصبغات الداكنة كاللون الأسود تتميز باستعمال تراكيز مرتفعة من عوامل الطليعة مما يساهم بزيادة سميتها [31] وهذا ما توصل إليه ويست وزملاؤهWest et al. في دراسة قاموا بها عام 1982 إلى أن الصبغات ذات اللون الأسود تزيد عامل خطورة الإصابة بالسرطان [32].
في النهاية لابد من الإشارة إلى أنه ضمن خطة الدراسة لم يكن بالإمكان معرفة أثر الجزء الممتص على الخلايا لكل مكوّن من مكونات الصبغة على حدة وهذا ما يجب التركيز عليه في الدراسات المستقبلية، إضافة إلى العمل على التحري عن طبيعة الاستموات الخلوي الذي تعرضت له الخلايا الشاذة.

الاستنتاج Conclusions
إن الجزء الممتص عبر الجلد من صبغات الشعر المؤكسدة يمكن أن يُظهر تأثير سام للجينات حتى بتراكيز أقل من الممتصة فعلياً عند الاستخدام الاعتيادي، كما وإن شدة السمية ربما تختلف باختلاف طبيعة ونسبة المكونات الداخلة في تركيب صبغات الشعر. تعتبر الصيغتان المدروستان واللتان تعطيان اللون الأحمر والبني صيغاً آمنة للاستعمال وينصح بتداولها والتحري عن صيغ أكثر مأمونية لصيغ الصبغات المشكلة للون الأشقر والأسود.
المراجع :[1] C. Darling, “On the equilibrium hemoglobin,” Hemoglobin, pp. 56–68, 1942.
[2] G. G. Bessegato, J. C. De Souza, J. C. Cardoso, and M. V. B. Zanoni, “Assessment of several advanced oxidation processes applied in the treatment of environmental concern constituents from a real hair dye wastewater,” J. Environ. Chem. Eng., vol. 6, no. 2, pp. 2794–2802, 2018, doi: 10.1016/j.jece.2018.04.041.
[3] J. C. de Souza, B. F. da Silva, D. A. Morales, G. de A. Umbuzeiro, and M. V. B. Zanoni, “Assessment of the autoxidation mechanism of p-toluenediamine by air and hydrogen peroxide and determination of mutagenic environmental contaminant in beauty salon effluent,” Sci. Total Environ., vol. 685, pp. 911–922, 2019, doi: 10.1016/j.scitotenv.2019.06.252.
[4] G. Venkatesan et al., “Development of novel alternative hair dyes to hazardous para-phenylenediamine,” J. Hazard. Mater., vol. 402, 2021, doi: 10.1016/j.jhazmat.2020.123712.
[5] T. A. Vogel, R. W. Heijnen, P. J. Coenraads, and M. L. A. Schuttelaar, “Two decades of p-phenylenediamine and toluene-2,5-diamine patch testing – focus on co-sensitizations in the European baseline series and cross-reactions with chemically related substances,” Contact Dermatitis, vol. 76, no. 2, pp. 81–88, 2017, doi: 10.1111/cod.12619.
[6] M. Qin et al., “Application of the in vivo Pig-a gene mutation assay to test the potential genotoxicity of p-phenylenediamine,” Food Chem. Toxicol., vol. 123, pp. 424–430, 2019, doi: 10.1016/j.fct.2018.10.061.
[7] M. Gago-dominguez et al., “Permanent hair dyes and bladder cancer : risk modification by cytochrome P4501A2 and N- acetyltransferases 1 and 2,” vol. 24, no. 3, pp. 483–489, 2003.
[8] Y. Tafurt-Cardona, P. Suares-Rocha, T. C. C. Fernandes, and M. A. Marin-Morales, “Cytotoxic and genotoxic effects of two hair dyes used in the formulation of black color,” Food Chem. Toxicol., vol. 86, pp. 9–15, 2015, doi: 10.1016/j.fct.2015.09.010.
[9] J. K. Lee, H. E. Lee, G. Yang, K. B. Kim, S. J. Kwack, and J. Y. Lee, “Para-phenylenediamine, an oxidative hair dye ingredient, increases thymic stromal lymphopoietin and proinflammatory cytokines causing acute dermatitis,” Toxicol. Res., vol. 36, no. 4, pp. 329–336, 2020, doi: 10.1007/s43188-020-00041-6.
[10] J. Y. Oh, B. M. Ryu, H. W. Yang, E. A. Kim, J. S. Lee, and Y. J. Jeon, “Protective effects of Ecklonia cava extract on the toxicity and oxidative stress induced by hair dye in in-vitro and in-vivo models,” J. Oceanol. Limnol., vol. 37, no. 3, pp. 909–917, 2019, doi: 10.1007/s00343-019-8148-3.
[11] C. R. Robbins, “Dyeing Human Hair,” Chem. Phys. Behav. Hum. Hair, pp. 171–195, 1988, doi: 10.1007/978-1-4757-2009-9_6.
[12] K. H. Kim, E. Kabir, and S. A. Jahan, “The use of personal hair dye and its implications for human health,” Environ. Int., vol. 89–90, pp. 222–227, 2016, doi: 10.1016/j.envint.2016.01.018.
[13] Ö. S. Aslantürk and T. Aşkin Çelik, “Genotoxic risk assessment in professionals working hairdressers area using buccal micronucleus assay, in Aydın City, Turkey,” Environ. Sci. Pollut. Res., vol. 24, no. 17, pp. 14700–14705, 2017, doi: 10.1007/s11356-017-9075-5.
[14] S. Maiti, K. Sasmal, S. S. Sinha, and M. Singh, “Analysis of cytotoxicity and genotoxicity on E. coli, human blood cells and Allium cepa suggests a greater toxic potential of hair dye,” Ecotoxicol. Environ. Saf., vol. 124, pp. 248–254, 2016, doi: 10.1016/j.ecoenv.2015.10.028.
[15] F. Espinoza et al., “Micronuclei assessment in the urothelial cells of women using hair dyes and its modulation by genetic polymorphisms,” Cancer Lett., vol. 263, no. 2, pp. 259–266, 2008.
[16] K. M. Towle, M. E. Grespin, and A. D. Monnot, “Personal use of hair dyes and risk of leukemia: a systematic literature review and meta-analysis,” Cancer Med., vol. 6, no. 10, pp. 2471–2486, 2017, doi: 10.1002/cam4.1162.
[17] The American Cancer Society medical and editorial content team, “Cancer.org. 1.800.227.2345,” Am. Cancer Soc., p. 88, 2020.
[18] NTP, “Chromium hexavalent compounds. Report on carcinogens. U.S. Department of Health and Human Services. National Toxicology Program,” pp. 106–9, 2011.
[19] S. Committee and C. S. Sccs, Scientific Committee on Consumer Safety reaction products of oxidative hair dye ingredients formed during hair dyeing processes, no. September. 2010.
[20] “Test No. 487: In Vitro Mammalian Cell Micronucleus Test,” Test No. 487 Vitr. Mamm. Cell Micronucleus Test, 2014, doi: 10.1787/9789264224438-en.
[21] Y. Zhang et al., “Personal use of permanent hair dyes and cancer risk and mortality in US women: Prospective cohort study,” BMJ, vol. 370, 2020, doi: 10.1136/bmj.m2942.
[22] OCDE 428, “OECD – GUIDELINE FOR THE TESTING OF CHEMICALS: Skin Absorption: in vitro Method,” Test, no. April, pp. 1–8, 2004.
[23] “European Medicines Agency,” Definitions, no. March, 2020, doi: 10.32388/yokp53.
[24] O. Ocde, “Oecd/ocde 487,” no. July, 2016.
[25] S. Maiti, K. Sasmal, S. S. Sinha, and M. Singh, “Analysis of cytotoxicity and genotoxicity on E. coli, human blood cells and Allium cepa suggests a greater toxic potential of hair dye,” Ecotoxicol. Environ. Saf., vol. 124, pp. 248–254, 2016, doi: 10.1016/j.ecoenv.2015.10.028.
[26] S. Kumar, V. Vishwakarma, B. Yadav, R. Gupta, N. Aggarwal, and A. Yadav, “Antigenotoxic Effects of Epigallocatechin Gallate against Hair Dye Induced Genotoxicity in Cultured Human Peripheral Blood Lymphocytes,” J. Biol. Act. Prod. from Nat., vol. 10, no. 2, pp. 141–152, 2020, doi: 10.1080/22311866.2020.1764866.
[27] H. Hintzsche, U. Hemmann, A. Poth, D. Utesch, J. Lott, and H. Stopper, “Fate of micronuclei and micronucleated cells,” Mutat. Res. – Rev. Mutat. Res., vol. 771, pp. 85–98, 2017, doi: 10.1016/j.mrrev.2017.02.002.
[28] J. S. Harvey, J. R. Howe, A. M. Lynch, and R. W. Rees, “The results of five coded compounds: Genistein, metaproterenol, rotenone, p-anisidine and resorcinol tested in the pH 6.7 Syrian hamster embryo cell morphological transformation assay,” Mutagenesis, vol. 20, no. 1, pp. 51–56, 2005, doi: 10.1093/mutage/gei009.
[29] NTP, “NTP Technical Report on the Toxicity Studies of Cedarwood Oil (Virginia) (CASRN 8000-27-9) Administered Dermally to F344/N Rats and B6C3F1/N Mice,” 2016, [Online]. Available: https://www.niehs.nih.gov/research/resources/databases/cebs/index.cfm.
[30] X. Jing, F. Yu, and W. Lin, “Monitoring cysteine level changes under LPS or H2O2 induced oxidative stress using a polymer-based ratiometric fluorescent probe,” Anal. Chim. Acta, vol. 1174, 2021, doi: 10.1016/j.aca.2021.338738.
[31] G. J. Nohynek, R. Fautz, F. Benech-Kieffer, and H. Toutain, “Toxicity and human health risk of hair dyes,” Food Chem. Toxicol., vol. 42, no. 4, pp. 517–543, 2004, doi: 10.1016/j.fct.2003.11.003.
[32] D. W. West, M. H. Myers, K. P. Cantor, and T. J. Mason, “Use of hair dyes and risk of bladder cancer,” Cancer Res., vol. 42, no. 11, pp. 4784–4787, 1982.