صياغة مضغوطات قابلة للتفتّت في الفم لمادّة بيروكسيكام بالمشاركة مع مادّة كودئين فوسفات وتقييمُها في الزّجاج
2023-01-01 | المجلد السابع العدد الأول - المجلد السابع | مقالات بحثيةعمار السقا | جميلة حسيان | أنطون اللحام
الملخص
يمتلك إيتاء الأدوية عبر المخاطية الفموية مزايا مهمّة مقارنة بإيتاء الأدوية عبر الفم، وأهمها تجنب المرور الكبدي الأول فضلًا عن سرعة البدء في التأثير، يهدف هذا البحث إلى صياغة مضغوطات قابلة للتفتت في الفم لمادة البيروكسيكام بالمشاركة مع مادة كودئين فوسفات من أجل زيادة سرعة تحررهما من الشكل الصيدلاني. دُرس مدى التوافق بين المادتين الدوائيتين بإجراء دراسة الاجهاد المتساوي حرارياً واستخدام تقنيات DSC وFTIR قبل الصياغة. وبعد ذلك، حُضّرت تسع صيغ صيدلانية مختلفة بنوع العامل المفتت الفائق وتركيزه. أظهرت نتيجة اختباري الـ DSC وFTIR وجود تداخل صلب-صلب بين البيروكسيكام والكودئين فوسفات، وأن المحتوى الدوائي للمادتين ضمن الحدود الدستورية بنتيجة اختبار الاجهاد المتساوي حرارياً. بيّنت الصيغة F3 التي تحتوي على الكروس بوفيدون-XL بوصفه عاملًا مفتتًا فائقًا بتركيز 7.5% بأنها تمتلك زمن التفتت الأقل، وكان معدل تحرر الكودئين فُسفات والبيروكسيكام في الصيغ المحضرة المنتخبة F3، F6، F7 مرتفعًا، وتحرر 80% من مادة الكودئين فُسفات والبيروكسيكام ضمن الدقائق الأربع الأولى من اختبار الذوبان.
كلمات مفتاحية : مضغوطات قابلة للتفتت في الفم، البيروكسيكام، الكودئين فوسفات، ODTs، اختبار الثبات الحراري، DSC، FTIR، HPLC، المفتت الفائق.
المقدمة Introduction:
يمكن إعطاء الدواء بعدد من الطرائق المختلفة لإعطاء تأثير دوائي جهازي وأكثر الطرائق الشائعة لإعطاء الدواء هي عبر الطريق الفموي، إذ يُبتلع الدواء فيدخل الدورة الدموية الجهازية في المقام الأول بواسطة أغشية الأمعاء الدقيقة. يملك الفم قدرة على العمل بوصفه موقعًا لامتصاص الأدوية لأنه مبطن بغشاء مخاطي غزير بالأوعية الدموية. وعمومًا، تخترق الأدوية الغشاء المخاطي بالانتشار البسيط، ويُحمل في الدم إلى الدوران الجهازي عبر الوريد الوداجي jugular vein. تُعدُّ المضغوطات القابلة للتفتت في الفم أشكالًا جرعية مثالية لإيتاء الأدوية عند الأطفال وكبار السن إذ بلغ حجم سوق الـمضغوطات القابلة للتفتت في الفم العالمي في عام 2012 نحو 9 مليار دولار((1. طُورت المضغوطات القابلة للتفتت في الفم بوصفها مقاربةً مفيدة في البروتوكول العلاجي للشقيقة (والتي تتطلب زمن بدء تأثير سريع)، كما ذكرت بعض الدراسات الإحصائية مدى تفضيل المرضى لهذه الأشكال الصيدلانية إذ بينت الدراسات أن أكثر من نصف المرضى يفضلون المضغوطات القابلة للتفتت في الفم عن الأشكال الصيدلانية الأخرى)2(. يمتلك إيتاء الأدوية عبر المخاطية الفموية مزايا مهمة مقارنة بإيتاء الأدوية عبر الفم وأهمها:
- لا تخضع الأدوية للتدرك الحمضي في المعدة.
- يصل الدواء إلى التراكيز العلاجية المصلية أسرع.
- يُدخل الدواء إلى الدوران الدموي العام دون المرور الكبدي الأول ما لم تُبلع المادة الدوائية(3).
هذه الظاهرة الأخيرة مهمة للأدوية التي تُستقلب استقلابًا كبيرًا في أثناء مرورها الأول الكبدي. هذا الاستقلاب (يحكمه نسبة استخراج الكبد) يمكن أن يؤدي إلى تقليل كمية الأدوية المتاحة بوضوح والواصلة إلى الدوران من الجرعة الفموية المعطاة عبر الفم، ولكن تُتجنّب هذه الظاهرة عبر إيتاء الأدوية عن طريق المخاطية الفموية(4). وقع الاختيار على البيروكسيكام والكودئين فوسفات لسببين رئيسيين، أولهما أن البيروكسيكام وهو أحد أدوية مضادات الالتهاب اللاستيروئيدية الذي شُورك مع مسكن ألم مركزي أفيوني وهو الكودئين فوسفات لصياغتهما ضمن مضغوطات قابلة للتفتت في الفم لاستخدامها في تدبير الحالات الاسعافية للألم، والسبب الثاني من وجهة نظر الصناعة الصيدلانية أنه لم تذكر الأدبيات مشاركة البيروكسيكام والكودئين فوسفات ضمن أي شكل صيدلاني. وفيما يخص صياغة مادة البيروكسيكام ضمن مضغوطات قابلة للتفتت في الفم فقد قامت بعض الدراسات الصيدلانية بتسليط الضوء على دراستها دراسة تقويم مخبري دون مشاركتها مع أي مادة دوائية أخرى)5(، أما فيما يخص صياغة الكودئين فوسفات ضمن مضغوطات قابلة للتفتت في الفم فلم تذكر الأدبيات ولا الدراسات السابقة صياغة هذه المادة ضمن مضغوطات قابلة للتفتت في الفم. أُجري البحث في محرك البحث الأكاديمي “غوغل سكولار Google scholar” استنادًا إلى الكلمات المفتاحية الآتية بالمقابل الانكليزي: البيروكسيكام والكودئين فوسفات، مشاركة بين الكودئين فوسفات والبيروكسيكام، مضغوطات قابلة للتفتت في الفم البيروكسيكام والكودئين فوسفات”، لم تظهر نتيجة البحث أية نتائج أو أوراق بحثية مشتركة ما بين المادتين الدوائيتين المذكورتين ضمن أي شكل صيدلاني جرعي.
يهدف هذا البحث إلى دراسة مدى التوافقية بين مادة بيروكسيكام وكودئين فوسفات لدى وجودهما ضمن الشكل الصيدلاني نفسه Orally Disintegrating Tablets (ODTs) باستخدام فحوص IR وDSC، ومن ثم صياغة مضغوطات قابلة للتفتت في الفم لمادة البيروكسيكام والكودئين فوسفات وتقييمها في الزجاج.
المواد والطرائق Materials and methods
المواد المستخدمة
البيروكسيكام (Apex Healthcare, India)، الكودئين فوسفات (Saneca Pharmaceuticals Hlohovec, Slovakia)، البريموجيل (JRS Pharma, India)، الكروس كارميلوز الصوديوم (Shandong Head Co, China)، شمعات المغنيزيوم (Nitika Pharmaceuticals Specialities, India)، المانيتول (Signet Chemical Corporation, India)، الأفيسيل PH-102 (Antika pulps and boards, India).
الأجهزة المستعملة Devices and Instruments
استخدمت الأجهزة الآتية: ميزان حساس (Satorius GP 2102, Germany)، ميزان حساس تحليلي (Precisa XB 220A, Switzerland) بدقة 0.0010 غرام، سخان كهربائي مع خلاط مغناطيسي، حاضنة ثبات (Humidity Chamber HCP50, Memmert, Germany)، جهاز الاستشراب السائل عالي الأداء (HPLC, Shimadzu Prominence PDA SPD-20A
Japan)، حمام أمواج فوق صوتية (PHYLO USH-10D, Italy)، جهاز المطياف الضوئي المرئي والأشعة فوق البنفسجية (HITACHI UV-VIS Spectrophotometer, U-1800, Japan)، جهاز المسح الحراري التفاضلي (Mettler Toledo, Switzerland)، جهاز فحص الذوبان (Erweka, Type DT800, Germany)، جهاز قياس الباهاء (HANNA instruments PH Microscopic pH Meter, USA)، جهاز اختبار زمن التفتت (Erweka ZT320, Germany)، آلة ضغط مخبرية (Erweka EK-0, Motor Drive AR 402, Germany)، جهاز قياس القساوة والسماكة (Erweka TBH300 S, Germany)، جهاز قياس الهشاشة (Erweka TAR20, Germany)، مراشح نايلون للمحاقن (Whatman, Germany)، مناخل دستورية (CISA, UK).
المقايسة المتواقتة للمادتين الدوائيتين بواسطة جهاز الاستشراب السائل عالي الأداء HPLC:
لم ترد في الأبحاث المنشورة أو الأدبيات أية طرائق للتعيين المتواقت لمزيج المادتين الدوائيتين بواسطة جهاز HPLC. لذلك طُوّرت طريقة تحليلية للمقايسة باستخدام جهاز الاستشراب السائل عالي الأداء HPLC بعد دراسة الصفات الفيزيائية والكيميائية للمواد المدروسة، حُدّد طول موجة الكشف المناسبة.
الشروط التحليلية:
نوع العمود: C18 (mm150×mm4.6) حجم الحبيبات 5µ.
طول موجة القياس: 214 nm.
معدل التدفق: 1.1 ml/min.
الطور المتحرك: ميتانول/وقاء فسفاتي pH=2.3 (4:6).
المذيب المستخدم من أجل المحلول العياري: الميثانول المحمض بحمض كلور الماء المركز methanolic hydrochrloic acid بتركيز 0.01 N.
التراكيز المستخدمة من أجل الشاهد: 0.1 ملغ/مل لكلا المادتين الدوائيتين.
تحضير المحاليل المعيارية :Standard Solutions
- تحضير محلول معياري لمادة البيروكسيكام لوحدها بتركيز 0.1 ملغ/مل:
تُوزن 10 ملغ من مادة البيروكسيكام وتنقل لبالون معايرة سعة 100 مل، وتذاب بالميثانول المحمض بحمض كلور الماء 0.01N ثم يمدد الحجم بواسطة الميثانول المحمض بحمض كلور الماء، توضع في جهاز الأمواج فوق الصوتية لمدة 15 دقيقة.
- تحضير محلول معياري لمادة الكودئين فُسفات لوحدها بتركيز 0.1 ملغ/مل:
تُوزن 10 ملغ من مادة الكودئين فُسفات وتنقل لبالون معايرة سعة 100 مل، وتذاب بالميثانول المحمض بحمض كلور الماء 0.01N ثم يمدد الحجم بواسطة الميثانول المحمض بحمض كلور الماء، توضع في جهاز الأمواج فوق الصوتية لمدة 15 دقيقة.
- المحلول المعياري للبيروكسيكام والكودئين فُسفات بتركيز 50 مكغ/مل لكلا المادتين الدوائيتين:
يوضع في دورق معياري سعة 50 مل 25 مل من محلول البيروكسيكام الأم، 25 مل من محلول الكودئين فُسفات الأم، ثم توضع في جهاز الأمواج فوق الصوتية لمدة 15 دقيقة.
تحضير المضغوطات القابلة للتفتت في الفم ODTs:
لم تشر الأدبيات إلى أية مشاركة دوائية بين مادة بيروكسيكام وكودئين فوسفات ضمن نفس الشكل الصيدلاني، لذلك كان لا بد من إجراء الفحوص اللازمة للتأكد من سلامة هذه المشاركة وعدم تأثيرها على الثباتية الكيميائية والفيزيائية للمستحضر المحضر.
الدراسة ما قبل الصياغة Preformulation Study:
تحضير العينات من أجل دراسة الإجهاد المتساوي حرارياً Isothermal Stress Testing (IST) (6)
مُزج البيروكسيكام مع الكودئين فوسفات بنسبة 1:1 مزجًا هندسيًا لتحقيق التجانس. وحُفظت العينات ضمن حاضنة ثبات مضبوطة درجة الحرارة والرطوبة النسبية على النحو الآتي: درجة الحرارة 40 م والرطوبة النسبية 75%، وذلك لمدة 6 أشهر وفق توصيات الـــICH لدراسة الثبات المسرع. حُلّلت العينات عيانياً وباستخدام تقنيات DSC وFTIR وHPLC وذلك من أجل التحري عن التوافق بين المواد وتحديد التآثر المحتمل.
مرحلة الصياغة formulation Study:
دُرست العديد من السّواغات المفتتة لتحقيق تفتت مناسب للمضغوطات المحضرة مع زمن تفتت سريع. حُضّرت تسع صيغ دوائية بطريقة الضغط المباشر موضحة في الجدول (1)، وطُبقّت اختبارات خاصة على المزيج المعدّ للضغط قبل عملية الضغط، وعلى المضغوطات بعد عملية الضغط.
خطوات العمل:
حُضّرت الصيغ التسع بطريقة الضغط المباشر (DC) Direct Compression، استخدم سواغ أفيسيل PH102 في تحضير الصيغ بوصفها مادة مالئة لأنها مناسبة لتحضير المضغوطات المحضرة بطريقة الضغط المباشر، كما أنها تمتلك خواص محسنة للانسيابية، وأضيف سواغ المانيتول بوصفه عاملًا ممددًا للصيغة وللاستفادة من خواصه المحلية لأنه يعطي إحساس بالبرودة وماصّاً للحرارة لدى تماسه مع اللعاب في الفم، استُخدمت شمعات المغنيزيوم بتركيز 1% بوصفها مادة مانعة للالتصاق ضمن حجر الضغط. مُزجت المواد الدوائية والسواغات مزجًا هندسيًا جيداً حتى تمام المزج، وأخيراً أضيفت شمعات المغنيزيوم ومُزجت الصيغ لمدة 5 دقائق. رُعي التسلسل في تحضير كافة الصيغ. وضُغط مزيج المساحيق ضمن مكبس رقم 8.
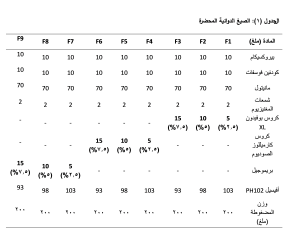
فحوص المضغوطات القابلة للتفتت في الفم بعد عملية الضغط Evaluation of ODTs:
- فحص القساوة Hardness test:
- فحص الهشاشة Friability test:
- فحص القطر والسماكة Diameter and thickness test:
- فحص اختلاف الوزن Weight Variation Test:
- فحص معايرة المحتوى Content uniformity test:
عويرت المادتان الدوائيتان في مختلف صيغ المضغوطات المحضرة. إذ أُخذت 10 مضغوطات من كل صيغة وسحقت، وأُخذ ما يعادل 10 ملغ من البيروكسيكام و10 ملغ من الكودئين فوسفات إلى بيشر ذات حجم 100 مل، وحُلّت في 10 مل من محلول الميثانول المحمض بحمض كلور الماء 0.01N مع التحريك، ومُدد حتى تمام الحجم بالوقاء الفوسفاتي pH 6.8 فيكون تركيز البيروكسيكام 0.1 ملغ/مل وتركيز الكودئين فوسفات 0.1 ملغ/مل. يرشح المحلول بمراشح ميكرونية 0.45 مكم، أُجري القياس بواسطة جهاز الاستشراب السائل عالي الأداء HPLC. يُجرى كل قياس ثلاث مرات(7).
- فحص الذوبان Dissolution test:
جرى هذا الاختبار باستخدام جهاز فحص الذوبان ذات المجداف USP ǁ paddle بسرعة تحريك 50 دورة/دقيقة ضمن وسط ذوبان 900 مل من محلول الوقاء الفسفاتي pH 6.8، إذ ضُبطت درجة حرارة وسط الذوبان عند 37±0.5 درجة مئوية. وطُبّق الفحص على ست مضغوطات في حجم 900 مل لكل مضغوطة، ثم سُحبت عينات 5 مل عند الأزمنة المحددة بالدقائق (1، 2، 3، 5، 10). رُشحت العينات المسحوبة بمراشح غشائية 0.45 مكم، وعُوّضت بكميات متساوية من وسط الذوبان، بعد ذلك قيست المساحة تحت المنحني AUC باستخدام جهاز الاستشراب السائل عالي الأداء HPLC. (8)
- فحص زمن التفتت Disintegration test:
جرى هذا الاختبار بوضع ست مضغوطات مأخوذة عشوائياً من كل صيغة ضمن جهاز اختبار زمن التفتت، إذ وُضع 900 مل من الماء المقطر بدرجة حرارة 37 ± 2 درجة مئوية، واحتُسب الزمن اللازم من أجل التفتت الكامل للمضغوطات، حتى ضمان عدم بقاء أي بقايا ضمن جهاز السلة وعدّه زمن تفتت(9). يُجرى كل قياس ثلاث مرات.
- فحص زمن التبلل Wetting Time test:
جرى هذا الاختبار بوضع ست مضغوطات من كل صيغة ضمن طبق بيتري يحتوي على 6 مل من الماء المقطر وورقة ترشيح قطنية، احتُسب الزمن اللازم من أجل أن تتبلل كامل المضغوطات أو الزمن اللازم لكي يصل الماء لأعلى المضغوطات (9). يجرى كل قياس ثلاث مرات.
النتائج والمناقشة Results and Discussion:
المقايسة المتواقتة للمادتين الدوائيتين بواسطة جهاز الاستشراب السائل عالي الأداء HPLC:
مقايسة المادة الفعالة Assy:
طُبقت الطريقة التحليلية المطورة لمقايسة مزيج المواد الدوائية والتأكد من مؤشرات ملائمة النظام System suitability وذلك بحقن ست حقن متتالية من محلول الميز Resolution solution وحساب عامل التذييل Tailing factor، عدد الصفائح النظرية Theorical plates، الميز Resolution، والانحراف المعياري النسبي RSD لمساحة قمم المواد البيروكسيكام والكودئين فُسفات كما هو موضح في الجدول (2) وكانت النتائج على الشكل الآتي:
- عامل التذييل: أقل من 1.5.
- عدد الصفائح النظرية: أكثر من 2000.
- الميز: أكبر من 1.5.
- الانحراف المعياري النسبي: أقل من%2.
يطبق اختبار ملائمة النظام في بداية كل عملية تحليلية.
| الجدول (2): معايير ملاءمة النظام System Suitability Test للبيروكسيكام والكودئين فُسفات | ||||
| المادة | زمن الاحتباس (د) Retention Time | عامل التذييل Tailing Factor | الميز Resolution | الصفائح النظرية Theoretical usp plates |
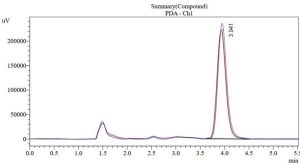
| البيروكسيكام | 3.955 | 1.220 | 8.649 | 2881974.65 |
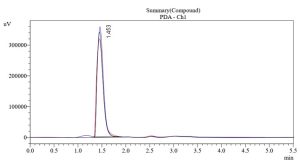
| الكودئين فُسفات | 1.462 | 1.417 | – | 2857275 |
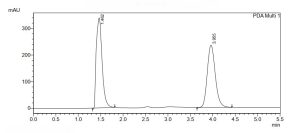
يبين الشكل (1، 2، 3) مخطط الاستشراب الناتج عن عملية حقن المحلول المعياري للبيروكسيكام، الكودئين فوسفات ولمزيج البيروكسيكام والكودئين فُسفات على الترتيب، إذ تظهر القمم عند زمن احتباس (3.955 دقيقة) و(1.462 دقيقة) على الترتيب، وهذا يؤكد دقة الفصل بين قمم المواد من دون وجود تداخل. حُسبت المساحة تحت القمة من خلال البرنامج الآلي الموصول مع جهاز HPLC.
نتائج دراسات التآثرات بين البيروكسيكام والكودئين فوسفات:
- الفحص العياني:
ظهرت عينات البيروكسيكام والكودئين فوسفات قبل الحفظ وبعده مسحوقًا أبيض شاحبًا للكودئين فوسفات ومسحوقًا أصفر باهتًا متكتل للبيروكسيكام قبل عملية الحفظ وبعده في شروط الحفظ لدراسة الثبات المسرع (درجة الحرارة 40 م والرطوبة النسبية 75%). أظهرت المزائج الثنائية بنسبة (1:1) فتظهر محافظة مزيج بيروكسيكام-كودئين فوسفات على خواصه العيانية طيلة مدة الحفظ في الشروط (RH75%/40°C).
- نتائج معايرة العينات الفردية والمزائج للمواد الفعالة بواسطة :HPLC
لُوحظ انخفاض تراكيز البيروكسيكام والكودئين فوسفات في أثناء الزمن لشروط الحفظ (RH 75%/40°C) مع بقاء النسبة المئوية للمحتوى الدوائي فوق 90% لكلا المادتين الدوائيتين، وكان الأقل تأثّراً هو البيروكسيكام النقي يليه الكودئين فوسفات النقي.
- المسح الحراري التفاضلي Differential scanning calorimetry: (10)
أُجرى المسح الحراري بواسطة جهاز DSC نوع (Mettler Toledo, Switzerland) على المواد الدوائية كلٍّ على حدة، ومزيجهما بنسبٍ متساوية (1:1). وُزنت العينات الجافة تمامًا وزنًا دقيقًا حوالي (5-7) ملغ، مع وضعها ضمن بوتقة خاصة مصنوعة من الألمنيوم، وأُحكم إغلاقها جيدًا بواسطة مكبس خاص، ثم أُجري الاختبار مع استخدام بوتقة أخرى فارغة من الألمنيوم شاهدًا وذلك بتعريض العينات إلى حرارة متزايدة ضمن المجال 25-400 درجة مئوية بمعدل (10 درجة مئوية/دقيقة) وتحت تدفق غاز الآزوت N2. يُظهِر مخطط المسح الحراري التفاضلي للبيروكسيكام خطًا بيانيًا يتضمن قمة ماصة للحرارة endothermic عند درجة حرارة 202.58 0م تشير إلى درجة انصهار الشكل البلوري للبيروكسيكام وهذا يتوافق مع دراسة نشرت عام 2020م. (11) وظهرت قمة أخرى ماصة للحرارة exothermic عند درجة حرارة 253.36 0م من المحتمل أن تكون عائدة رئيسيًا إلى عملية تخرب البيروكسيكام بعد انصهاره. (الشكل 4). وأظهر مخطط المسح الحراري التفاضلي للكودئين فوسفات (الشكل 5) خطًا بيانيًا يتضمن قمة ماصة للحرارة endothermic عند درجة حرارة 61.51 0م تشير إلى تبخر الماء الموجود ضمن بنية الكودئين فوسفات لأن الملح هيمي هدرات. وأبدى المخطط قمة ماصة للحرارة endothermic عند درجة حرارة 246.34 0م تشير إلى درجة انصهار الشكل البلوري للكودئين فوسفات هيمي هيدرات.
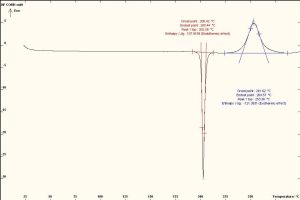
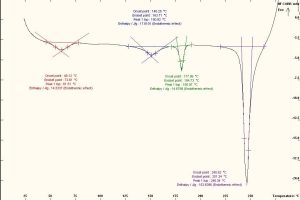
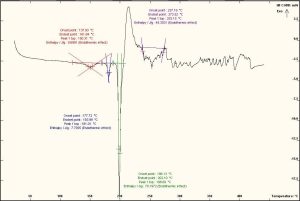
بالعودة إلى مخطط المسح الحراري لمزيج بيروكسيكام وكودئين فوسفات (1/1) (الشكل 6) يظهر لدينا قمة ماصة للحرارة endothermic عند درجة حرارة 80.05 0م تشير إلى تبخر الماء الموجود ضمن بنية الكودئين فوسفات لأن الملح هيمي هدرات، وأظهر المخطط قمة حادة ماصة للحرارة endothermic عند درجة حرارة 198.69 0م تشير إلى انزياح واضح في قمة بيروكسيكام بمقدار 3.89 0م مع تغير واضح جدًا في انتالبية التفاعل بمقدار 37.72 J/g، وأظهر أيضًا قمة شبه حادة ماصة للحرارة عند درجة حرارة 253.15 0م تشير إلى انزياح في قمة كودئين فوسفات بمقدار 6.81 0م مع تغير واضح في انتالبية التفاعل بمقدار 108.34 J/g. من ثمّ يتضح بمخططات DSC والنتائج في اختبار الإجهاد المتساوي حراريًا السابقة أنه هنالك تداخلًا فيزيائيًا صلبًا-صلبًا بين مادة بيروكسيكام ومادة كودئين فوسفات، يؤثر في درجة انصهار كلا المادتين الدوائيتين من دون التأثير في تركيزهما الدوائي.
- المسح الطيفي بالأشعة تحت الحمراء FTIR Spectroscopy: (6)
يوضح الشكل (7) أهم المجموعات الوظيفية الموجودة ضمن البيروكسيكام، وطيف الأشعة تحت الحمراء وهذا ما يتوافق مع دراسة نشرها جابر عام 2013. (12) ويوضح الشكل (8) أهم المجموعات الوظيفية الموجودة ضمن الكودئين فوسفات، وطيف الأشعة تحت الحمراء، إذ أظهر الطيف عصابة اهتزاز تمتد 1900-3000 سم-1 من المحتمل أن تكون عائدة إلى مجموعة الأمين الثالثي، على حين العصابة في الموضع 3460 سم-1 من المحتمل أن تكون عائدة إلى مجموعةOH ضمن الكودئين فوسفات مشكلة روابط هيدروجينية داخل جزيئية ضمن المركب، العصابات الموجودة عند أطوال الموجة 525، 1126، 1263 سم-1عائدة رئيسيًا إلى مجموعات ᶹP=O, ᶹP-O, γP=O، وعصابة الاهتزاز عند الموضع 925 سم-1 من المحتمل أن تكون عائدة ل مجموعةC=H وهذا يتوافق مع دراسة نشرت عام 2006. (13)
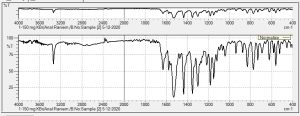

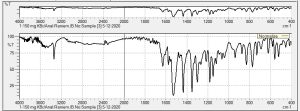
يوضح الشكل (9) نتيجة المسح الطيفي بالأشعة تحت الحمراء لمزيج بيروكسيكام وكودئين فوسفات بنسبة (1/1)، إذ أبدى طيف الـ (FTIR) القمم المميزة الآتية (v, cm-1): 524، 775، 939، 1118، 1149، 1300، 1350، 1435، 1527، 1629، 3336. يلاحظ بقاء عصابات الامتصاص الأساسية البارزة والمميزة للبيروكسيكام مع حصول انزياح (shift) طفيف في مواقعها، نلحظ اختفاء العصابة المميزة في طيف الكودئين فوسفات ضمن طيف المزيج عند العصابة التي تمتد 1900-3000 سم-1 واختفاء عصابة الاهتزاز عند 3460 سم-1 العائدة لمجموعة الهيدروكسيل، مع حصول انزياح واضح بعصابات الامتصاص الأساسية البارزة والمميزة ضمن المركب، هذا يدل على وجود تداخل فيزيائي بين المركبين الدوائيين من ثمّ تدعم نتائج الـ FTIR وجود تداخل بين هاتين المادتين الدوائيتين لدى مزجهما معًا، هذا يتفق مع نتائج المسح التفاضلي الحراري DSC. استبعد وجود تداخل كيميائي بنتيجة دراسة الإجهاد المتساوي حراريًا وأن التخرب الدوائي الحاصل للمادتين الدوائيتين في أثناء الدراسة ضمن الحدود الدستورية.
الفحوص الفيزيائية المطبقة على المضغوطات:
يوضح الجدول (3) نتائج الفحوص المطبقة على المزيج المعد للضّغط مع قيم الانحراف المعياري SD. نلحظ من الجدول (3) أن جميع الصيغ المحضرة جميعها تتمتع بانسيابية جيدة إلى ممتازة.
فحوص المضغوطات القابلة للتفتت بعد عملية الضغط Evaluation of ODTs:
يوضح الجدول (4) نتائج الفحوص المطبقة على المضغوطات القابلة للتفتت في الفم بعد عملية الضغط مع قيم الانحراف المعياري SD.
– ضُبطت آلة الضغط بحيث تتراوح قساوة المضغوطات الناتجة بين (2.5-5 كغ/سم2). أظهرت الصيغ المدروسة جميعها قيم قساوة تتراوح ما بين (2.6-5.13 كغ/سم2)، وكانت قيم الهشاشة جميعها ضمن الحدود المقبولة دستورياً (> 1%).
– بالنسبة إلى فحص اختلاف الوزن كانت القيم تتراوح ما بين (187.15-205.10 ملغ) وهي ضمن شروط القبول الدستورية.
– تراوح قطر المضغوطات المحضرة ضمن هذه الدراسة للصيغ المفحوصة جميعها بين (8.87-8.93) مع العلم أن قطر مكيس آلة الضغط المستخدم (8 ملم)، يمكن أن تعزى الزيادة في قطر المضغوطات بعد عملية الضغط إلى التشوه المرن الحاصل للسواغات والمواد الدوائية. يوضح الجدول (5) قيم زمني التفتت والتبلل ونسبة امتصاص الماء للصيغ التسع المحضرة إذ أبدت الصيغ التسع المحضرة تفاوتًا بزمن التفتت ما بين (6-110) ثانية، أعطت الصيغة F3 التي تحتوي على كروس بوفيدون-XL عند استخدامها بنسبة 7.5% أقل زمن تفتت، إذ لوحظ تناقصًا في زمن التفتت مع تزايد تركيز نسبة هذا العامل المفتت الفائق وهذا التزايد ذو دلالة إحصائية (P<0.05) بالنسبة إلى الصيغ المحضرة جميعها، وهذا يعود رئيسيًا إلى الآلية التي يعمل بها كروس بوفيدون-XL إذ يزيد من مسامية المضغوطة لدى تماسها مع الماء، فهو يعمل مفتتًا فائقًا وفق آلية العبور التي تسمح للقوة الشعرية للمسامات بقبط الماء بعمق لداخل المضغوطة وبالنتيجة تفتتها سريعًا وهذا يتوافق مع بحث نشره Harada وزملاؤه عام 2010(14)، على حين كانت النسبة من الكروس كارميلوز التي أعطت أقل زمن تفتت هي 7.5% في الصيغة F6، ولوحظ أيضًا تناقصًا في زمن التفتت مع تزايد تركيز نسبة هذا العامل المفتت الفائق وهذا التزايد ذو دلالة إحصائية (P<0.05) بالنسبة للصيغ المحضرة جميعها أيضًا.
– لوحظ أن زمن التفتت للصيغ الحاوية على البريموجل (غليكولات نشاء صوديوم) عاملًا مفتتًا فائقًا أبدت تزايدًا في زمن التفتت بتزايد تراكيز هذا العامل المفتت إذ هذا التزايد ذو دلالة إحصائية (P<0.05)، يمكن أن يعزى ذلك رئيسيًا إلى زيادة قساوة المضغوطات المحضرة ضمن هذه الصيغ عن مثيلاتها من الصيغ الأخرى وهذا ما يتوافق مع بحث نشره Harada وزملاؤه عام 2010 عن علاقة زمن التفتت بزيادة الضغط المطبق على المضغوطات القابلة للتبعثر في الفم(14)، ويمكن أن نفسر التزايد الحاصل في زمن التفتت بزيادة تركيز البريموجيل بتشكل طبقة من الهلامة اللزجة حول المضغوطات لدى تماسها مع الماء والتي تشكل حاجزًا لزجًا ثخينًا أمام اختراق وسط التفتت لهذه المضغوطات ومن ثمّ تطاول زمن التفتت، وهذا يتفق مع بحث نشره Setty وزملاؤه عام 2008 (15).


 – تراوحت أزمنة التبلل للصيغ التسع المحضرة بين (3.17-20.76) ثانية، وقد لوحظ وجود ارتباط طردي واضح بين زمني التفتت والتبلل للصيغ من F1 إلى F3 ومن F4 إلى F6، تتفق هذه النتيجة مع النتائج التي توصل إليها P. Hooper وزملاؤه عند دراسة العلاقة بين زمني التفتت والتبلل(16). امتلكت الصيغة F3 الحاوية على كروس بوفيدون-XL بوصفه عاملًا مفتتًا فائقًا أقل قيمة زمن تبلل (3.17 ثانية) بين الصيغ التسع المحضرة جميعها، وهذه القيمة ذو دلالة إحصائية (P<0.05).
– تراوحت أزمنة التبلل للصيغ التسع المحضرة بين (3.17-20.76) ثانية، وقد لوحظ وجود ارتباط طردي واضح بين زمني التفتت والتبلل للصيغ من F1 إلى F3 ومن F4 إلى F6، تتفق هذه النتيجة مع النتائج التي توصل إليها P. Hooper وزملاؤه عند دراسة العلاقة بين زمني التفتت والتبلل(16). امتلكت الصيغة F3 الحاوية على كروس بوفيدون-XL بوصفه عاملًا مفتتًا فائقًا أقل قيمة زمن تبلل (3.17 ثانية) بين الصيغ التسع المحضرة جميعها، وهذه القيمة ذو دلالة إحصائية (P<0.05).
– تراوحت نسبة امتصاص الماء للصيغ المحضرة جميعها بين 71.2% و146.4%، فقد كانت نسبة امتصاص الماء للمضغوطات القابلة للتفتت في الفم للصيغ الحاوية على غليكولات صوديوم النشاء (Primojel) SSG وكروس كارميلوز الصوديوم SCC أعلى من تلك الحاوية على كروس بوفيدون CP، وكانت الصيغ الحاوية على غليكولات صوديوم النشاء SSG تمتلك النسب الأعلى من بين جميع الصيغ في نسبة امتصاص الماء. نلاحظ عند تزايد تركيز العامل المفتت الفائق تتزايد نسبة امتصاص الماء للمضغوطات المحضرة وهذا ما يتوافق مع بحث نشره SK Battu وزملاؤه عام 2007 عند دراسة العلاقة بين نسبة المفتت الفائق المستخدم ونسبة امتصاص الماء.(17)
– انتقيت ثلاث صيغ F3، F6، F7 لمتابعة دراسة اختبار الذوبان وكان المعيار الأساس في الاختيار هو زمن التفتت، إذ اختبرت النسبة والتي أعطت أقل زمن تفتت من كل مفتت، إذ كان زمن التفتت للصيغ F3، F6، F7 هو 6، 8.2، 18.1 ثانية على الترتيب.
- فحص معايرة المحتوى Content uniformity test:
كانت قيم معايرة المحتوى للبيروكسيكام والكودئين فوسفات ضمن الحدود المقبولة دستوريًا (85%-115%)، إذ تراوحت القيم ما بين (99.3%-102.6%) للبيروكسيكام وما بين (99.1%-102.1%) للكودئين فوسفات.
- فحص الذوبان Dissolution test: (18)
- دُرس منحني الذوبان للمضغوطات المحضرة في الصيغ F3، F6، F7 المنتخبة لدراسة تأثير تغير العامل المفتت الفائق وزمن التفتت في تحرر كل من البيروكسيكام والكودئين فُسفات، وذلك في (1، 2، 3، 4، 5، 10) دقيقة ضمن وسط من محلول الوقاء الفسفاتي (pH= 6.8)، الشكلين (10 و11).
- احتُسب الزمن اللازم لتحرر 80% من كمية المادتين الدوائيتين البيروكسيكام والكودئين فُسفات لكل صيغة وذلك باستخدام بيانات ومنحني اختبار الذوبان لهذه الصيغ.
- كان معدل تحرر الكودئين فُسفات والبيروكسيكام من الصيغ المحضرة المنتخبة جميعها مرتفعًا، فقد تحرر 80% من مادة الكودئين فُسفات في (1.33، 1.9، 2.75) دقيقة والبيروكسيكام في (2.25، 2.63، 2.95) دقيقة بالنسبة إلى الصيغ F3، F6، F7 على الترتيب. لوحظ تشابه تحرر مادة الكودئين فُسفات والبيروكسيكام من كلا الصيغتين F3، F6 الشكلين (7 و8)، إذ يمكن تفسير هذه النتيجة بأن كروس كارميللوز الصوديوم يساعد على تفتيت المضغوطات ويعطي أجزاء أصغر من تلك الناتجة عن الكروس بوفيدون، في حين الكروس بوفيدون يعطي أجزاء أكبر عند تفتته ولكنه يتفتت بشكل أسرع، لذا كانت مرتسمات الذوبان متشابهة للصيغ الحاوية على كروس بوفيدون وكروس كارميللوز الصوديوم كعامل مفتت فائق، كان معدل الذوبان لكلا المادتين الدوائيتين في الصيغة F7 الحاوية على البريموجيل أقل مما عليه في الصيغ F3 وF6، يمكن تفسير هذه النتيجة بأن غليكولات نشاء الصوديوم (البريموجيل) يفتت المضغوطات بشكل أبطأ بإعطاء جزيئات كبيرة الحجم مقارنةً بكروس بوفيدون وكروس كارميللوز الصوديوم، هذا يتفق مع دراسة نشرهاZaho وزملاؤه عام 2005 م.(19)
- أبدت الصيغ المحضرة المنتخبة F3، F6، F7 تحررًا أسرع لمادة الكودئين فُسفات مقارنةً بتحرر البيروكسيكام وذلك في أول أربع دقائق من هذا الاختبار، ويمكن أن يعزى ذلك إلى الانحلالية العالية والسريعة للكودئين فُسفات مقارنةً بالبيروكسيكام إذ إن الكودئين فُسفات يصنّف ضمن الصنف الأول للأدوية Class l، فضلًا عن الانحلالية العالية للبيروكسيكام ضمن وسط الذوبان المستخدم (وقاء فسفاتي pH=6.8) مع أنه يصنف ضمن الصنف الثاني Class ǁ وفق نظام التصنيف الصيدلاني الحيوي.(20)


الاستنتاجات Conclusions
- دُرست التآثرات والتداخلات المحتملة بين المواد الدوائية بدراسة كل من مخططات الـ DSC ومخططات الـ FTIR الناتجة، ومن ثم أجريت دراسة الثبات المسرع في شروط (40°C/75% RH) في 6 أشهر وفق توصيات الـ ICH، وبعدها حُللت المواد الدوائية كميًا باستخدام جهاز (HPLC)، بينت نتائج هذه الدراسة وجود تنافر فيزيائي بين البيروكسيكام والكودئين فوسفات، واستبعد وجود التنافر الكيميائي بعد أن دُرس الثبات المسرع للمادتين الدوائيتين ومزيجهما وبقاء المحتوى الدوائي ضمن الحدود الدستورية.
- أبدت الصيغة 3F نتائج مثالية من إذ الفحوص الفيزيائية، إذ كان زمن التبلل 3.17 ثانية وزمن التفتت 6 ثانية، بالنسبة إلى نتائج معايرة المادتين الدوائيتين ضمن الصيغ التسع المحضرة فقد تراوحت النسبة المئوية للبيروكسيكام ما بين (3%-102.6%) وللكودئين فوسفات بين (99.1%-102.1%) وهي ضمن الحدود الدستورية التي نص عليها دستور الأدوية الأمريكي (85-115%).
- كون هذه الدراسة أولية بالنسبة إلى مشاركة البيروكسيكام والكودئين فُسفات، نقترح متابعة الدراسة في العضوية الحية In-vivo للمضغوطات في الصيغ المنتخبة المحضرة F3، F6، F7 ودراسة التوافر الحيوي للبيروكسيكام والكودئين فُسفات من هذه المضغوطات والتأكد من تحسن التوافر الحيوي لهاتين المادتين الدوائيتين وذلك عند صياغتهما بمضغوطات قابلة للتفتت في الفم، ومن ثم مقارنة هذه النتائج ودراسة مدى ارتباطها مع نتائج التحرر في الزجاج In-vitro.
- أعطى المفتت الفائق الكروس بوفيدون أقل زمن تفتت بين الصيغ جميعها وذلك عند استخدامه بتركيز 7.5%.
- أعطى غليكولات نشاء الصوديوم أكبر زمن تفتت بين الصيغ جميعها وذلك عند استخدامه بتركيز 7.5%.
- احتُسب الزمن اللازم لتحرر 80% من كمية المادتين الدوائيتين البيروكسيكام والكودئين فُسفات لكل صيغة وذلك باستخدام بيانات ومنحني اختبار الذوبان لهذه الصيغ.
- كان معدل تحرر الكودئين فُسفات والبيروكسيكام من الصيغ المحضرة المنتخبة جميعها مرتفعًا، فقد تحرر 80% من مادة الكودئين فُسفات في (1.33، 1.9، 2.75) دقيقة والبيروكسيكام في (2.25، 2.63، 2.95) دقيقة بالنسبة إلى لصيغ F3، F6، F7 على الترتيب.
- Al-Khattawi A, Mohammed AR. Compressed orally disintegrating tablets: excipients evolution and formulation strategies. Expert Opin Drug Deliv. 2013;10(5):651-663.
- Hirani JJ, Rathod DA, Vadalia KR. Orally disintegrating tablets: a review. Trop J Pharm Res. 2009;8(2):161-172.
- Comoglu T, Bahadori F. Granulation and Production Approaches of Orally Disintegrating Tablets. In: Handbook of Pharmaceutical Granulation Technology. CRC Press; 2021:555-574.
- Wiedey R, Kokott M, Breitkreutz J. Orodispersible tablets for pediatric drug delivery: current challenges and recent advances. Expert Opin Drug Deliv. 2021;18(12):1873-1890.
- Ravi Kiran N, Palanichamy S, Rajadhas Tg, Thanga Thirupathi A. Formulation and Evaluation of Orodispersible Piroxicam Tablets.
- Liltorp K, Larsen TG, Willumsen B, Holm R. Solid state compatibility studies with tablet excipients using non thermal methods. J Pharm Biomed Anal. 2011;55(3):424-428.
- Kiran NR, Palanichamy S, Rajesh M, et al. Formulation and evaluation of orodispersible piroxicam tablets. J Pharm Sci & Res. 2010;2(10):615-621.
- United States Pharmacopeia 43، National Formulary 38 Rev. United States Pharmacopeial Convention, 2020.
- Tafere C, Yilma Z, Abrha S, Yehualaw A. Formulation, in vitro characterization and optimization of taste-masked orally disintegrating co-trimoxazole tablet by direct compression. PLoS One. 2021;16(3):e0246648.
- Ceschel GC, Badiello R, Ronchi C, Maffei P. Degradation of components in drug formulations: a comparison between HPLC and DSC methods. J Pharm Biomed Anal. 2003;32(4-5):1067-1072.
- Ammanage A, Rodriques P, Kempwade A, Hiremath R. Formulation and evaluation of buccal films of piroxicam co-crystals. Future Journal of Pharmaceutical Sciences. 2020;6(1):1-11.
- Jabbar ASA, Hussein AA. Formulation and evaluation of piroxicam liquisolid compacts. Int j pharm. 2013;5(1):132-141.
- Bakalska R, Ivanova B, Kolev T. Solid-state IR-LD spectroscopy of codeine and N-norcodeine derivatives. Open Chemistry. 2006;4(3):533-542.
- Harada T, Narazaki R, Ohwaki T, Uchida T. Effect of physical properties of orally disintegrating tablets on disintegration time as determined by a new apparatus. J Drug Deliv Sci Technol . 2010;20(5):377-383.
- Setty CM, Prasad DVK, Gupta VRM, Sa B. Development of fast dispersible aceclofenac tablets: effect of functionality of superdisintegrants. Indian J Pharm Sci. 2008;70(2):180.
- Brniak W, Jachowicz R, Pelka P. The practical approach to the evaluation of methods used to determine the disintegration time of orally disintegrating tablets (ODTs). Saudi Pharm J. 2015;23(4):437-443.
- Battu SK, Repka MA, Majumdar S, Rao Y M. Formulation and evaluation of rapidly disintegrating fenoverine tablets: effect of superdisintegrants. Drug Dev Ind Pharm. 2007;33(11):1225-1232.
- Kiran NR, Palanichamy S, Rajesh M, et al. Formulation and evaluation of orodispersible piroxicam tablets. Journal of Pharmaceutical Sciences and Research. 2010;2(10):615.
- Zhao N, Augsburger LL. Functionality comparison of 3 classes of superdisintegrants in promoting aspirin tablet disintegration and dissolution. AAPS pharmscitech. 2005;6(4):E634-E640.
- Shohin IE, Kulinich JI, Ramenskaya GV, Abrahamsson B, Kopp S, Langguth P, Polli JE, Shah VP, Groot DW, Barends DM, Dressman JB. Biowaiver monographs for immediate release solid oral dosage forms: piroxicam. J. Pharm. Sci. 2014 Feb 1;103(2):367-77.