دراسة في الزجاج لتوزع أبعاد جسيمات الجرعة المحررة لصيغ مطورة خالية من الايتانول لأشكال ارذاذية معايرة الجرعة حاوية على السالبوتامول سلفات (دراسة ثبات مُسرّع)
2023-01-01 | المجلد السابع العدد الأول - المجلد السابع | مقالات بحثيةعلاء فيصل الضابط | محمد هارون | معروف الخيّر | وسيم عبد الواحد
الملخص
تم في هذا البحث استخدام PEG400 و Isopropyl Myreistate (IPM) كمحلات مساعدة مقترحة بديلة للايتانول بتراكيز (1-3-5%) وتم التوصل إلى أن PEG400(1%) هو المحل المساعد المحتمل اعتماداً على نتائج الفحص العياني وفحص توزع أبعاد الجسيمات في الزجاج (عدد العبوات =5). تم تحضير الصيغ المقترحة الخالية من الايتانول بحيث تحتوي على نسبة ثابتة من سلفات سالبوتامول و PEG400(1%) كـS-PEG400 وتم إضافة عوامل لزيادة ثبات المعلق إلى الصيغة السابقة كحمض الزيت(0.01%) كعامل فعال على السطح في S-PEG400-OA وPVP-k30(0.0001%) كعامل معلق في S-PEG400-PVP. تم إجراء دراسة ثبات مُسرّع في الزجاج (40°C/75%RH) لتوزع أبعاد الجسيمات في النقاط (0-3-6) أشهر ومقارنة النتائج مع صيغة الشاهد الحاوية على الايتانول (%10) S-ETOH وتحليل النتائج إحصائياً باستخدام اختبار t-student. أظهرت النتائج أن PEG400(1%) بديل جيد للايتانول بوجود PVP-k30(0.0001%) حيث أن نسبة الجسيمات الواصلة إلى الرئة لـ S-PEG400-PVP أكبر من 35% والقطر الهوائي الحركي يقع ضمن (1-5µ) ولا يوجد أي تأثير هام ذي دلالة إحصائية عند المقارنة مع صيغة الشاهدS-ETOH (p-value˃0.05).
كلمات مفتاحية : سلفات سالبوتامول ، شكل اراذاذي معاير الجرعة، ايتانول, فحص توزع أبعاد الجسيمات, ثبات مُسّرع.
المقدمة Introduction:
يعد السبيل التنفسي أحد أهم طرق إيتاء الدواء نظراً لما تتمتع به الرئة من مساحة كبيرة معدة للامتصاص (100م2) , كما أنه يجنب الدواء المرور الكبدي الأول, مما يساعد المرضى في الحصول على تأثير علاجي بأقل جرعة ممكنة وأقل تأثير جانبي ممكن.1, 2 إن أول استخدام للأشكال الارذاذية معايرة الجرعة Metered Dose Inhaler(MDI) يعود لعام 1956 , حيث تمكنت مختبرات Riker من استخدام Medihaler في علاج الربو والداء الرئوي الانسدادي المزمن.3, 4 تتألف لـMDI من مكونات عديدة, كل منها ضروري لجودة عمل الشكل الارذاذي وهي :
-1 الغاز الدافع (propellant).
-2 الوعاء الحاوي (canister).
-3الصمام (valve).
-4المشغل ( actuator, adaptor, mouthpiece).
-5الصيغة الصيدلانية ( formulation).5
يعتبر الغاز الدافع المكون الأساسي للـ MDI, ولقد تطور استخدامه تطوراً كبيراً, حيث استخدمت في البداية غازات Chloro Flouro Carbon (CFC), والتي تم سحبها نهائياً من الأسواق بعد صدور بروتوكول Monterial عام 1978 نتيجة لتأثيراتها الضارة على طبقة الأوزون.6, 7 تضافرت جهود الشركات الدوائية في البحث عن غازات بديلة صديقة للبيئة, وتم التوصل إلى أن غازات Hydro Flouro Alkane(HFA-134 /HFA227) بدائل جيدة للـ CFC 8. إن الانتقال من CFC إلى HFA تطلب العديد من الأبحاث نتيجة الاختلاف في الخواص الفيزيوكيميائية لكل منهما, مما أدى إلى ضرورة إجراء بعض التغيرات في التصميم الهندسي للـ MDI كالصمام و المشغل (actuator), وضرورة إجراء تعديل في الصياغة الصيدلاينة والبحث عن سواغات جديدة ذوابة ضمن الغاز الدافع الجديد. 6 تعتبر العوامل الفعالة على السطح (Surfactants) مثلsorbitan trioleate وحمض الزيت oleic acid و lecithin من أهم السواغات الداخلة في صياغة MDI, حيث تلعب دوراً هاماً في منع تشكل التكتلات(agglomerates) ومنع ظاهرة النمو البلوري (crystal growth) بالإضافة لدورها المزلق للصمام (lubricant) لكنها ذات انحلالية منخفضة ضمن غازات HFAs مقارنة بـ CFCs ويمكن تحسين هذه الانحلالية بإضافة محلات مساعدة (co-solvent) مثل الايتانول. 9-11
الايتانول هو أكثر المحلات المساعدة المستخدمة شيوعاً في MDI وتشير الدراسات إلى أن نسبة الايتانول في الصيغة يجب أن تكون مدروسة بدقة وإن أي زيادة في تركيز الايتانول ينجم عنه نقصان في كثافة وضغط بخار الصيغة مما يؤثر على عملية الارذاذ, ويؤدي لتشكل قطيرات كبيرة الحجم تتوزع في التجويف البلعومي الفموي 12, كما يعتبر الايتانول المسؤول عن الطعم السيئ للـ (MDI)13 , وتعزى إليه مشكلة السعال بعد تناول الجرعة14, وإيجابية فحص الكحول خلال (1-3) دقيقة من تناول الجرعة15. تعتبر MDI الحاوية على السالبوتامول سلفات ناهض 2ß قصير الأمد الخط العلاجي الأول في تدبير نوبات الربو الحادة وهي مسوقة بشكل معلقات.16 إن الدراسات المتوفرة عن تحضير MDI للسالبوتامول سلفات خالية من الايتانول قليلة جداً ,ومحمية ببراءات اختراع حيث تمكن Da Rocha et al من إعادة صياغة معلق سالبوتامول سلفات باستخدام عامل فعال على السطح LAm Eon LAm 17, كما تمكن Fassberg et al من الوصول إلى صيغ ثابتة باستخدامoleic acid , و Miglyol840 , و transcutol , ولكن أي من هذه الصيغ لم تسوق بعد18. كما اتجه الباحثون الى هندسة الجزيئات حيث نجح Arafa et al من تحضير MDI حاوية على السالبوتامول سلفات بشكل niosomes 19, كما تمكن Dellamary et al من تحضير جسيمات مسامية محبة للدسم (pulmosphere) للسالبوتامول سلفات ولكن هذه الجسيمات مازالت قيد التطوير , ولم تحصل على الموافقات اللازمة لطرحها في الأسواق20. سيتم في هذه الدراسة تحضير صيغ لـ MDI باستخدام محلات مساعدة بديلة للايتانول مثل PEG400 , و Isopropyl Myreistate (IPM) , ومراقبة جودة الصيغ المقترحة في الزجاج in-vitroلاختيار المحل المساعد الأمثل من خلال دراسة توزع أبعاد الجسيمات Aerodynamic particle size distribution (APSD) باستخدام جهاز Next generation cascade impactor (NGI) واستخدام هذا المحل في تطوير صيغة جديدة خالية من الايتانول باتباع استراتيجيات صياغة مختلفة كإضافة حمض الزيت كعامل فعال على السطح أو إضافة (PVP k-30) كعامل معلق و اجراء دراسة ثبات مسرع (accelerated) ضمن الشروط التالية (40°C/75%RH) لتحديد توزع أبعاد جسيمات الجرعة المحررة للصيغ الجديدة خلال النقاط (0-3-6 ) أشهر و مقارنة النتائج مع صيغة الشاهد(control) الحاوية على ايتانول بنسبة (10%). يُستخدم جهاز NGI الظاهر في الشكل(1) لدراسة APSD , وهو يتألف من سبع مراحل و فلتر نهائي , حيث يعتبر NGI جهازاً محاكياً لبنى السبل التنفسي ومناسباً للعمل بمعدل تدفق هواء من (15-100 litre/min) 21, وهو معتمد من قبل العديد من الدساتير, وهيئات الرقابة الدوائية كفحص في الزجاج (in-vitro) 22 , حيث يعبَر عنAPSD بمجموعة من المعايير أهمها القطر الهوائي الوسطي لتوزع أبعاد الجسيمات Mass median aerodynamic diameter(MMAD) , و تشير الدراسات إلى إن قيم MMAD يجب أن تكون (1-5µ) للحصول على افضل تأثير دوائي, أي أن الجسيمات ذات (MMAD˃5µ) تعلق في التجويف البلعومي الفموي, بينما الجسيمات ذات (MMAD ˂ 1 µ) تخرج مع هواء الزفير دون أن تحدث أي تأثير دوائي, كما يعبر أيضاً عن APSD بمقدار الجرعة المحررة القادرة على الوصول إلى الرئةFine Particle Mass (FPM) أي كمية المادة الدوائية ذات MMAD من (1-5µ) كما يعبّر أيضاً عن فحص APSD بـنسبة الجسيمات القادرة على الوصول إلى الرئة Fine Particle Fraction(FPF) , وهي نسبة الجسيمات ذات MMAD من (1-5µ) من إجمالي الجرعة المحررة و من ضمن المعايير التي يمكن الحصول عليها من فحص APSD الانحراف المعياري الهندسي Geometric Standard Deviation (GSD).23

المواد والطرائقMaterials and Methods
- المواد المستخدمة
- سالبوتامول سلفات العياري BP302 (99.8%)صنع شركة Merck ألمانيا, و سالبوتامول سلفات مادة أولية ذات أبعاد (95% = 4.31µm) صنع شركة Jayco (63%) رقم طبخة SS/161/17-18 الهند.
- PEG400 صنع SHANDONG رقم الطبخة 8734-37 الصين, وEthanol (99.9%) صنع Sasol Chemicals رقم الطبخة 92039194 جنوب إفريقيا, و Oleic Acid صنع Quimica رقم الطبخة TQ0338 المكسيك, وHFA134a صنع Zephex رقم الطبخة BR16442-8 المملكة المتحدة.
- عبوات معدنية مصنوعة من الألمنيوم صنع PRESSPART رقم الطبخة PPB0021987 المملكة المتحدة والصمام معاير الجرعة سعة 50µL رقم الطبخة /00242091 والحاضنة رقم الطبخة Coaster71298/001 صنع إيطاليا.
- عبوات PET vial-MRX002 صنع Merxin رقم الطبخة MR547 المملكة المتحدة.
- Lichrosolv® (Methanol) (99.8%) و(98.0%) Emsure® (Ammonium Acetate) صنع Merk ألمانيا.
- الأجهزة المستخدمة
تم في هذه الدراسة استخدام جهاز الكروماتوغرافيا السائلة عالية الأداء نوع MERCK-HITACHI LaChrom L-7000 series صنع ألمانيا , وجهاز قياس توزع أبعاد الجسيمات Next Generation Cascade Impactor صنع Copley المملكة المتحدة ,وجهاز الأمواج فوق الصوتية sonicator صنع Liarre إيطاليا ,وحجرة ثبات نوع Memmert M-750 صنع ألمانيا ,وميزان حساس(0.0001غ) نوع Precisa XB220A صنع سويسرا.
- الطرق
1-3- شروط الكروماتوغرافيا السائلة عالية الأداء
تمت المعايرة باستخدام طريقة الكروماتوغرافيا السائلة عالية الأداء (HPLC) الواردة ضمن دستور الأدوية البريطاني (BP2013), حيث تم استخدام عمود Lichrocart®100RP-18(5µmx10-cm) وطور متحرك مكون من مزيج (Methanol: Amonioum Acetate 0.1%W/ V)( 800ml:225ml), كما تم ضبط معدل التدفق 2ml/minute وطول موجة الكشف على 276 nm وتم حقن عينة 20µl عند كل تحليل.
2-3- طريقة العمل
1-2-3- اختيار المحل المساعد والسواغات المناسبة:
- تحتوي صيغة الشاهد S-ETOH على سالبوتامول سلفات و حمض الزيت و ايتانول و HFA134a.
- تم استخدام PEG400 وIPM كمحلات مساعدة مقترحة بديلة للايتانول في صيغة الشاهد.
- تم تعبئة الصيغ المقترحة الحاوية على (1-3-5%) من المحلات المساعدة البديلة PEG400 و IPM و نسب ثابتة من السالبوتامول سلفات و حمض الزيت(5 عبوات معدنية و عبوتين PET).
- تم تعبئة صيغة الشاهد S-ETOH الحاوية على (10%) من الايتانول (5 عبوات معدنية و عبوتان (PET.
- كل الصيغ المعبأة تحرر(108mcg) بالجرعة الواحدة و كل عبوة تحتوي على 200 جرعة.
- تم استخدام بروتوكول الفحص العياني (visual observation) لاختيار النسبة المحتملة من المحل المساعد.
- تم استخدام عبوة جديدة لتحديد دراسة توزع أبعاد الجسيمات APSD للعبوات التي اجتازت الفحص العياني ليتم اختيار المحل المساعد الأمثل (عدد العبوات = 5).
- تم تعبئة الصيغ المقترحة التالية الحاوية على نسبة ثابتة من السالبوتامول سلفات والمحل المساعد الجديد باستخدام عوامل تساعد على ثبات المعلق كحمض زيت و PVP-k30 .
- إجراء دراسة ثبات مسرع (40°C/75%RH) و دراسة توزع أبعاد الجسيمات للعبوات السابقة باستخدام جهاز NGI خلال النقاط التالية (0,3,6 أشهر) و مقارنتها مع صيغة الشاهد S-ETOH .
2-2-3- فحص توزع أبعاد جسيمات الجرعة المحررة باستخدام جهاز NGI
- ضبط معدل تدفق الهواء لجهاز NGI على 30 لتر/ دقيقة وهو المعدل المناسب للحصول على أفضل تأثير دوائي للـMDI .
- إجراء عملية تحضير للعبوة(priming) من خلال تحرير أربع جرعات في الهواء وفق الشروط الواردة حسب كل تحليل.
- تحرير عشر بخات من عبوة MDI داخل جهاز NGI. .
- غسل كل مرحلة من مراحل جهاز NGI باستخدام 5ml من الوقاء و 10مل ميتانول.
- وضع الارلنماير في جهاز الأمواج فوق الصوتية لمدة عشر دقائق.
- نقل العينة الى بالون معايرة سعة 50ml وثم إكمال إلى خط العيار باستخدام الميتانول.
- وضع البالون في جهاز الأمواج فوق الصوتية مدة خمس دقائق ثم نقل العينة إلى فيال الحقن مع العنونة.
- حقن المحلول العياري ثلاث مرات لنحصل على ملاءمة الجهاز.
- حقن 20 µl من العينة و حساب التركيز.
3-3- الدراسة الإحصائية
تم تحليل النتائج إحصائياً باستخدام برنامج JMP 13.2 عند مستوى دلالة (α =0.05) وفق Comparative each pair (t-Student).
النتائج والمناقشة:
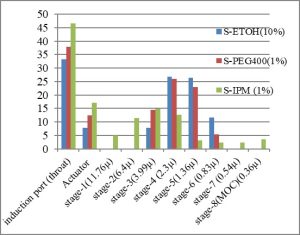
تم تحضير صيغة الشاهدS-ETOH , والصيغ المقترحة الحاوية على PEG400 و IPM كمحلات مساعدة بديلة للايتانول من خلال تثبيت كافة مكونات الصيغة, واستبدال الايتانول بتراكيز متزايدة (1-3-5%) من PEG400 و IPM. كما تمت مراقبة عبوات PET المعبأة عيانياً ومقارنتها مع S-ETOH(10%) لاستبعاد الصيغ الحاوية على تكتلات صعبة البعثرة أو التصاقات بجدران العبوة, حيث تشير النتائج أن S-PEG400(1%) و S-IPM (1%) قد تكون محلات مساعدة بديلة للايتانول كما يظهر الشكل(2). تمت دراسة توزع أبعاد جسيمات الجرعة المحررة in-vitro باستخدام جهاز NGI لكل من الصيغ S-ETOH(10%) و S-PEG400(1%) و S-IPM(1%) بعد تحرير 4 جرعات في الهواء , وضبط معدل تدفق الهواء لجهاز NGI على 30 لتر/ دقيقة وتحرير 10 جرعات ضمن جهازNGI , وتحليل العينات العائدة لمراحل الجهاز و القطعة الفموية باستخدام جهاز HPLC عند طول موجة (276nm) , وتكرار العملية بالنسبة للعبوة التالية (عدد العبوات = 5) , والنتائج التي حصلنا عليها موضحة في الجدول(1).

|
الجدول (1): نتائج فحصAPSDلكل منS-ETOH (10%)وS-PEG400(1%)وS-IPM(1%) |
|||
|
NGI Stages |
S-ETOH(10%) ± SD |
S-PEG400(1%) ± SD |
(S-IPM 1%) ± SD |
| induction port (throat) | 33.34 ± 2 | 37.97 ± 2.36 | 46.67 ± 1.35 |
| Actuator | 7.88 ± 1.2 | 12.53 ± 1.75 | 17.20 ± 1.44 |
| stage-1(11.76µ) | NOT DETECTED | NOT DETECTED | 4.94 ± 0.73 |
| stage-2(6.4µ) | NOT DETECTED | NOT DETECTED | 11.53 ± 0.96 |
| stage-3(3.99µ) | 7.71 ± 1.64 | 14.56 ± 1.48 | 14.91 ± 0.18 |
| stage-4 (2.3µ) | 26.77 ± 1.36 | 26.06 ± 1.45 | 12.56 ± 0.7 |
| stage-5(1.36µ) | 26.30 ± 3.6 | 22.93 ± 1.50 | 3.22 ± 0.51 |
| stage-6 (0.83µ) | 11.70 ± 1.25 | 5.31 ± 1.04 | 2.26 ± 0.64 |
| stage-7 (0.54µ) | NOT DETECTED | NOT DETECTED | 2.39 ± 0.04 |
| stage8(MOC)(0.36µ) | NOT DETECTED | NOT DETECTED | 3.63 ± 0.49 |
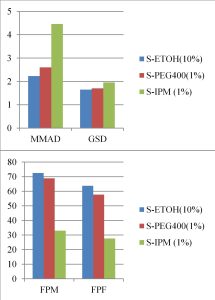
| FPM | 72.50 ± 3.08 | 68.86 ± 2.49 | 32.97 ± 1.46 |
| FPF | 63.75 ± 1.72 | 57.7 ± 1.72 | 27.61 ± 1.62 |
| MMAD | 2.23 ± 0.06 | 2.6 ± 0.09 | 4.46 ± 0.08 |
| GSD | 1.64 ± 0.07 | 1.70 ± 0.025 | 1.96 ± 0.01 |
من الواضح في الشكل (3) أن كمية السالبوتامول سلفات العائدة لـ S-IPM(1%) المتوضعة ضمن القطعة الفموية للـMDI وthroat الخاصة بجهاز NGI أكبر من الكمية العائدة لـ S-PEG400(1%) و S-ETOH(10%) , كما إن نسبة السالبوتامول سلفات العائدة لـ S-IPM(1%) والمتوضعة ضمن المرحلتين الأولى والثانية من جهاز NGI تعادل (15%) من إجمالي الجرعة المتحررة, بينما لا تعلق على الإطلاق جسيمات السالبوتامول سلفات العائدة لكل من S-PEG400(1%) و S-ETOH(10%) ضمن المرحلتين الأولى و الثانية, وهذا دليل على أن S-IPM(1%) تملك أبعاد جسيمات أكبر بالمقارنة مع S-PEG400(1%) و S-ETOH(10%). تم استخدام برنامج C.I.T.D.A.S الخاص بجهاز NGI في حساب المعاملات الخاصة بفحص APSD , والنتائج التي حصلنا عليها موضحة في الشكل(4) , حيث تُظهر النتائج أن S-IPM(1%) يملك أقل قيمة لـ FPF و FPM و أعلى قيمة لـ MMAD , حيث أن قيمة FPF لـ S-IPM(1%) تساوي (27.61 ± 1.62 %) أي أن S-IPM(1%) هي الأقل قدرة على إحداث تأثير دوائي كون أقل من 35% من الجرعة المحررة قادرة على الوصول إلى الرئة, بالإضافة إلى أن S-IPM(1%) تملك(4.46 ± 0.08µ) MMAD= وهي قريبة من الحدود العليا لأبعاد الجسيمات القادرة على إحداث تأثير دوائي (1-5µ) , بينما S-PEG400(1%) تملك FPF أكبر من 35% , وتملك MMAD=(2.6 ± 0.09µ) و تحقق المتطلبات الدستوريةBP2013 .
تم تحليل النتائج إحصائياً باستخدام اختبار t-student , حيث تشير الدراسة الإحصائية إلى أن لنوع المحل المساعد المستخدم تأثيراً هاماً ذا دلالة إحصائية على FPF و FPM و MMAD و GSD (p-value < 0.05). وبالتالي فإن 1%))PEG400 هو المحل المساعد الأمثل الذي سيتم استخدامه في تحضير الصيغ التالية الخالية من الايتانول وفق الجدول (2).
|
الجدول (2): يوضح الصيغ المقترحة الجديدة الحاوية على(1%)PEG400 ونوع العامل المساعد على ثبات المعلق المستخدم |
||
|
Percentage (%) |
Stabilizer Type |
Formulation |
|
None |
None |
S-PEG400 |
|
0.01 |
Oleic Acid |
S-PEG400-OA |
|
0.0001 |
PVP-k30 |
S-PEG400-PVP |
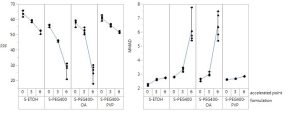
تمت تعبئة الصيغ الجديدة الخالية من الايتانول والحاوية على المحل المساعد البديل وفق الجدول(2), كما تم إجراء دراسة ثبات مسرع في (40°C/75%RH) للصيغ السابقة من ناحية توزع أبعاد جسيمات الجرعة المحررة باستخدام جهاز NGI في النقاط (0-3-6) أشهر , ومقارنة النتائج مع صيغة الشاهد S-ETOH من خلال إجراء عملية تحضير للعبوة , واقتطاع العينة المؤلفة من عشر جرعات , وتحديد محتواها باستخدام جهاز HPLC(عدد العبوات=5) , والنتائج التي حصلنا عليها موضحة في الجدول (3).
|
الجدول(3): نتائج دراسة الثبات المسرع من ناحية توزع أبعاد جسيمات الجرعة المتحررة للصيغ المقترحة المدروسة. |
|||||
| Formulation
Type |
Accelerated point(month) |
FPM ± SD (Micro gram) |
FPF ± SD (%) |
MMAD ± SD (micron) |
GSD ± SD |
| S-ETOH |
0 |
72.50 ± 3.08 |
63.75 ± 1.72 |
2.23 ± 0.06 |
1.64 ± 0.07 |
| S-PEG400 |
0 |
56.15 ±2.22 |
56.02 ± 0.65 |
2.77 ± 0.02 |
1.67 ± 0.05 |
| S-PEG400-OA |
0 |
68.86 ± 2.49 |
57.7 ± 1.72 |
2.6 ± 0.09 |
1.70 ± 0.025 |
| S-PEG400-PVP |
0 |
64.44 ± 4.58 |
61.12 ± 1.44 |
2.62 ± 0.023 |
1.56 ± 0.044 |
| S-ETOH |
3 |
58.81 ± 2.20 |
59.13 ± 0.6 |
2.62 ± 0.03 |
1.6 ± 0.03 |
| S-PEG400 |
3 |
40.39 ± 1.22 |
46.13 ± 0.54 |
3.33 ± 0.13 |
1.67 ± 0.02 |
| S-PEG400-OA |
3 |
53.01 ± 4.14 |
52.45 ± 1.81 |
3 ± 0.1 |
1.76 ± 0.07 |
| S-PEG400-PVP |
3 |
58.23 ± 2.4 |
56.28 ± 0.79 |
2.68 ± 0.01 |
1.56 ± 0.04 |
| S-ETOH |
6 |
51.9 ± 2.4 |
52.29 ± 1.02 |
2.75 ± 0.02 |
1.85 ± 0.08 |
| S-PEG400 |
6 |
7.68 ± 2.68 |
28.25 ± 4.26 |
6.11 ± 0.95 |
2.98 ± 0.5 |
| S-PEG400-OA |
6 |
3.38 ± 0.96 |
25.71 ± 4.8 |
6.45 ± 0.89 |
3.01 ± 0.43 |
| S-PEG400-PVP |
6 |
53.96 ± 1.62 |
51.84 ± 0.64 |
2.85 ± 0.02 |
1.59 ± 0.03 |
تشير النتائج الواردة في الجدول السابق إلى أن جميع الصيغ المدروسةS-PEG400 و S-PEG400-OA وS-PEG400-PVP تمكنت من اجتياز نقطة الثبات الأولى(النقطة صفر) والثانية(ثلاثة أشهر) حيث أن قيمة FPF لكل الصيغ السابقة في كلا النقطتين أكبر من 35% , كما أن قيمة MMAD للصيغ السابقة في كلا النقطتين تقع ضمن المجال (1-5µ) , أي أن كل الصيغ السابقة قادرة على اجتياز المتطلبات الدستورية في نقطة الثبات الأولى و الثانية بينما تشير النتائج إلى أن S-PEG400 و S-PEG400-OA لم تتمكن من اجتياز نقطة الثبات الثالثة (ستة أشهر), حيث أن قيمة FPF لـ S-PEG400 تساوي (28.25±4.26%) و لـ S-PEG400-OA تساوي (25.71 ± 4.8%), حيث تشير قيم FPF إلى أن كلاً من S-PEG400 وS-PEG400-OA غير قادرة على إحداث تأثير دوائي كون أقل من 35% من الجرعة المحررة قادرة على الوصول إلى الرئة (FPF˂35%) ,كما تظهر نتائج دراسة الثبات بعد مضي ستة أشهر أن S-PEG400 تملك قيمة MMAD تساوي (6.11±0.95µ) كما أن قيمة MMAD لـ S-PEG400-OA بلغت (6.45±0.89µ) , أي أن قيمة MMAD لكلٍ من S-PEG400 و S-PEG400-OA تقع خارج المجال المسموح به دستورياً (1-5µ) مما يزيد من مقدار الجرعة المتحررة المتوزعة ضمن التجويف البلعومي الفموي و يقلل من الجرعة الواصلة إلى الرئة, وهذا ما تعكسه قيم FPF لكلا الصيغتين.
بينما تشير النتائج إلى أن S-PEG400-PVP تمكنت من اجتياز نقاط الثبات الثلاث لدراسة الثبات المسرع (40°C/75%RH) في الزجاج من ناحية دراسة توزع أبعاد الجسيمات, حيث أن قيمة FPF للصيغة المدروسة أكبر من 35% , حيث بلغت قيمة FPF في النقطة صفر (61.12 ± 1.44%) وفي النقطة الثانية بعد مضي ثلاثة أشهر (56.28 ± 0.79%) وفي النقطة الثالثة بعد مضي ستة أشهر(51.84 ± 0.64%) , كما أن قيمةMMAD للصيغة السابقة تقع ضمن المجال المسوح به دستورياً (1-5µ) , حيث بلغت قيمةMMAD في النقطة صفر (2.62 ± 0.023µ) , وفي النقطة الثانية (2.68 ± 0.01µ) , وفي النقطة الثالثة (2.85 ± 0.02µ) , والنتائج التي حصلنا عليها موضحة في الشكل(5).
يعزى ذلك إلى دور PVP-k30 في الصيغة, حيث تقوم جزئيات PVP-k30 بالادمصاص بشكل فيلم دقيق على سطح جزيئات السالبوتامول سلفات بشكل فيلم دقيق ممايسبب إعاقة فراغية تعمل على منع الجزيئات من التماس مع بعضها وبالتالي منع تشكل تجمعات كما أن إضافة PVP-k30 يزيد من لزوجة الصيغة الصيدلانية مما يقلل من معدل ترسيب جزيئات السالبوتامول وفق قانونStokes مما يزيد من ثبات المعلق.24
تم إجراء دراسة إحصائية باستخدام اختبار t-Student للمقارنة بينS-PEG400 و S-PEG400-OA و S-PEG400-PVP مع صيغة الشاهد S-ETOH عند مستوى دلالة (=0.05α) , والنتائج التي حصلنا عليها موضحة في الجدول(4).
|
الجدول(4): نتائج اختبارt-studentللمقارنة بين نتائج فحصAPSDللصيغ المحضرة وصيغة الشاهد |
||||||
|
Response |
formulation |
-formulation |
Difference |
Std Error |
t Ratio |
Prob>|t| p-value |
|
FPF |
S-ETOH |
S-PEG400 |
15.0487 |
1.880164 |
8.00 |
<.0001 |
|
S-ETOH |
S-PEG400-OA |
13.2010 |
1.880164 |
7.02 |
<.0001 |
|
|
S-ETOH |
S-PEG400-PVP |
2.1054 |
1.880164 |
1.12 |
0.2678 |
|
|
MMAD |
S-ETOH |
S-PEG400 |
-1.54747 |
0.3135278 |
-4.94 |
<.0001 |
|
S-ETOH |
S-PEG400-OA |
-1.48473 |
0.3135278 |
-4.74 |
<.0001 |
|
|
S-ETOH |
S-PEG400-PVP |
-0.18347 |
0.3135278 |
-0.59 |
0.5609 |
|
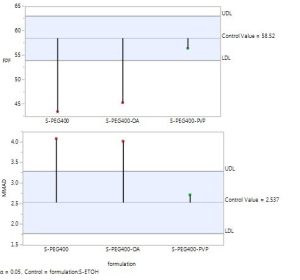
تشير النتائج إلى وجود تأثير هام ذي دلالة إحصائية عند مقارنة قيم FPF و MMAD العائدة لفحص توزع أبعاد جسيمات الجرعة المحررة من S-PEG400 وS-PEG400-OA مع صيغة الشاهد S-ETOH حيث أن قيمة (p-value˂0.05), بينما تشير النتائج إلى عدم وجود تأثير هام ذي دلالة إحصائية عند مقارنة FPF و MMAD العائدة لـS-PEG400-PVP وصيغة الشاهدS-ETOH , حيث أن قيمة (p-value˃0.05). يوضح الشكل(6) مخطط المقارنة مع صيغة الشاهد, حيث يلاحظ من الشكل أن قيم FPF و MMAD لـ S-PEG400-PVP تقع ضمن الحدود الدنيا و العليا لصيغة الشاهد, بينما تقع قيم FPF و MMAD العائدة لـ S-PEG400 و S-PEG400-OA خارج الحدود الدنيا بالنسبة لـ FPF والعليا بالنسبة لـMMAD عند مقارنتها مع صيغة الشاهد.
الاستنتاجات Conclusions:
إن الصيغة الحاوية على PEG400(1%) بوجود PVP-k30(0.0001%)هي صيغة ثابتة خالية من الايتانول , وبديل جيد لصيغة الشاهد الحاوية على ايتانول بنسبة (10% ) من ناحية دراسة توزع أبعاد جسيمات الجرعة المحررة (دراسة في الزجاح). يجب أن تتبع هذه الدراسة بدراسة لاستكمال الفحوص الدستورية الأخرى لضمان جودة عمل الشكل الارذاذي الخالي من الايتانول والحاوي على السالبوتامول سلفات.
المراجع :- Muro S, Sugiura H, Darken P, Dorinsky PJRr. Efficacy of budesonide/glycopyrronium/formoterol metered dose inhaler in patients with COPD: post-hoc analysis from the KRONOS study excluding patients with airway reversibility and high eosinophil counts. 2021; 22: 1-9.
- Abdo RW, Saadi N, Hijazi NI, Suleiman YA. Quality control and testing evaluation of pharmaceutical aerosols. Drug Delivery Systems: Elsevier; 2020. p. 579-614.
- Sorino C, Negri S, Spanevello A, Visca D, Scichilone N. Inhalation therapy devices for the treatment of obstructive lung diseases: the history of inhalers towards the ideal inhaler. Eur J Intern Med 2020; 75: 15-8. doi:10.1016/j.ejim.2020.02.023
- Rawat SS, Vaidya CR. FORMULATION AND DEVELOPMENT OF SALBUTAMOL PRESSURIZED METERED DOSE INHALER. 2021.
- Aldabet A, AlKayer M. Study of the Effect of Electrostatic Charge on the
Delivered Dose of Metered Dose Inhaler. Tishreen University Journal Health Sciences Series 2013; 35.
- Myrdal PB, Sheth P, Stein SW. Advances in Metered Dose Inhaler Technology: Formulation Development. AAPS PharmSciTech 2014; 15: 434-55. doi:10.1208/s12249-013-0063-x
- Lickley M, Solomon S, Fletcher S, Velders GJ, Daniel J, Rigby M, et al. Quantifying contributions of chlorofluorocarbon banks to emissions and impacts on the ozone layer and climate. 2020; 11: 1-11.
- Toon R, Preedy E, Prokopovich P. Formulating drugs for inhalers and stability issues. Eurasian Chemico-Technological Journal 2012; 14: 271-86.
- Sou T, Bergström CA. Contemporary formulation development for inhaled pharmaceuticals. Journal of Pharmaceutical Sciences 2020; 66-86. doi:10.1016/j.xphs.2020.09.006
- Saleem IY, Smyth HDC. Tuning Aerosol Particle Size Distribution of Metered Dose Inhalers Using Cosolvents and Surfactants. BioMed Research International 2013; 2013: 1-7. doi:10.1155/2013/574310
- Morales JO, Peters JI, Williams RO. Surfactants: their critical role in enhancing drug delivery to the lungs. Therapeutic Delivery 2011; 2: 623-41. doi:10.4155/tde.11.15
- Ivey JW, Vehring R, Finlay WH. Understanding pressurized metered dose inhaler performance. Expert Opin Drug Deliv 2015; 12: 901-16. doi:10.1517/17425247.2015.984683
- Lavorini F, Fontana GA, Usmani OS. New inhaler devices – the good, the bad and the ugly. Respiration 2014; 88: 3-15. doi:10.1159/000363390
- Sellers WFS. Asthma pressurised metered dose inhaler performance: propellant effect studies in delivery systems. Allergy Asthma Clin Immunol 2017; 13: 30. doi:10.1186/s13223-017-0202-0
- Self TH, Jones PJ, Sands CW. False‐positive breathalyser tests and use of metered‐dose inhalers: D oes inhalation technique affect test results? J Respirology 2017; 22: 1677-.
- Newman SPJRc. Principles of metered-dose inhaler design. 2005; 50: 1177-90.
- Da Rocha SR, Wu L. Co-polymer stabilizers for hydrofluoroalkane dispersions. Google Patents; 2013.
- Fassberg J, Sequeira JA, Chaudry IA, Kopcha M. Aerosol formulations of albuterol and 1, 1, 1, 2-tetrafluoroethane. Google Patents; 2002.
- Arafa M, Ayoub BM. Nano-vesicles of salbutamol sulphate in metered dose inhalers: formulation, characterization and in vitro evaluation. 2017.
- Dellamary LA, Tarara TE, Smith DJ, Woelk CH, Adractas A, Costello ML, et al. Hollow porous particles in metered dose inhalers. 2000; 17: 168-74.
- Yoshida H, Kuwana A, Shibata H, Izutsu K-i, Goda YJAP. Comparison of aerodynamic particle size distribution between a next generation impactor and a cascade impactor at a range of flow rates. 2017; 18: 646-53.
- Marple VA, Roberts DL, Romay FJ, Miller NC, Truman KG, Van Oort M, et al. Next generation pharmaceutical impactor (a new impactor for pharmaceutical inhaler testing). Part I: Design. 2003; 16: 283-99.
- Chow MYT, Tai W, Chang RYK, Chan H-K, Kwok PCLJADDR. In vitro-in vivo correlation of cascade impactor data for orally inhaled pharmaceutical aerosols. 2021; 113952.
- Kurakula M, Rao GKJJoDDS, Technology. Type of Article: REVIEW Pharmaceutical Assessment of Polyvinylpyrrolidone (PVP): As Excipient from Conventional to Controlled Delivery Systems with a Spotlight on COVID-19 Inhibition. 2020; 102046.