تقييم الفعالية المضادة للأكسدة لخلاصات الكمأة Terfezia claveryi، وصياغتها بشكل هلامة مائية ومرهم من البولي إيتيلن غليكول
2023-07-01 | المجلد السابع العدد الثاني - المجلد السابع | مقالات بحثيةعبد الله الأتاسي | محمد عثمان
الملخص
تعتبر مضادات الأكسدة طبيعية المنشأ ومنها عديدات الفينول ذات قيمة علاجية وتجميلية هامة للجلد، من حيث كبح الجذور الحرة ذات التأثيرات الضارة على الخلايا، لكن هذه المركبات قابلة للتخرب السريع، ولها اعتبارات تصنيعية. تم تحضير خلاصات مائية كحولية للكمأة Terfezia claveryi بالنقع مع الاستعانة بالأمواج فوق الصوتية، وتحليل محتوها الفينولي الكلي وحساب فعاليتها المضادة للأكسدة، كما تم صياغة إحدى الخلاصات ضمن هلامة من الكاربوبول 934P، إضافةً إلى مرهم من البولي إيتيلن غليكول، وتقييم الفعالية المضادة للأكسدة بعد 12 يوم. لقد تراوح المحتوى الفينولي الكلي للخلاصات ما بين 28-43 ملغ مكافئ من حمض الغاليك لكل غرام خلاصة، والتركيز الكابح لنصف ركائز الجذور الحرة DPPH 6.1-8.9 ملغ/مل من الخلاصة. لم يُلاحظ أي فقد في الفعالية المضادة للأكسدة لمرهم البولي إيتيلن غليكول على عكس الهلامة المائية.
كلمات مفتاحية : مرهم بولي إيتيلن غليكول، هلامة مائية، أرجحة حرارية.
المقدمة Introduction
تُعرف الكمأة بأنها من الفطور الزقية Ascomycetes القابلة للأكل والتي تنمو تحت الأرض (1)، ويوجد لها الكثير من الأنواع، لكن نوع الكمأة السوداء Terfezia calveryi من أكثر الأنواع انتشاراً، ويتركّز انتشارها في المناطق الجافة والمناطق شبه الجافة لشرق المتوسط، وهو يُدعى في سوريا بـ “العبيدي”، وفي الجزيرة العربية يُسمَّى “خلاصي” (2). حازت الكمأة اهتماماً كبيراً في الطب الشعبي، إذ تستخدم في مداواة عدة أمراض عينية وجلدية (3)، ومع هذا فهي لم تُدرس بما يكفي ولم يتم استثمارها بالشكل الأمثل، وحديثاً تم الاستفادة من الفطور تجميلياً من حيث فعالياتها المثبطة لأنزيمات الكولاجيناز والتيروزيناز وسيكلوأوكسيجيناز، إذ تفيد في إزالة التجاعيد وإنقاص حدوث التصبُّغات والتأثيرات المضادة للالتهاب والمضادة للأكسدة، نظراً لما تحويه من طيف واسع من المركبات (4). تشير الدراسات إلى غِنى الكمأة بمضادات الأكسدة، مثل المركبات الفينولية كالحموض الفينولية والفلافونوئيدات، وكذلك عديدات السكاريد والستيرولات (5). إن عديدات الفينول polyphenols من المركبات الأساسية المضادة للأكسدة، وهي قادرة على التفاعل مع الجذور الحرة وإيقاف تأثيراتها الضارة نظراً لقدرتها المرجعة وما تملكه من مجموعات هيدروكسيلية (6). إن الاستخلاص بالاستعانة بالأمواج فوق الصوتية Ultrasonic-assisted extraction (UAE) من الطرائق الفعالة في استخلاص عديدات الفينول ضمن ظروف عادية، بحيث تحسّن اختراقية مذيبات الاستخلاص وتقلل الكمية اللازمة منها وهي مناسبة للمواد الحساسة للحرارة (7). تعتبر طريقة الـ DPPH من الطرائق الأكثر شيوعاً لقياس الفعالية المضادة للأكسدة؛ حيث تعتمد على الجذر الحر العضوي الثابت ذي اللون البنفسجي 2,2-diphenyl-1-picrylhydrazyl (DPPH) والذي يتحول إلى اللون الأصفر عند تفاعله مع مضادات الأكسدة، وهي طريقة سهلة وسريعة (8). يلجأ الباحثون إلى تطوير أنظمة صيدلانية جديدة لصياغة مواد دوائية ذات منشأ طبيعي، للتغلب على مساوئ الأشكال الجلدية التقليدية، مثل التأثيرات الجانبية والسمية، وانخفاض التوافر الحيوي والثبات. ومن تلك الأنظمة الحوامل الميكروية والنانوية(9). يهدف هذا البحث إلى دراسة المحتوى الفينولي لخلاصات الكمأة وفعاليتها المضادة للأكسدة والكابحة للجذور الحرة، لاختيار الخلاصة الأفضل لصياغتها ضمن أشكال جلدية نصف صلبة، وتحري فعاليتها بعد تعريضها إلى درجات حرارة مختلفة.
المواد والطرائق Materials and methods
المواد المستخدمة
الإيتانول Ethanol 70% (ساري، سوريا)، بولي إيتيلن غليكول 200 & 4000 (Riedel-de Haen, Germany)، EDTA ثنائي الصوديوم (BDH, England)، بروبيلين غليكول، وتري إيتانول أمين، وكاربوبول 934P، وميتيل بارابين، وبروبيل بارابين، ميتانول methanol 99% (Sigma-Aldrich, USA)، كاشف Folin-ciocalteu’s phenol reagent (Sigma-Aldrich, Switzerland)، حمض الأسكوربيك، وكربونات الصوديوم اللامائية (Panreac, spain)، حمض الغاليك العياري (Titan biotech, india)، كاشف DPPH• (2,2-Diphenyl-1-Picrylhydrazyl) بنقاوة أكبر من 95% (Cayman chemical, USA).
تحضير عينة الكمأة
تم جمع الأجسام الثمرية ascocarps للكمأة من مدينة حمص في شهر نيسان 2020م، وقد كانت سليمة وخالية من أي مظهر تخرب خارجي. تم تصنيف نوع الكمأة المدروس بالاعتماد على الخصائص الشكلية والمجهرية والرجوع للأدبيات (10). تم تنظيف الأجسام الثمرية للكمأة بعد ذلك بتيار من الماء وأزيلت الأتربة بتقشير الطبقة السطحية، ثم قطعت إلى شرائح وجففت ضمن فرن (40°م) خلال ثلاثة أيام، ثم تم طحن الكمأة المجففة وحفظها بعبوات بلاستيكية محكمة الإغلاق بحرارة المخبر حتى الاستخدام.
تحضير خلاصات الكمأة
حُضِّرت خلاصات بطريقة النقع، واحدة بالماء، وثانية بالميتانول، وثالثة بالإيتانول 70% لمدة يوم كامل لكل منها بدرجة حرارة المخبر، مع تعريض الخلاصات للأمواج فوق الصوتية (PHYLO USH-10D, Italy) لمدة ربع ساعة في بداية الاستخلاص، وكانت نسبة مسحوق الكمأة إلى المذيب 10:1 على الترتيب. بعد 24 ساعة، تم تثفيل وترشيح الخلاصات، ثم تبخير المذيب باستعمال المبخر الدوار (Great Wall, Rotary evaporator R-1001-VN, China) بدرجة حرارة 45°م حتى الوصول إلى خلاصة جافة، وحُفظت الخلاصات الجافة الناتجة في المجمدة.
معايرة المحتوى الفينولي الكلي والفعالية المضادة للأكسدة بطريقة الـ DPPH
تم معايرة المحتوى الفينولي الكلي باتباع معايرة فولين-سيوكالتو اللونية Folin-ciocalteu، حيث تم إجراء المعايرة وفقاً لطريقة (Al-Laith, 2010) مع بعض التعديلات (11). إلى أنبوب اختبار يحوي 1.58 مل ماء مقطر، يُضاف 20 ميكروليتر من العينة، أو العياري، أو الشاهد، ثم يُضاف 100 ميكروليتر من كاشف الفولين المركز (2 mol/l)، وبعد ثلاث دقائق يتم إضافة 300 ميكروليتر من وقاء كربونات الصوديوم (200 غ/ل)، ويُرج المزيج، ثم يحضن لمدة 30 دقيقة ضمن حمام مائي عند درجة حرارة 40º م، حتى يتشكل لون ثابت، ثم يتم قياس الامتصاص عند طول موجة 736 نانومتر، باستخدام جهاز (pg instruments UV-VIS Specrtophotometer T80+, UK) مقابل الشاهد الذي يحوي جميع مكونات التفاعل بدون الخلاصة. وقد تم حساب المحتوى الفينولي الكلي من خلال المعادلة الناتجة عن السلسلة المعيارية لحمض الغاليك (y=0.0009x+0.00177, R2=0.9961)، ويعبر عن النتائج بالمكافئ من وزن حمض الغاليك بالميلي غرام مقابل كل غرام من الخلاصة الجافة (mg GAE/g dry extract)، تم تكرر التجربة لكل خلاصة 3 مرات، ويعبر عن النتائج (mean ± SD).

أما ما يتعلق بقياس الفعالية المضادة للأكسدة الكابحة للجذور الحرة DPPH•، فقد تم وفقاً لـ (Gouzi et al, 2013) مع بعض التعديلات (12). إلى أنبوب اختبار يحوي 2.9 مل من كاشف DPPH الميتانولي بتركيز 0.1 mM، يُضاف 100 ميكروليتر من العينة، أو الشاهد الإيجابي (حمض الأسكوربيك)، أو الشاهد السلبي (المذيب المستخدم)، يُرج المزيج، ثم يحضن لمدة 30 دقيقة في الظلام بدرجة حرارة المخبر، ثم يُقاس الامتصاص عند طول موجة 515 نانومتر، مقابل شاهد يحوي الميتانول فقط. ويتم حساب النسبة المئوية لكبح الجذور الحرة لكل تركيز من تراكيز الخلاصات وفق القانون التالي:
Scavenging activity % = Abs0 – Abs1 / Abs0 X 100%
حيث: Abs0 امتصاص الشاهد السلبي (الكاشف)، Abs1 امتصاص الخلاصة أو حمض الأسكوربيك مع الكاشف. من خلال المنحنى البياني الخاص بكل خلاصة يتم حساب التركيز الكابح لـ 50% من الجذر الحر (IC50)، ويتم حساب الـ IC50 للشاهد الإيجابي أيضاً (حمض الأسكوربيك). تم تكرار المعايرة لكل خلاصة 3 مرات، والتعبير عن النتائج (mean ± SD).
تحضير هلامة الكاربوبول ومرهم PEG
تم تحضير هلامة مائية بأساس من الكاربوبول (F1)، ومرهم منحل في الماء بأساس من PEG F2)). تم إدخال الخلاصة الإيتانولية 70% الجافة للكمأة السوداء إلى الصيغتين على البارد (إضافة الخلاصة المبعثرة ضمن البروبيلين غليكول إلى كمية الماء اللازمة للتحضير، ثم إضافة العامل المهلِّم، وأخيراً القلوَنَة باستخدام triethanolamine بالنسبة للصيغة F1، أما المرهم (الصيغة F2) فقد تم تحضيره بالصهر ثم إدخال الخلاصة بالمهك). يوضّح (الجدول 1) مكونات الصيغتين والنسبة المئوية لكل مكوّن.
تأثير الأرجحة الحرارية Thermo-cycling على الهلامة المائية والمرهم
تم دراسة ثبات الفعالية المضادة للأكسدة للشكلين المحضّرين، وذلك من خلال استخدام دراسة تأرجح حراري Thermo-cycling، وهي تعتبر من دراسات الشدة Stress study (13). تم اتباع طريقة (Krongrawa et al, 2018) مع بعض التعديلات (14)، إذ تم تعريض كلتا الصيغتين إلى 6 دورات حراريّة، تتألف كل دورة من حضن بدرجة حرارة ±2 4ºم لمدة 24 ساعة، يتلوها حضن بدرجة حرارة ±2 40ºم لمدة 24 ساعة. بالمقابل تم حضن عينات أخرى دون أرجحة حرارية عند درجات حرارة ثابتة ±2 4ºم، و±2 25ºم، و±2 40ºم لمدة 12 يوم بشكل مستمر. قُيِّمت الصيغ عند بداية الدراسة، وتم تقييمها مباشرةً بعد نهاية ست دورات للأرجحة الحرارية، كما تم تقييم العينات الأخرى بعد مرور 12 يوم، وذلك من حيث اللون والمظهر، والتجانس، ودرجة الحموضة pH (بتمديدها 10 مرات بالماء المقطر، والقياس بجهاز[HANNA instruments pH 211, USA]) ، واللزوجة (بطريقة بروكفيلد Brookfield باستخدام [Myr Viscotic VR 3000, Spain] عند درجة الحرارة 20°م، وبالشروط المناسبة لكل صيغة من حيث أنماط المغازل spindle وسرعات الدوران [F1: R7, 60 rpm; F2: R7, 20 rpm])، وأيضاً من حيث الفعالية الكابحة للجذور الحرة DPPH• (بعد استخلاص الصيغة بالإيتانول 70% بحيث يصبح تركيز الخلاصة 5 ملغ/مل)، وتجرى هذه المعايرة أيضاً على شاهد سلبي (صيغ لا تحوي الخلاصة).
| الجدول (1): مكونات الصيغتان المحضرتان من خلاصة الكمأة الإيتانولية 70% الجافة، والنسبة المئوية لكل مكوّن | ||
| المكوّن | F1
هلامة مائية (w/w%) |
F2*
مرهم الـ PEG (w/w%) |
| ماء مقطر | 83.18 | – |
| بروبيلين غليكول | 13 | – |
| ميتيل باربين | 0.18 | – |
| بروبيل بارابين | 0.02 | – |
| كاربوبول 934P | 0.8 | – |
| EDTA | 0.02 | – |
| TEA | 0.8 | – |
| PEG 4000 | – | 30 |
| PEG 200 | – | 68 |
| الخلاصة الجافة | 2 | 2 |
| * يمكن تحضير الصيغة F2 باستخدام عدة أمزجة لأنواع أخرى من PEG ونسب مختلفة بينها | ||
الدراسة الإحصائية:
تم إجراء اختبار تحليل التباين أحادي الاتجاه (One-way ANOVA) باستخدام البرنامج الإحصائي IBM® SPSS® statistics, version 25 للتأكد من الفروقات بين المتوسطات، مع إتباعه باختبار (Tukey’s HSD)، وتم اعتماد القيمة P-Value < 0.05 للدلالة على الفارق المعتد به إحصائياً.
النتائج والمناقشة Results and discission
حققت الخلاصة المائية مردود استخلاص أعلى (44.2%). إن الماء أكثر قطبية من الميتانول والإيتانول، وبالتالي ربما يعود مردود استخلاصه العالي إلى قدرته على استخلاص محتوى الكمأة المرتفع من السكاكر البسيطة وعديدات السكاكر والأحماض الأمينية وعديدات الفينول الغليكوزيدية مع العديد من المركبات الأخرى. إن استخدام طريقة الاستخلاص بالاستعانة بالأمواج فوق الصوتية قد حققت زيادةً في مردود الاستخلاص، حيث بلغ مردود الاستخلاص بالميتانول 16.7%، بينما لم يتجاوز مردود الاستخلاص بالنقع في الميتانول دون أمواج فوق الصوتية 1.8% وفقاً لـ (Dahham et al, 2018) وزملائه على نفس نوع الكمأة المدروسة هنا (15). تراوحت قيم المحتوى الفينولي الكلي Total phenolic content (TPC) للخلاصات ما بين 28.7-43.6 ملغ مكافئ من حمض الغاليك لكل غرام خلاصة (الجدول 2)، يوجد تقارب بين المحتوى الفينولي للخلاصات الثلاث (المائية والميتانولية والإيتانولية 70%)، ولم يُلاحظ وجود فوارق إحصائية معتد بها بين أنواع الخلاصات وفقاً للدراسة الإحصائية. زادت قيمة TPC للخلاصة المائية عن تلك المنشورة وفقاً لـ (Boufeldja et al, 2016) (16) على الخلاصة الميتانولية 80% لنفس نوع الكمأة المدروسة. إن تواجد عديدات الفينول بكميات كبيرة يقي من حدوث العديد من الأمراض مثل السرطان والأمراض القلبية الوعائية وغيرها في حال أُخذت داخلاً. إن المحتوى الفينولي لنوع الكمأة الصحراوية المدروسة (4.14 ملغ/غ كتلة طازجة) يفوق المحتوى الفينولي لأغذية تصنف على أنها غنية بها مثل الكرز (0.87 ملغ/غ كتلة طازجة) والفراولة (0.93 ملغ/غ كتلة طازجة)، لكنه أقل من المحتوى الفينولي للتوت (6.7 ملغ/غ كتلة رطبة)، وقد يُعزى ذلك إلى الظروف القاسية التي تنمو فيها الكمأة في الصحراء من حيث الجفاف وتفاوت درجات الحرارة ما بين الليل والنهار، مما يزيد من مضادات الأكسدة وخاصةً المركبات الفينولية (6,17). وفقاً لـ (الشكل 2)، ازداد كبح الجذور الحرة DPPH• مع زيادة التراكيز المستخدمة من الخلاصات، وأعلى نسبة كبح للخلاصات المختلفة كانت 91%، أحرزتها الخلاصة الإيتانولية 70%.
قام الشاهد الإيجابي (حمض الأسكوربيك) بكبح 95% من الجذور الحرة DPPH• بتركيز 0.25 ملغ/مل.
| الجدول (2): مردود الاستخلاص والمحتوى الفينولي الكلي والفعالية المضادة للأكسدة لخلاصات الكمأة Terfezia claveryi | |||
| نوع الخلاصة | مردود الاستخلاص (%) | المحتوى الفينولي الكلي
(mg GAE/g dry extract) |
IC50(mg/ml) |
| مائية | a | a | a |
| ميتانولية | b | a | a |
| إيتانولية 70% | b | a | a |
| تشير IC50 إلى التراكيز الكابحة لنصف ركائز الجذور الحرة DPPH•
تعبر كل قيمة في الجدول عن المتوسط الحسابي mean ± SD (n=3)، وتشير الأحرف المتشابهة للمتوسطات ضمن نفس العمود إلى عدم وجود فروق دالّة إحصائياً وفق اختبار Tukey (P>0.05) |
|||
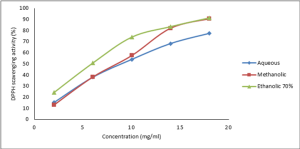
وفقاً لـ (الجدول 2)، تفوقت الخلاصة الإيتانولية 70% (6.12 ملغ/مل) على الخلاصتين المائية والميتانولية في كبح الجذور الحرة، مع عدم ملاحظة وجود فوارق ذات دلالة إحصائية بين الخلاصات الثلاث. إن الفعالية الكابحة للشاهد الإيجابي (حمض الأسكوربيك) (IC50=0.116 mg/ml)أعلى بكثير من فعالية الكبح للخلاصات المدروسة، وذلك لأنه مركب واحد نقي، بينما تكون الخلاصات الخام crude extracts أمزجة من مركبات ذات تراكيز متباينة وقليلة. إن قيمة IC50 للخلاصة الميتانولية الناتجة (8.6 ملغ/مل) اتفقت مع قيمة IC50 للخلاصة الميتانولية المحضرة بطريقة سوكسيلييه (8.6 ملغ/مل) وفقاً لـ (Neggaz et al, 2015) (18)، أما الخلاصة الميتانولية المحضرة بطريقة النقع بدون أمواج فوق صوتية فقد كانت أقل فعالية (22.2 ملغ/مل)، وذلك باتباع طريقة عمل مماثلة. نتائج دراسة الأرجحة الحرارية للهلامة المائية (F1) ومرهم PEG (F2) موضحة في (الجدول 3). لقد انخفضت الفعالية المضادة للأكسدة للصيغة F1 عند تعريضها للأرجحة الحرارية لتصبح (11.6%)، وانخفضت بشكل كبير عند حفظ الصيغة بالدرجة 40º م لمدة 12 يوم، حيث وصلت إلى (6.5%). أما حفظ العينات بدرجات حرارة 4º م و25º م خلال 12 يوماً كانت نتائجهما متشابهة إحصائياً (14.7% و13.8% على الترتيب). لم تتوافق النتائج السابقة مع نتائج دراسة الأرجحة لهلامات تحوي خلاصات ذات محتوى فينولي (جوز الهند (14) والصنوبر (19))، حيث لم تتأثر الفعالية المضادة للأكسدة للصيغ طيلة فترة الدراسة (12 يوم) وذلك في جميع شروط الحرارة المدروسة. لقد انخفضت الفعالية المضادة للأكسدة لخلاصة الكمأة في الهلامة المائية عند تعريضها لدرجة حرارة عالية، وذلك يعود إلى التأثير السلبي لارتفاع درجات الحرارة ووجود الوسط المائي على ثبات المركبات الفينولية ومضادات الأكسدة الأخرى الموجودة في الخلاصة، مما يجعلها عرضةً للأكسدة والتخرب بشكل أكبر، كما لوحظ تغير بألوان العينات مع ازدياد درجات الحرارة، وهذا قد يشير إلى عدم الثبات الكيميائي لمركبات الخلاصة الفينولية وتعرضها للأكسدة وتحولها لمركبات كينونية، وهذا ما يتوافق مع مواد مماثلة (14) و(20)، حيث ازداد تغيّر لون الصيغ المحفوظة بدرجات حرارة 45º م و37º م على الترتيب. لم يتغيّر مظهر ودرجات حموضة العينات بعد انتهاء فترة الدراسة، حيث تراوحت بين 6.48-6.61 بدون وجود فوارق ذات دلالة إحصائية (تعود القيمة الدنيا لعينة الأرجحة، والقيمة العليا لعينة بداية الدراسة)، لكن تم ملاحظة انخفاض في لزوجة العينة التي تعرضت للأرجحة الحرارية (كانت قيمة اللزوجة 35333 سنتيبواز في بداية الدراسة، وأصبحت 22300 سنتيبواز بعد الأرجحة). أما مرهم PEG (الصيغة F2)، لم يُلاحظ انخفاضات أو ارتفاعات ذات دلالات إحصائية على الفعالية المضادة للأكسدة وذلك بالنسبة لكافة عينات الدراسة، مما يشير إلى قدرة هذه الصيغة في الحفاظ على ثبات المركبات الفينولية ومضادات الأكسدة الأخرى خلال شروط الحرارة المطبقة، وربما يُعزى ذلك إلى عدم وجود الوسط المائي في هذه الصيغة مقارنةً بالهلامة المائية، إضافة إلى قدرة الأساس الحامل على حماية تلك المركبات من ظروف الأكسدة. أما من ناحية خصائص الصيغة فقد طرأت انخفاضات طفيفة في درجات الحموضة على كافة العينات، كان أعلاها في العينة التي تم حضنها بحرارة 40º م طيلة فترة الدراسة، حيث تراوحت القيم بين 4.84-5.27 (تعود القيمة الدنيا للعينة التي تم حضنها بحرارة 40º م، والقيمة العليا لعينة بداية الدراسة). إن تعرض مرهم PEG للأرجحة الحرارية خلال 12 يوم أدّى إلى ارتفاع واضح في اللزوجة (كانت قيمة اللزوجة 101066 سنتيبواز في بداية الدراسة، وأصبحت 169333 سنتيبواز بعد الأرجحة)، وقد تسبب ذلك في ظهور بعض التشققات والتكتلات في الصيغة. قد يُعزى ذلك إلى تميع الأساس المرهمي عند الحضن بحرارة 40º م ثم إعادة التصلب مرة أخرى بشكل غير متجانس عند الحضن بحرارة 4º م، وذلك لعدة دورات متتابعة.
| الجدول (3): تأثير درجة حرارة الحفظ في قدرة الصيغتين (F1: الهلامة المائية، وF2: مرهم PEG) على كبح الجذور الحرة DPPH | |||||
| الصيغة | عند بداية الدراسة | بعد 12 يوم من الأرجحة | بعد 12 يوم بـ 4ºم | بعد 12 يوم بـ 25ºم | بعد 12 يوم بـ 40ºم |
| F1 | a | b | a,c | b,c | d |
| F2 | a | a | a | a | a |
| تعبر كل قيمة في الجدول عن النسبة المئوية لكبح الجذور الحرة DPPH•، وهي تمثل المتوسط الحسابي mean ± SD (n=3)، وتشير الأحرف المتشابهة للمتوسطات ضمن نفس الصف إلى عدم معنوية الفروق إحصائياً بواسطة اختبار Tukey (P>0.05). | |||||
الاستنتاجات Conclusions
ساهم تعريض خلاصات الكمأة للأمواج فوق الصوتية إلى زيادة مردود الاستخلاص، ولم يتأثر المحتوى الفينولي الكلي بنوع مذيب الاستخلاص المستخدم. اتضح أن خلاصات الكمأة تملك فعالية جيدة مضادة للأكسدة عن طريق كبح الجذور العضوية الحرة DPPH•، وهي من أكثر الطرائق شيوعاً في التحري عن الفعالية المضادة للأكسدة إما بمنح هيدروجين أو إلكترون. تبيّن تأثير المحتوى المائي للصيغ نصف الصلبة ونوع السواغات ودرجة حرارة الحفظ في الفعالية المضادة للأكسدة الخاصة بخلاصة الكمأة، وهذا يؤكد الحاجة إلى صيغ وسواغات وتقنيات ملائمة لحمل وحفظ المركبات الفينولية ومضادات الأكسدة الخاصة بخلاصات الكمأة لضمان ثباتها وفعاليتها العلاجية كونها عرضة للتخرب السريع؛ حيث حافظ مرهم PEG على الفعالية المضادة للأكسدة للخلاصة في مختلف الظروف الحرارية، مع الحاجة لتحسين الخصائص الفيزيوكيميائية للصيغة، وإجراء دراسات صياغة لخلاصة الكمأة بأشكال نصف صلبة عديدة وتقييمها، وهي قيد الإعداد والنشر مستقبلاً.
المراجع :- Enshasy H El, Elsayed EA, Aziz R, Wadaan MA. Mushrooms and Truffles : Historical Biofactories for Complementary Medicine in Africa and in the Middle East. Evidence-Based Complement Altern Med. 2013;2013.
- Owaid MN. Bioecology and uses of desert truffles ( Pezizales ) in Middle Eastern Bioecology and Uses of Desert Truffles ( Pezizales ) in the Middle East. WALAILAK J. 2018;15(3):179–88.
- Khalifa SAM, Farag MA, Yosri N, Sabir JSM, Saeed A, Al-mousawi SM, et al. Truffles : From Islamic culture to chemistry , pharmacology , and food trends in recent times. Trends Food Sci Technol [Internet]. 2019;91:193–218. Available from: https://doi.org/10.1016/j.tifs.2019.07.008
- Wu Y, Choi M, Li J, Yang H, Shin H. Mushroom Cosmetics : The Present and Future. cosmetics. 2016;3(22).
- Kagan-Zur V, Roth-Bejerano N, Sitrit Y, Morte A, editors. Desert Truffles Phylogeny, Physiology, Distribution and Domestication. Springer Berlin Heidelberg; 2014.
- Nollet LML, Gutierrez-Uribe JA, editors. Phenolic Compounds in Food Characterization and Analysis. CRC Press Taylor & Francis Group; 2018.
- Ajila CM, Brar K, Verma M. Extraction and Analysis of Polyphenols : Recent trends. Crit Rev Biotechnol. 2010;1–22.
- Garde-cerdán T, Gonzalo-diago A, Pérez-álvarez EP, editors. Phenolic compounds types, effects and research. Nova Science Publishers; 2017.
- Singh MR, Nag MK, Patel S, Daharwal SJ, Singh D. Novel Approaches for Dermal and Transdermal Delivery of Herbal Drugs. Res J Pharmacogn Phytochem. 2013;5(6):271–9.
- Alsheikh AM. Taxonomy and Mycorrhizal Ecology of the Desert Truffles in the Genus Terfezia. Oregon State University; 1995.
- Al-laith AAA. Antioxidant components and antioxidant/antiradical activities of desert truffle (Tirmania nivea) from various Middle Eastern origins. J Food Compos Anal [Internet]. 2010;23(1):15–22. Available from: http://dx.doi.org/10.1016/j.jfca.2009.07.005
- Gouzi H, Leboukh M, Bouchouka E. Antioxidant and Antiradical Properties of Methanolic Extracts from Algerian Wild Edible Desert Truffles ( Terfezia and Tirmania , Ascomycetes ). Int J Med Mushrooms. 2013;15(5):473–88.
- Bajaj S, Singla D, Sakhuja N. Stability Testing of Pharmaceutical Products. J Appl Pharm Sci. 2012;2(3):129–38.
- Krongrawa W, Limmatvapirat S, Pongnimitprasert N, Meetam P, Limmatvapirat C. Formulation and evaluation of gels containing coconut kernel extract for topical application. Asian J Pharm Sci [Internet]. 2018; Available from: https://doi.org/10.1016/j.ajps.2018.01.005
- Dahham SS, Al-Rawi SS, Ibrahim AH, Majid ASA, Majid AMSA. Antioxidant , anticancer , apoptosis properties and chemical composition of black truffle Terfezia claveryi. Saudi J Biol Sci [Internet]. 2018;25(8):1524–34. Available from: https://doi.org/10.1016/j.sjbs.2016.01.031
- Wahiba B, Wafaà T, Asmaà K, Bouziane A, Mohammed B. Nutritional and antioxidant profile of red truffles ( Terfezia claveryi ) and white truffle ( Tirmania nivea ) from southwestern of Algeria. Der Pharm Lett. 2016;8(17):134–41.
- Hamza A, Jdir H, Zouari N. Nutritional , Antioxidant and Antibacterial Properties of Tirmania nivea , A Wild Edible Desert Truffle from Tunisia Arid Zone. Med Aromat Plants. 2016;5(4).
- Neggaz S, Fortas Z, Chenni M, Abed D El, Ramli B, Kambouche N. In vitro evaluation of antioxidant, antibacterial and antifungal activities of Terfezia claveryi Chatin. Phytothérapie. 2015;
- Daudt RM, Back PI, Cardozo NSM, Marczak LDF, Külkamp-Guerreiro rene C. Pinhão starch and coat extract as new natural cosmetic ingredients: Topical formulation stability and sensory analysis. Carbohydr Polym. 2015;134:573–80.
- Salas AL, Uriburu FMC, Zampini IC, Arias M, Moreno MIN, Deiú AS, et al. Hydroalcoholic gel with Argentine propolis : the potential for antimicrobial and antioxidant activities , stability evaluation , and in vitro phenolic release. J Apic Res [Internet]. 2020; Available from: https://doi.org/10.1080/00218839.2020.1790791