البروتين الايوزينيّ الكاتيونيّ ECP واصماً حيوياً لتفعيل الحمضات في الداء الرئوي الانسدادي المزمن COPD
2023-07-01 | المجلد السابع العدد الثاني - المجلد السابع | مقالات بحثيةرنا حداقي | خليل القوتلي | شادن حداد
الملخص
تمثل الاستجابة الالتهابية المزمنة في السبل التنفسية السمة الرئيسة لإمراضية الداء الرئوي الانسدادي المزمن COPD، ومع أنها عادةً استجابة التهابية متواسطة بالعدلات، فقد وُجِدَ أنّ للحمضات دورًا فيها، ولكن من غير الواضح حتى الآن دور تفعيل الحمضات، وبروتيناتها المفرزة في إمراضية الـCOPD وحدوث سوراته. يمثل البروتين الايوزيني الكاتيوني ECP واحدًا من أبرز البروتينات المفرَزَة من الحمضات عقب تفعيلها، ومن ثمَّ تُعَد تراكيزه مشعرًا لتفعيل الحمضات. أظهرت الدراسة الحالية ارتفاعًا في تراكيز ECP المصلية لدى مرضى COPD بالمقارنة مع الأصحاء، وكانت تراكيزه أعلى لدى مرضى السورات من تراكيزه لدى مرضى COPD بحالة الهدأة، ما يشير إلى حدوث تفعيل للحمضات لدى هؤلاء المرضى وإفرازها ECP الذي يتمتع بفعاليات بيولوجية عديدة سامة، وغير سامة للخلايا التي تسهم في التغيرات المرضية المميزة ـCOPD.
كلمات مفتاحية : الداء الرئوي الانسدادي المزمن، البروتين الايوزيني الكاتيوني، والحمضات.
المقدمة Introduction
يُعرَّف الداء الرئوي الانسدادي المزمن أنه مرضٌ شائع يمكن تدبيره والوقاية منه، يترافق مع أعراض تنفسية دائمة أبرزها الزلة التنفسية والسعال المنتج، ويتميز باستجابة التهابية مزمنة في السبل التنفسية تؤدي إلى تحدد (تضيّق) لا عكوس في المجرى الهوائي [1, 2]، ويشكّل هذا الداء سببًا رئيسيًا للمراضة والمواتة، إذ يحتل المرتبة الثالثة بين الأسباب المؤدية إلى الوفاة عالميًا [3]، وتختلف معدلات انتشاره من بلد إلى أخر [1]، وتُعَد سوريّة ذات أعلى معدل انتشار للـCOPD في دول الشرق الأوسط [4]. يعتمد تشخيص الـCOPD على تأكيد وجود التحدد الهوائي اللاعكوس باستخدام قياس التنفس Spirometry، إذ تُحسَب النسبة ما بين الحجم الزفيري القسري في الثانية الأولى Forced Expiratory Volume In One Second (FEV1)، والسعة الحيوية القسرية Forced Vital Capacity (FVC) أي FEV1/FVC، وتُعَد أي نسبة أقل من 0.7 بعد إرذاذ الموسع القصبي مشخصة للـCOPD [2]. يترافق هذا المرض مع آونة تسوء فيها الأعراض التنفسية على نحو يستدعي تغيير العلاج وقد يؤدي إلى الحاجة إلى الاستشفاء، وتُدعَى هذه الفترات الآونة بسورات (هجمات) الـCOPD (COPD Exacerbations)، وتُعَد هذه السورات حدثًا مهددًا للحياة، وتترافق مع زيادة في الاستجابة الالتهابية في السبل التنفسية وتزداد جهازيًا [1, 2]. إنّ آلية COPD الإمراضية غير مفهومة جيداً، ولكن عادةً ما تكون الاستجابة الالتهابية المتواسطة بالعدلات هي الاستجابة الالتهابية المسيطرة فيه [5]، ومع ذلك فقد تشارك الحمضات في هذه الاستجابة المناعية وقد تحدث زيادة في أعداد الحمضات لدى مرضى الـCOPD [5-7]، ما قد يترافق مع زيادة في إفراز البروتينات الموجودة ضمن حبيباتها، ما يوحي بحدوث تفعيل لهذه الخلايا المناعية، ومشاركتها هي وبروتيناتها المفرَزَة في رد الفعل المناعي المميز لهذا المرض [8]، وما يدعم هذه الفرضية أنّ ما يقارب ثلث مرضى الـCOPD يبدون نمطًا التهابيًا حامضيًا، أي تسود لديهم الاستجابة المناعية المتواسطة بالحمضات على نحو مشابه لمرضى الربو [2, 5]، ومن ثمَّ فمن المفيد دراسة دور تفعيل الحمضات وليس فقط تعدادها في إمراضية الـCOPD، لفهم آليته الإمراضية فهماً أفضل ومن ثمَّ إمكانية تطوير علاجات مستقبلية له. يوجد البروتين الايوزيني الكاتيوني ECP ضمن حبيبات الحمضات إلى جانب البروتين الأساسي القاعدي Major Basic Protein، والبروكسيداز الايوزيني Eosinophil Peroxidaxe، والسم العصبي المشتق من الحمضات Eosinophil-derived Neurotoxin والبروتين X الايوزيني Eosinophil Protein X [9]، ولا يُفرَز الـECP سوى من الحمضات المُفَعّلة، ومن ثمَّ تُعَد تراكيزه مشعرًا للتحري عن دوره ودور الحمضات المفعّلة في الأمراض المختلفة مثل COPD والربو [9, 10]. يبدي ECP فعاليات بيولوجية عديدة سامة للخلايا البشرية وغير البشرية، فهو ذو فعالية مضادة للأحياء الدقيقة، ويتمتع بتأثيرات بيولوجية غير سامة للخلايا، فعلى مستوى الجهاز التنفسي يؤدي ECP دورًا بتنظيم فعالية الأرومة الليفية، ويحرض إفراز المخاط، ويقلل من حركة الأهداب في الظهارة التنفسية، ويتواسط تقلص العضلات الملس في هذه السبل أيضًا، كما يبدي دوراً في إعادة تشكيل (نمذجة) النسج التنفسية tissues remodeling [9, 11]. وعادةً ما تُلاحَظ هذه التغيرات المرضية مثل تقلص العضلات الملس في السبيل التنفسي وفرط إفراز المخاط وإعادة تشكيل النسج التنفسية لدى مرضى الـCOPD [1] ومن ثمَّ قد يؤدي ECP دورًا في حدوثها لدى هؤلاء المرضى. تهدف هذه الدراسة للتحري عن دور الحمضات المفعّلة والبروتين الايوزيني الكاتيوني ECP في إمراضية الـCOPD وحدوث سوراته لدى مرضى سوريين بوساطة تحديد تراكيز ECP المصلية لديهم.
المواد والطرائق Materials and methods
هذه الدراسة من النمط حالة شاهد Case control، تضمنت 87 فردًا، 20 منهم أصحاء ظاهريًا، 32 مريضًا COPD بحالة الهدأة (حالة مستقرة)، و35 مريضًا COPD بحالة السورة، ووُثِقَت بيانات عدة لكل فرد منهم والتي شملت عمره، وجنسه، ومنسب التدخين لديه، فضلًا عن عدد أيام الاستشفاء لدى مرضى السورات. شملت معايير التضمين inclusion criteria في هذه الدراسة أي مريض COPD شُخِّصَ المرض لديه بعد تقويمه من مختص الداخلية الصدرية وإجراء قياس التنفس بالنسبة إلى المرضى، إذ اعتمِدَت النسبة FEV1/FVC <0.7 بعد إرذاذ الموسع القصبي نسبةً تشخيصية، أما بالنسبة إلى الأصحاء فقد نُفيَت إصابتهم به. أما معايير الاستبعاد exclusion criteria فشملت أي مريض لديه واحد أو أكثر مما يأتي: ذبحة أو احتشاء عضلة قلبية، وأمراض تنفسية آخرى ما عدا COPD (مثل الربو والتليف الرئوي)، وأمراض تأتبية (تحسسية)، وتناول أدوية ستيروئيدية في 14 يومًا قبل سحب العينة الدموية. حصلت هذه الدراسة على موافقة لجنة الأخلاقيات الحيوية في جامعة دمشق بتاريخ 6/7/2021 وبرقم 4042، وأُخِذَت موافقة كل فرد للمشاركة في هذه الدراسة بوساطة الموافقة المستنيرة. جُمِعَت العينات الدموية للأصحاء والمرضى في المدة الواقعة بين نيسان، وتشرين الأول من عام 2021، إذ بُزِلَ 5 مل من الدم الوريدي من كل مشارك في هذه الدراسة على أنبوب جاف، وتُرك في درجة حرارة الغرفة حتى تمام التخثر، ومن ثمّ ثُفِلَت العينات بسرعة 1680 Xg ولمدة خمس عشرة دقيقة، أُخِذَ المصل لكل عينة فيما بعد، ووُزِع على ثلاثة أنابيب ابيندروف التي حُفِظَت في الدرجة 80 – Co إلى حين إجراء المعايرة. عُويرَت تراكيز الـECP بالامتزاز المناعي المرتبط بالإنزيم ELISA باستخدام عتيدة Human ECP ELISA Kit لشركة USCN الصينية، وعُمِلَ وفقًا لتعليمات الشركة المصنعة.
الدراسة الإحصائية:
استُخدِمَ برنامج SPSS الإصدار 25 وGraphPad Prism 9، لإنجاز كامل الدراسة الإحصائية، وعُبّرَ عن القيم المختلفة باستخدام المتوسط الحسابي ± الانحراف المعياري، وقُورِنَت قيم تراكيز ECP المصلية للمجموعات المختلفة باستخدام Kruskal-Wallis test، واستُخدِمَ اختبار Mann-Whitney في المقارنة بين قيم مجموعتين فقط، أما لدراسة علاقة الارتباط بين المعالم المختلفة فاستُخدِمَ اختبار chi-square، واعتُمِدَت قيمة p < 0.05 بوصفها قيمة يعتد بها إحصائيًا.
النتائج Results
الخصائص العامة والديموغرافية لأفراد الدراسة
شملت الدراسة 87 فرداً، 23 من الإناث و64 من الذكور وُزِعوا في ثلاث مجموعات رئيسية، ويبين الجدول (1) الخصائص العامة والديموغرافية لهم تبعاً لمجموعاتهم.
| الجدول (1): الخصائص العامة والديموغرافية لأفراد الدراسة | |||
| المتغير | مجموعة الأصحاء
n= 20 |
مجموعة مرضى COPD
n = 67 |
|
| مجموعة الهدأة
n = 32 |
مجموعة السورة
n = 35 |
||
| الجنس*
ذكر أنثى |
13 7 |
25 7 |
26 9 |
| العمر** | 57.25 ± 9.76 | 63.22 ± 8.72 | 68.94 ± 8.99 |
| عدد أيام الاستشفاء** | – | – | 6.86 ± 3.55 |
| حالة التدخين | |||
| مدخن حالي* | 11 | 30 | 32 |
| مدخن سابق* | 0 | 0 | 1 |
| غير مدخن* | 9 | 2 | 2 |
| منسب التدخين**
(علبة / سنة) |
37.45 ± 41.07 | 58.97 ± 32.86 | 66.14 ± 43.99 |
| *عُبّرَ عن هذه القيم بتكرارها
**عُبّرَ عن هذه القيم باستخدام المتوسط الحسابي ± الانحراف المعياري |
|||
نتائج معايرة ECP لدى كامل عينة الدراسة:
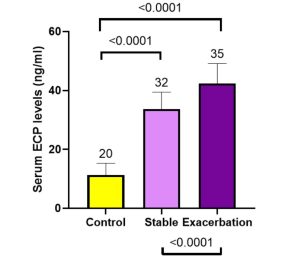
بلغت تراكيز ECP المصلية لدى الأصحاء 11.35 ± 3.92 نغ/مل، ولدى مجموعة مرضى COPD الكلية ±38.24 7.63 نغ/مل. ولدى تقسيم مجموعة مرضى COPD تبعًا لحالة المرض لديهم، كانت تراكيز ECP المصلية لدى مرضى حالة الهدأة 33.69 ± 5.73 نغ/مل، ولدى المرضى في طور السورة 42.4 ± 6.76 نغ/مل.
مقارنة تراكيز ECP بين مجموعتي مرضى COPD الكلية (n= 67) والأصحاء (n=20):
لُوحِظَ ارتفاعٌ في تراكيز ECP لدى مجموعة مرضى COPD الكليّة التي تشمل حالتي الهدأة، والسورة (±38.24 7.63 نغ/مل) وذلك لدى مقارنتها بمجموعة الأصحاء (11.35±3.92 نغ/مل)، وبفارق معنوي يعتد به إحصائيًا p = 0.0001.
مقارنة تراكيز ECP المصلية بين مجموعة المرضى بحالة الهدأة والمرضى بحالة السورات والأصحاء:
لُوحِظَ ارتفاع في تراكيز ECP لدى مرضى COPD بحالة السورة (42.4 ± 6.76 نغ/مل) عند مقارنتها بتراكيز ECP لدى مرضى COPD بحالة الهدأة (33.69 ± 5.73 نغ/مل)، لدى مقارنتها بتراكيز ECP لدى مجموعة الأصحاء (11.35 ± 3.92 نغ/مل) أيضًا، وهذا الاختلاف في تراكيز ECP المصلية لدى المجموعات الثلاث ذو قيمة يعتد بها إحصائيًا p = 0.0001 (الشكل 1). وُجِدَ فارقٌ معنويٌ عند دراسة كل مجموعة مع الأخرى على حدة أيضًا، أي لدى مقارنة تراكيز ECP بين مرضى السورات ومرضى الهدأة p = 0.0001، وكذلك عند مقارنة تراكيزه لدى مرضى السورات والأصحاء p = 0.0001 ولدى المقارنة بين المرضى بحالة الهدأة والأصحاء p = 0.0001 أيضًا (الشكل 1).
مقارنة تراكيز ECP بين الذكور والإناث في كل مجموعة من المرضى:
لم نجد فرقًا معتدًا به إحصائيًا في تراكيز ECP المصلية بين الذكور والإناث في مجموعة الأصحاء وكذلك في مجموعتي المرضى (في حالة الهدأة وحالة السورة) إذ بلغت قيمة P (0.524، 0.583 و0.850) على الترتيب.
ارتباط تراكيز ECP مع العمر بكل مجموعة:
لم نجد ارتباطًا معنويًا بين العمر وتركيز ECP لدى كل مجموعة إذ بلغت قيمة P لدى الأصحاء 0.459، ولدى المرضى بحالة الهدأة 0.547، أما لدى مرضى السورات فبلغت 0.590.
العلاقة بين تراكيز ECP وعدد أيام الاستشفاء لدى مرضى السورات:
لم نجد ارتباطًا معنويًا بين تراكيز ECP وعدد أيام الاستشفاء P = 0.802 لدى مرضى سورات الـCOPD.
الارتباط بين منسب التدخين وتراكيز ECP لدى كل مجموعة على حدة:
لم نجد ارتباطًا معنويًا بين منسب التدخين وتراكيز ECP لدى الأصحاء ومجموعتي المرضى (في حالة الهدأة وحالة السورة) إذ بلغت قيمة P 0.183 و0.319 و0.405 على الترتيب.
المناقشة Discussion
تُعَد الاستجابة الالتهابية المزمنة والمترقية في السبل التنفسية السمة الرئيسة المميزة لإمراضية الداء الرئوي الانسدادي المزمن COPD، الذي يُشَخَّص على نحو رئيس باستخدام قياس التنفس Spirometry [1, 2]، يعتمد قياس التنفس على تأكيد وجود تحدد هوائي من عدمه من دون أن يعطي أية فكرة عن الآلية الإمراضية أو الاستجابة الالتهابية، وترقيها في أثناء تطور هذا المرض [12, 13]. ومن ثمَّ من المفيد تحديد واصمات حيوية تقيّم هذه الاستجابة الالتهابية من حيث نوعها وشدتها وترقيها وهذا قد يسهم بزيادة فهم الآلية الإمراضية المسببة للـCOPD، ومراقبة تطور المرض، وقد يحسّن هذا الأمر من تدبير مرضى الـCOPD أيضًا. ومع أنّ نمط الاستجابة الالتهابية السائد في هذا الداء هو ذاك المتواسط بالعدلات، فقد أشارت العديد من الدراسات إلى دور الحمضات في رد الفعل المناعي المميز للـCOPD [5-8]، ولكن من دون التطرق إلى دور تفعيلها، وما يرافقه من إفراز محتوياتها في رد الفعل المناعي هذا. تفرز الحمضات محتويات حبيباتها عقب تفعيلها، وهجرتها إلى مواقع الالتهاب، ويُعَد البروتين الايوزيني الكاتيوني ECP واحداً من أبرز البروتينات المتحررة من حبيبات الحمضات، وتُعَد تراكيزه مشعرًا في التحري عن تفعيلها، ويتمتع هذا البروتين بفعاليات بيولوجية متعددة سامة وغير سامة للخلايا تجعله محط اهتمام لدراسة دوره وتأثيره في الأمراض المختلفة كالـCOPD [9, 10]. أظهرت الدراسة الحالية ارتفاعًا ملحوظًا في تراكيز ECP لدى مجموعة مرضى COPD لدى المقارنة بالأصحاء، ما يشير إلى حدوث تفعيل للحمضات لدى هؤلاء المرضى وإفرازها ـECP وغيره من محتويات حبيباتها مثل السيتوكينات مثل IL-2، IL-3 وعوامل النمو مثل عامل النخر الورمي tumor necrosis factor (TNF) التي تتداخل جميعها بإبقاء الاستجابة الالتهابية مستمرة في الرئتين وبالأذية النسيجية الحاصلة [5]. ويمكن تفسير دور ـECP بهذه الأذية النسيجية المميزة للـCOPD بوساطة ما يتمتع به من قدرة على تحريض الموت الخلوي المبرمج للخلايا الظهارية في السبل التنفسية بتفعيل شلال الكاسباز Caspase cycle، ويسهم في إعادة تشكيل (نمذجة) نسيج السبل التنفسية وما يرافق ذلك من حدوث تليف لهذه الأنسجة بوساطة جذبه للأرومة الليفية، وتحريض زيادة اصطناع البروتيوغليكان، وتثبيط تحلله ما يؤدي إلى تراكمه ضمن الخلايا [9]. وجد فيوريني وزملاؤه [14] نتائج مشابهة من حيث ارتفاع تراكيز ECP لدى مرضى COPD بالحالة المستقرة بالمقارنة مع تراكيزه لدى الأصحاء. أظهرت الدراسة الحالية ارتفاعًا كبيرًا في تراكيز ECP لدى مرضى سورات الـCOPD عند مقارنتها بمرضى الهدأة أيضًا، أي ازداد تفعيل الحمضات في أثناء سورات المرض ضمن السبل التنفسية وذلك يترافق مع زيادة في إفراز المكونات الموجودة ضمنها، وأبرزها البروتين الايوزيني الكاتيوني ذو الفعالية السامة للخلايا [11]، والذي يحطم ظهارة السبل التنفسية، ويزيد إفراز المخاط [15] ويؤدي إلى تقلص العضلات الملس في السبل التنفسية [16]، أي يسهم بإمراضية هذه السورات، وأعراضها المرافقة مثل زيادة إنتاج البلغم وشدة الزلة التنفسية [1]. وُجِدَت نتائج مماثلة في دراسة عثمان وزملائه في مصر التي أشارت إلى دور ECP في حدوث سورات COPD [17]، وكذلك في دراسة يانغ وزملائه في الصين [11] الذين درسوا دور تفعيل الحمضات في حدوث سورات COPD بوساطة معايرة تراكيز ECP إلى جانب البروتينات الثلاثة الرئيسة المتحررة من حبيبات الحمضات لدى تفعيلها وهي البروتين الأساسي القاعدي، والبروكسيداز الايوزيني، والسم العصبي المشتق من الحمضات. تُعَد سورات الـCOPD أحد أبرز الأسباب المرتبطة بالعبء الاقتصادي الكبير لهذا المرض، وكذلك السبب الرئيس للاستشفاء لدى المصابين به [1]، ويمكن أن يفيد تحديد العوامل المرتبطة بطول مدة الاستشفاء لدى كل مريض باتخاذ تدابير علاجية تسهم في تقليل هذه المدة، ولم تظهر نتائجنا وجود ارتباط ما بين تراكيز ECP وطول مدة الاستشفاء لدى مرضى السورات، ومن ثمَّ يسهم الـECP بإمراضية وحدوث سورات الـCOPD ولكن لا يمكن الاعتماد على تراكيزه في التنبؤ بطول مدة الاستشفاء.
الاستنتاجات Conclusions
أظهرت نتائج الدراسة الحالية ارتفاع تراكيز ECP المصلية لدى مرضى COPD، وترافقت تراكيزه الأشد ارتفاعًا مع طور سورة الـCOPD، ما يجعل من ECP واصمًا حيويًا محتملًا في التحري عن شدة الاستجابة الالتهابية المتواسطة بالحمضات وترقيها لدى مرضى CPOPD. لم تُظهِر الدراسة أي علاقة بين تراكيز الـECP وعمر المريض أو جنسه أو منسب التدخين، ولم تُظهِر علاقة بين تراكيزه، ومدة الاستشفاء لدى مرضى السورات.
المراجع :- Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. 2022.
- Barnes, P.J., et al., Chronic obstructive pulmonary disease. Nat Rev Dis Primers, 15076. 2015
- https://www.who.int/news-room/fact-sheets/detail/chronic-obstructive-pulmonary-disease-(copd). accessed on 16 – 6- 2022.
- Alzaabi, A., S. Toor, and M.I. Saleem, Review of COPD in Middle East and Gulf countries. Medical Research Archives. 7(2).2019.
- David, B., et al., Eosinophilic inflammation in COPD: from an inflammatory marker to a treatable trait. Thorax. 76(2). 188-195.2021.
- Bafadhel, M., I.D. Pavord, and R.E.K. Russell, Eosinophils in COPD: just another biomarker? Lancet Resipr Med. 5(9): p. 747-759. 2017.
- Brusselle, G., et al., Blood eosinophil levels as a biomarker in COPD. Respiratory Medicine. 138. 21-31. 2018.
- Liu, H.-X., N. Cui, and Y.-F. Li, the correlation between chronic obstructive pulmonary disease and eosinophil in peripheral blood. European Journal of Inflammation. 19. 1-5. 2021
- Topic, R.Z. and S. Dodig, Eosinophil cationic protein–current concepts and controversies. Biochem Med (Zagreb). 21(2). 111-21. 2011.
- Bystrom, J., K. Amin, and D. Bishop-Bailey, Analysing the eosinophil cationic protein–a clue to the function of the eosinophil granulocyte. Respir Res. 12. 10. 2011.
- Yang, Q.F., et al., Eosinophilic biomarkers for detection of acute exacerbation of chronic obstructive pulmonary disease with or without pulmonary embolism. Exp Ther Med. 14(4). 3198-3206. 2017.
- Letuve, S., et al., YKL-40 is elevated in patients with chronic obstructive pulmonary disease and activates alveolar macrophages. J Immunol. 181(7). 5167-73. 2008.
- Ranu, H., M. Wilde, and B. Madden, Pulmonary function tests. Ulster Med J. 80(2). 84-90. 2011
- Fiorini, G., et al., Serum ECP and MPO are increased during exacerbations of chronic bronchitis with airway obstruction. Biomed Pharmacother. 54(5). 274-8. 2000
- de Oliveira, P.C., et al., Eosinophil cationic protein: overview of biological and genetic features. DNA Cell Biol. 31(9). 1442-6. 2012.
- Acharya, K.R. and S.J. Ackerman, Eosinophil granule proteins: form and function. J Biol Chem. 289(25). 17406-15. 2014.
- Osman, O., R.A.E. Zohne, and A.A. Elminshawy, Eosinophilic cationic protein as a marker for detection of acute exacerbations of patients with chronic obstructive pulmonary disease The Egyptian Journal of Chest Diseases and Tuberculosis. 70(2). 205-207. 2021.