تواتر الأليل ناقص الوظيفة CYP2D6*10 وتحرّي تأثيره في المحصّلات السّريريّة للمعالجة بالتاموكسيفين لدى مريضات سرطان ثدي سوريّات
2023-07-01 | المجلد السابع العدد الثاني - المجلد السابع | مقالات بحثيةسارة الرجال | لمى يوسف
الملخص
خلفيّة وأهداف البحث: يُعدّ CYP2D6 الإنزيم المفتاحيّ للتّفعيل الحيويّ للتّاموكسيفين، وترمّزه جين شديدة التّعقيد وكثيرة التّعدّدات الشّكليّة، والتي يؤثّر بعضها في فعّاليّة الإنزيم وبالتّالي في المحصّلات السّريريّة للمعالجة بالتّاموكسيفين. هدفت دراستنا إلى تحرّي تواتر الأليل ناقص الوظيفة CYP2D6*10 المعرّف بالاستبدال 100C>T وتقويم تأثير النّمط الجينيّ في النّكس لدى مريضات سرطان ثدي سوريّات معالجات بالتّاموكسيفين.
المواد والطرائق: شملت دراستنا الوصفيّة من نمط حالة-شاهد مريضات سرطان ثدي ممّن تلقين علاجاً مساعداً بالتّاموكسيفين. تحرّينا الأنماط الجينيّة لـ CYP2D6*10 عن طريق السّلسلة المعياريّة لمنتجات تضخيم تفاعل البوليميراز التسلسلي (PCR) لموقع جين CYP2D6 الحاوي على الاستبدال 100C>T. اعتُمدت البقيا الخالية من المرض لتقييم المحصّلات، واستُعملت منحنيات كابلان ماير واختبار Log-Rank الإحصائيّ لتقييم العلاقة بين الأنماط الجينيّة والبقيا الخالية من المرض.
النتائج: حقّقت 103 مريضات معايير التّضمين وتوزعّن بين ذراع الحالة الذي ضمّ 61 مريضة نكسن خلال خمس سنوات من بدء المعالجة، وذراع الشّاهد الذي اشتمل 42 مريضة أتممن مدّة العلاج لخمس سنوات على الأقل دون نكس. بلغ تواتر الأليل 10* نسبة قدرها 19.7% لدى النّاكسات مقارنة بـ 16.7% لدى المستجيبات، ودون وجود فارقٍ معتدّ به إحصائيّاّ في توزّع الأليل الطّافر أو الأنماط الجينيّة الثلاثة (CT وTT وCC) بين ذراعيّ الدّراسة (P=0.585،P=0.826 على التّوالي). بيّنت دراستنا عدم وجود فارقٍ ذي دلالةٍ إحصائيّة (0.912P=) في وسيط البقيا الخالية من المرض بين مجموعات الأنماط الجينيّة الثّلاثة.
الاستنتاجات: بيّنت دراستنا غياباً لتأثير الأليل 10* بمفرده في المحصّلات السّريريّة للمعالجة بالتّاموكسيفين لدى مريضات سرطان ثدي سوريّات متغايرات أو متماثات الزّيجوت، ممّا يوجّب استقصاء ألائل أخرى (مثل الأليلين *4 و*41) بهدف مكاملة البيانات وتفسير التّباينات في فعاليّة التاموكسيفين بين الأفراد.
كلمات مفتاحية : سرطان الثدي، تاموكسيفين، الأليل CYP2D6*10، CYP2D6، النمط الجيني، 100C>T، سورية.
المقدمة Introduction
يُعدّ سرطان الثّدي أكثر أنواع السّرطانات انتشاراً في العالم، حيث قُدّر عدد الحالات المشخّصة بـ2.3 مليون إصابة في عام 2020 متفوّقاً بذلك على سرطان الرّئة (Sung et al., 2021). تُعبّر 80% من سرطانات الثّدي الغازية عن المستقبلات الهرمونيّة؛ مستقبلات الإستروجين estrogen receptors(ERs) و/أو مستقبلات البروجسترون progesterone receptors (PRs)(Hwang et al., 2017). وبناءً عليه تُعدّ المعالجة الهرمونيّة، وعلى الأخصّ المحوّرات الإنتقائيّة لمستقبلات الإستروجين selective estrogen receptor modulators (SERMs)، الخط العلاجيّ الأوّل لسرطانات الثّدي إيجابيّة المستقبلات الهرمونيّة ويتصدّر التاموكسيفين قائمة هذه الأدوية. يستعمل التاموكسيفين سريريّاً منذ أكثر من أربعين عاماً كعلاج مساعد في سرطان الثّدي إيجابي المستقبلات الهرمونيّة عند النّساء في مرحلة ما قبل سنّ الإيّاس وما بعده، حيث أنّ المعالجة الهرمونيّة بالتاموكسيفين لمدة خمس سنوات بعد الجراحة تٌقلّل من خطر حدوث النّكس بنسبة 50% وتُخفّض نسبة الوفيّات بمقدار الثّلث(Goetz et al., 2018). كما يُعدّ التاموكسيفين العلاج الهرمونيّ الوحيد الحائز على موافقة إدارة الغذاء والدّواء الأمريكيّة Food and Drug Administration FDA)) للوقاية من سرطان الثّدي لدى النّساء في مرحلة ما قبل سنّ الإيّاس اللواتي يبدين اختطاراً عالياً للإصابة بالمرض، ولعلاج السّرطانة القنويّة اللابدة في الموضعductal carcinoma in situ (DCIS)، وعلاج سرطانات الثّدي النقائليّة (Goetz et al., 2018) metastatic breast cancers. لكن، وعلى الرّغم من نجاعة العلاج بالتاموكسيفين عند غالبيّة المريضات وأهميّته كعاملٍ وقائيٍّ وعلاجيٍّ في سرطان الثّدي، فإنّ نسبةً تتراوح بين 30 – 50% من المريضات المعالجات بالتاموكسيفين يتعرّضن للنّكس ممّا يشير إلى وجود تباينات بين الأفراد في الاستجابة للتاموكسيفين (Drögemöller et al., 2019). تُسهم عدة عوامل في هذه التّباينات، مثل نمط سرطان الثّدي ودرجة وصول الخباثة إلى العقد اللمفاويّة ومطاوعة المريضة للعلاج والعلاجات الكيميائيّة المصاحبة والتّآثرات الدّوائية مع الأدوية المصاحبة ووجود أحد التّعدّدات الشكليّة الجينيّة genetic polymorphisms المؤثّرة في وظيفة الإنزيمات التي تستقلب التاموكسيفين (Wigle et al., 2017). يُعَرَّف التاموكسفين بأنّه طليعة دواء prodrug ضعيف الألفة لمستقبلات الإستروجين ويتطلّب تفعيلاً حيويّاً بتواسط إنزيمات السيتوكروم cytochrome P450 في الكبد إلى المستقلبات الأكثر فعاليّة، وأهمّها 4-هيدروكسي التاموكسيفين 4-hydroxytamoxifen (4HT) و4-هيدروكسي التاموكسيفين منزوع الميتيل hydroxy-N-desmethyltamoxifen 4-أو ما يُعرف بالإندوكسيفين endoxifen، وهذان المركّبان يمتلكان ألفة تجاه مستقبلات الإستروجين تفوق التاموكسيفين بـ 100 ضعفٍ، وتفوق فعاليّتهما في كبح تكاثر خلايا سرطان الثّدي المعتمدة على هرمون الإستروجين فعالية التاموكسفين بـ 30 إلى 100 ضعف. يتكافأ المستقلبان 4HT والإندوكسيفين في الفعاليّة، لكن مستويات الإندوكسيفين البلازميّة تفوق تلك العائدة لـ4HT بـ5 إلى 10 أضعاف، لذلك تعزى الفعاليّة والأهميّة السّريريّة بصورةٍ رئيسيّة للإندوكسيفين (Binkhorst et al., 2015; Wigle et al., 2017). على الرغم من اشتراك العديد من إنزيمات السّيتوكروم الكبديّة في عمليّة استقلاب التاموكسفين، يُعدّ إنزيم CYP2D6 الأهمّ في تحديد الاستجابة لكونه الإنزيم المفتاحيّ في التّفعيل الحيوي للتاموكسيفن وتشكّل الإندوكسيفين. تقع الجين المرمّزة لإنزيم CYP2D6 على الذّراع الطّويل (q) للصّبغي 22 في الموقع 13.1 (22q13.1) ويجاوره جينان كاذبان pseudogenes غير وظيفيين هما CYP2D7 وCYP2D8 .(Ingelman-Sundberg, 2005) يُؤدّي التّشابه الكبير في التّسلسل النّيكليوتيدي لهذين الجينين الكاذبين المجاورين للجين المرمّزة لإنزيم CYP2D6 إلى زيادة احتماليّة حدوث حذوفات أو إضافات أو استبدالات للنّيكليوتيدات أو إعادة ترتيب أو حذف أو تضاعف الجين بأكملها مما يُؤدّي إلى تشكّل ألائل مختلفة لإنزيم (Gaedigk, 2013) CYP2D6، لذلك يُعدّ إنزيم CYP2D6 شديد تغاير النّمط الشّكلي حيث تمّ استعراف أكثر من 140 تعدّد شكلي مفرد النّيكليوتيدSingle nucleotide polymorphisms (SNPs) حتى الآن (Gaedigk, 2022). تُصنّف هذه الألائل حسب فعاليّتها الوظيفيّة، فإمّا أن تكون طبيعيّة الفعاليّة الوظيفيّة (مثل CYP2D6*1 و*2) أو منقوصة الفعاليّة الوظيفيّة (مثل CYP2D6*9 و*10 و*17 و*41) أو عديمة الفعاليّة الوظيفيّة (مثل CYP2D6*3 و*4 و*5) أو فائقة الفعاليّة الوظيفيّة نتيجة تضاعف عدد النّسخ (مثل *1xNو *2xNو*35xN). يُترجم النّمط الجيني بعدها إلى أربعة أنماط ظاهريّة اعتماداً على شفع الألائل التي يمتلكها كل فرد في تركيبته الجينيّة، وبالتالي يمكن أن يكون الفرد ضعيف الاستقلاب poor metabolizer (PM) أو متوسّط الاستقلاب intermediate metabolizer (IM) أو طبيعي الاستقلاب normal metabolizer (NM) أو فائق الاستقلاب ultrarapid metabolizer (UM)(Goetz et al., 2018). يُعدّ الاليل CYP2D6*10أحد أهمّ الألائل ناقصة الوظيفة، وينتج عن طفرة نقطيّة (100C>T) في الإكسون 1 حيث يحل الثايمين محل السيتوزين في الموقع 100 وبالتالي يحلّ الحمض الأميني السّيرين محل البرولين، وينتج عن ذلك إنزيم غير ثابت بفعاليّة ضعيفة وألفة منخفضة تجاه الرّكازات (Ingelman-Sundberg, 2005). على الرّغم من الدّور البالغ الأهمية لإنزيم CYP2D6 في فعاليّة التاموكسيفين، لاتزال التّأثيرات الإجمالية للأليل ناقص الوظيفة CYP2D*10 في المحصّلات السّريريّة للمعالجة غير واضحة نتيجة للتّناقض الكبير في نتائج الدّراسات. وفي ظل غياب البيانات حول تواتر الأليل CYP2D6*10 لدى السّوريّين بالرّغم من انتشاره الواسع عند الآسيوييّن وشعوب بلدان الشّرق الأوسط، هدفت هذه الدّراسة إلى استقصاء تواتر الأليل CYP2D6*10 ودراسة العلاقة بين النّمط الجينيّ لـ 100C>T والاستجابة للتاموكسيفين لدى مريضات سرطان ثدي سوريّات.
المواد والطرائقMaterials and Methods
تصميم وجمهرة الدراسة
صُمّمت دراستنا لتكون دراسة وصفيّة observational من نمط حالة شاهد case-control على جمهرة مريضات ثدي سوريّات مراجعات لوحدة الثّدي في مستشفى البيروني الجامعيّ في الفترة الممتدّة بين كانون الثّاني وأيار2019. ضمّ ذراع الحالة مريضات سرطان ثدي عولجن بالتاموكسيفين ونكسن خلال فترة المعالجة، بينما ضمّ ذراع الشّاهد مريضات سرطان ثدي أتممن العلاج بالتاموكسيفين لمدة خمس سنوات على الأقل دون أن يبدين أيّة علامة من علامات النّكس. شملت معايير التّضمين مريضات في مرحلة ما قبل سنّ الإيّاس وما بعده بأعمار أكبر من 18 عاماً مصابات بسرطان ثدي إيجابي مستقبلات الإستروجين و/أو البروجسترون الهرمونيّة (ER+ و/أو PR+) ممّن تلقين معالجة مساعدة وحيدة بالتاموكسيفين تالية للجراحة. بينما استُبعدت المريضات المصابات بسرطان ثدي نقيلي أو سلبي المستقبلات الهرمونيّة (ER-/PR-) أو اللواتي نكسن بعد أقل من ثلاثة أشهر من بدء المعالجة بالتاموكسيفين أو ذوات المطاوعة السّيئة للعلاج، بالإضافة إلى المريضات اللواتي تلقين معالجة كيميائيّة خلال فترة المعالجة بالتاموكسيفين أو اللواتي تلقين علاجاً بأدوية هرمونيّة أخرى. جمعت البيانات الديموغرافيّة والمعلومات المتعلّقة بجمهرة الدّراسة مثل العمر والحالة الطمثيّة عند التّشخيص والتّدخين والتّاريخ العائلي لسرطان الثّدي والتأثيرات الجانبيّة للعلاج بالتاموكسيفين ومعلومات حول خصائص الورم ونمط الجراحة والعلاجات الكيميائيّة والإشعاعيّة السّابقة وتاريخ وموضع النّكس من السّجلات الطبيّة للمريضات والمقابلات الشّخصيّة مع المريضات. حازت هذه الدّراسة على موافقة لجنة أخلاقيّات البحث العلمي في كليّة الصّيدلة في جامعة دمشق وأعطت جميع المريضات موافقاتهنّ المستنيرة قبل المشاركة في الدّراسة.
التّنميط الجينيّGenotyping واستعراف الأليل CYP2D6*10
أُجري العمل المخبريّ في مخبر التّقانات الحيويّة الصيدلانيّة والمناعيّة في الهيئة العامّة للتّقانة الحيويّة. بُزلت عيّنات دم محيطي (3 مل) من كلّ مريضة من مريضات الدّراسة ضمن أنابيب حاوية على مضاد تخثر EDTA وحفظت العيّنات بدرجة حرارة (-20oC) إلى حين إجراء عزل الدنا المجينيّ gDNA. استُخلص الدنا المجينيّ من العينات باستخدام عتيدة Wizard® Genomic DNA Purification Kit من شركة Promega وفقاً للتّعليمات المرفقة مع العتيدة. حُدّد النّمط الجينيّ بسلسلة منتجات تضخيم المنطقة الحاوية على الاستبدال 100C>T في الإكسون 1 من جين CYP2D6 عن طريق تفاعل البوليميراز التّسلسليpolymerase chain reaction (PCR) وفقاً للخطوات التّالية: حُضّر مزيج التّفاعل باستعمال حجم مناسب من الدنا المعزول و0.5 ميكرولتر يكافئ تركيز 10 بيكومول/مكل من كلّ من المشرّع التّقدمي forward primer ذي التسلسل (5’-CCATTTGGTAGTGAGGCAGGTAT-3’) والمشرّع العكسيّ reverse primer ذي التسلسل (5’- CACCATCCATGTTTGCTTCTGGT-3’) و10 مكرولتر من مزيج التّفاعل الرئيسيّ مسبق التّحضير OnePCR™ (GeneDirex®) وأُكمل حجم التّفاعل النّهائيّ إلى 20 ميكرولتر باستخدام الماء المنقّى الخالي من النّوكلياز nuclease-free water. ضُبطت شروط جهاز المدوّر الحراريّ وفقاً للشّروط الواردة في دراسة Xu وزملائه (2008) مع إجراء بعض التّعديلات من أجل أمثلة الشّروط كما هو مُوضّح في الجدول (1)(Xu et al., 2008). رُحّلت منتجات التّفاعل كهربائيّاً على هلامة أغاروز بتركيز 1.5% موسومة ببروميد الإيثيديوم وعُرّضت الهلامة بعد ذلك للأشعّة فوق البنفسجيّة لإظهار العصابات حيث يدلّ وجود منتج وحيد بطول 271 زوج أساس (bp) على نجاح تفاعل الـPCR . أُرسلت منتجات التّفاعل إلى شركة Macrogen في مدينة سيؤول-كوريا الجنوبيّة حيـث أُجـري تفاعـل السّلسـلة المعياريّ بطريقة سينجر Sanger Sequencing باستعمال المشرّع التّفدميّ وجهاز ABI PRISM® 3730XL DNA Analyzer وعتيدة السّلسلة الموافقة ABI PRISM® BigDyeTM بعد تنقية منتجات التّفاعل بواسطة إنزيم EnzSAP™، ومن ثمّ قمنا بقراءة نتائج السّلسلة باستعمال برمجيّة Chromas.
نقطة النهاية والاختبارات الإحصائيّة End point and statistical analyses
استُعمل اختبار Independent Samples T test للمقارنة بين متوسّطات البيانات الكميّة المستمرّة واختبار كاي للتّربيع Chi-square وفيشرFisher’s exact test لمقارنة توزّع المريضات بين ذراعيّ الدّراسة بالنّسبة للبيانات الفئويّة ولدراسة العلاقة بين النّمط الجينيّ والاستجابة للتاموكسيفين. اعتُمدت منحنيات كابلان-ماير Kaplan–Meier واختبار Log rank لحساب وسيط ونسب البقيا الخالية من المرضDisease Free Survival (DFS) بين مجموعات الأنماط الجينيّة المختلفة. اعتُمدت البقيا الخالية من المرض كنقطة نهاية end point في دراستنا وعُرّفت بأنّها الفترة الممتدّة من بدء المعالجة بالتاموكسيفين حتى حدوث النّكس (سواءً كان موضعيّاً أو ناحيّاً أو نقائليّاً) أو إصابة الثّدي الآخر أو الوفاة لأيّ سبب كان. استُعمل نموذج كوكس للمخاطر النسبيّة Cox proportional hazards لتحديد العوامل الإنذاريّة ذات الأهميّة واختبار أيّة مساهمات مستقلّة للعامل الجينيّ في حدوث النّكس. اعتُمدت قيمة P<0.05 قيمةً معتداً بها إحصائيّاً لجميع الاختبارات الإحصائيّة وأجريت الاختبارات باستعمال برمجيّة SPSS بإصداره الخامس والعشرين وGraphPad Prism بإصداره التاسع.
| الجدول (1): شروط تفاعل الـPCR لتضخيم المنطقة الحاوية على الاستبدال 100C>T | |||||
| خطوات التّفاعل | التّمسّخ البدئيّ
Initial denaturation |
التّمسّخ
Denaturation |
التّلدين
Annealing |
الاستطالة
Elongation |
الاستطالة النهائيّة
Final elongation |
| درجة الحرارة | 94oC | 94oC | 60oC | 72oC | 72oC |
| المدّة | 15 دقيقة | 30 ثانية | 45 ثانية | 45 ثانية | 10 دقائق |
| عدد الدّورات | 35 دورة | ||||
النّتائجResults
الخصائص السريريّة لمريضات الدّراسة وسمات الورم
حقّقت 103 مريضات معايير التّضمين وتوزّعن بين ذراع الحالة (n=61) وذراع الشّاهد (n=42). بلغ متوسط العمر للمريضات المشاركات في الدّراسة عند تشخيص المرض 48.88 ± 8.98 عاماً. كانت حوالي نصف المريضاتn=53 (51.5%) في مرحلة ما بعد سنّ الإيّاس ومعظمهنّn=83 (%80.6) من غير المدخّنات فيما أبلغت 28 مريضة (27.2%) عن تاريخ عائليّ للإصابة بسرطان الثّدي لدى قريبات من الدّرجة الأولى والثّانية. عانت قرابة نصف المريضاتn=50 (48.5%) من ورم من الدّرجة الثّانية وتراوح حجم الورم لدى58 مريضة (56.3%) بين 2 -5 سم، كما لوحظ زيادة التّعبير عن مستقبلات عامل النّمو البشريّ الثّاني Human epidermal growth factor receptor 2 (HER2) عند 21 مريضة (20.4%) في حين كانت معظم المريضات n=76 (73.8%) إيجابيّات المستقبلين الهرمونييّن ER وPR معاً. خضعت غالبيّة المريضات n=95 (92.2%) لاستئصال كامل الثّدي وللعلاجين الإشعاعيّ والكيميائيّ بعد العمل الجراحيّ n=89 (86.4%). لم تكن الفوارق معتدّاً بها إحصائيّاً لدى مقارنة المتثابتات السّابقة بين ذراعيّ الدّراسة، باستثناء وجود نزعة trend لازدياد عدد العقد اللمفيّة المنخرطة وزيادة التّعبير عن مستقبليّ الإستروجين والبروجسترون معاً في ذراع الحالة بالمقارنة مع ذراع الشّاهد (الجدول 2).
تواتر الأنماط الجينيّة والأليل CYP2D6*10 في جمهرة الدّراسة
بيّنت نتائج السّلسلة وجود الأنماط الجينيّة الثّلاثة في جمهرة الدّراسة (الشّكل 1) حيث نُمّطت 78 مريضة (75.7%) على أنّهنّ متماثلات الزّيجوت للنّمط الشّائع CC، في حين حملت 12 مريضة (11.7%) النّمط الجينيّ متخالف الزّيجوت CT، وكانت 13 مريضة (12.6%) من النّمط الجينيّ متماثل الزّيجوت للأليل المتغاير TT. وبلغ تواتر الأليل الطّافر T نسبة قدرها 18.4% في جمهرة الدّراسة، حيث بلغ تواتره في ذراع الحالة 19.7% في حين بلغ تواتره 16.7% في ذراع الشّاهد. أمّا الأليل الشّائع C فبلغ تواتره نسبة قدرها 81.6% في جمهرة الدّراسة وبنسبةٍ قدرها 80.3% في ذراع الحالة مقارنةً بـ83.3% في ذراع الشّاهد، ولم يوجد فارقٌ ذو دلالةٍ إحصائيّةٍ في تواتر الألائل بين ذراعي الدّراسة (P=0.585).
| الجدول (2): الخصائص الديموغرافيّة وخصائص الورم والمتثابتات السّريريّة لمريضات الدّراسة | ||||
| المثابتات | ذراع الشّاهد
n=42 العدد (%) |
ذراع الحالة
n=61 العدد (%) |
إجمالي المريضات
n=103 العدد (%) |
قيمة P |
| العمر عند التّشخيص | ||||
| المتوسط الحسابي ±الانحراف المعياري | 49.1 ±8.54 | 48.73 ±9.4 | 48.88 ±9.01 | 0.368 |
| الحالة الطّمثيّة عند تشخيص المرض | ||||
| قبل سن الإيّاس | 13 (31.0) | 20 (32.8) | 33 (31.7) | 0.956 |
| بعد سن الإيّاس | 22 (52.4) | 31 (50.8) | 53 (51.5) | |
| حول سن الإيّاس | 7 (16.7) | 9 (14.8) | 16 (15.8) | |
| غير معروف | 0 (0) | 1 (1.6) | 1 (1.0) | |
| التّدخين | ||||
| غير مدخّنة | 32 (76.2) | 51 (83.6) | 83 (80.6) | 0.377 |
| مدخّنة | 6 (14.3) | 7 (11.5) | 13 (12.6) | |
| مدخّنة سابقة | 4 (9.5) | 2 (3.3) | 6 (5.8) | |
| غير معروف | 0 (0) | 1 (1.6) | 1 (1) | |
| تاريخ عائلي للإصابة بسرطان الثّدي | ||||
| لا يوجد | 31 (73.8) | 43 (70.5) | 74 (71.8) | 0.811 |
| يوجد | 11 (26.2) | 17 (27.9) | 28 (27.2) | |
| غير معروف | 0 (0) | 1 (1.6) | 1 (1) | |
| المستقبلات الهرمونيّة | ||||
| ER+/PR+ | 26 (61.9) | 50 (82) | 76 (73.8) | 0.060 |
| ER+/PR- | 5 (11.9) | 4 (6.6) | 9 (8.7) | |
| ER-/PR+ | 7 (16.7) | 3 (4.9) | 10 (9.7) | |
| غير معروف | 4 (9.5) | 4 (6.6) | 8 (7.8) | |
| مستقبلات HER2 | ||||
| HER2- | 29 (69) | 33 (54.1) | 62 (60.2) | 0.144 |
| HER2+ | 6 (14.3) | 15 (24.6) | 21 (20.4) | |
| غير معروفة | 7 (16.7) | 13 (21.3) | 20 (19.4) | |
| حجم الورم | ||||
| Tx | 2 (4.8) | 1 (1.6) | 3 (2.9) | 0.358 |
| Tis | 1 (2.4) | 0 (0) | 1 (1) | |
| T1 | 6 (14.3) | 4 (6.6) | 10 (9.7) | |
| T2 | 21 (50) | 37 (60.7) | 58 (56.3) | |
| T3 | 6 (14.3) | 13 (21.3) | 19 (18.4) | |
| T4 | 3 (7.1) | 3 (4.9) | 6 (5.8) | |
| غير معروف | 3 (7.1) | 3 (4.9) | 6 (5.8) | |
| انخراط العقد اللّمفيّة | ||||
| N0 | 13 (31) | 8 (13.1) | 21 (20.4) | 0.052 |
| N1 | 12 (28.6) | 16 (26.2) | 28 (27.2) | |
| N2 | 11 (26.2) | 21 (34.4) | 32 (31.1) | |
| N3 | 3 (7.1) | 13 (21.3) | 16 (15.5) | |
| غير معروف | 3 (7.1) | 3 (4.9) | 6 (5.8) | |
| الدّرجة | ||||
| I | 0 (0) | 1 (1.6) | 1 (1) | 0.476 |
| II | 23 (54.8) | 27 (44.3) | 50 (48.5) | |
| III | 13 (31) | 20 (32.8) | 33 (32) | |
| غير معروف | 6 (14.3) | 13 (21.3) | 19 (18.4) | |
| الجراحات السّابقة | ||||
| استئصال كامل الثّدي (mastectomy) | 41 (97.6) | 54 (88.5) | 95 (92.2) | 0.137 |
| استئصال الكتلة الورميّة (lumpectomy) | 1 (2.4) | 7 (11.50) | 8 (7.8) | |
| المعالجات السّابقة | ||||
| لم تخضع لمعالجات سابقة | 1(2.4) | 0 (0) | 1 (1) | 0.363 |
| معالجة كيميائيّة فقط | 6 (14.3) | 7 (11.5) | 13 (12.6) | |
| معالجة كيميائيّة وإشعاعيّة | 35 (83.3) | 54 (88.5) | 89 (86.4) | |
يُبيّن الجدول (3) توزّع الأنماط الجينيّة بين مجموعة المريضات النّاكسات (ذراع الحالة) ومجموعة المريضات المستجيبات (ذراع الشّاهد)، حيث تبيّن أن 13.1% من مريضات ذراع الحالة يحملن النّمط الجينيّ متخالف الزّيجوت CT مقابل 9.5% من مريضات ذراع الشّاهد، بينما حملت 13.1% من مريضات ذراع الحالة النّمط الجينيّ متماثل الزّيجوت TT مقابل 11.9% من مريضات ذراع الشّاهد، دون وجود فارقٍ يُعتدّ به إحصائياً (P=0.827).
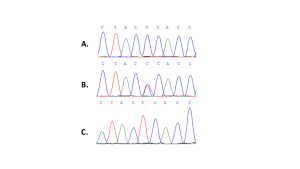
النّمط الجينيّ والبقيا الخالية من المرض DFS
قُيّمت البقيا الخالية من المرض لدى 101 مريضة حيث استُبعِدت مريضتان بسبب تواقت استعمال مثبّطات قويّة لإنزيم CYP2D6 مع المعالجة بالتاموكسيفين بينما كانت المريضة الثّانية مصابة بـDCIS . بلغ وسيط DFS 38.25 شهراً لدى حاملات النّمط الجيني CC و30.5 شهراً لدى حاملات النّمط CT و43.8 شهراً لدى حاملات النّمط TT، ولكن دون وجود فارق يُعتدّ به إحصائيّاً بين المجموعات الثّلاث (P= 0.926). بينما بلغ وسيط DFS 36.8 شهراً لدى المريضات الحاملات لأليل متغيّر واحد على الأقل (CT + TT) مقابل 38.25 شهرأ لدى حاملات النّمط الشّائع، لكن دون وجود فارق يُعتدّ به إحصائيّاً أيضاً (P= 0.869) (الشّكل 2). بيّن نموذج انحدار Cox أن المستقبلات الهرمونيّة (HR=0.528, 95% CI=0.290-0.961, P=0.037) وعدد العقد اللّمفيّة المنخرطة (HR=1.395, 95% CI=1.074-1.811, P=0.012) ونمط الجراحة (HR=2.364, 95% CI= 1.009-5538, P=0.048) كانت العوامل الإنذاريّة المستقلّة الوحيدة المرتبطة بالـ DFS في التّحليل الأحادي. في حين بيّن التّحليل المتعدّد multivariate analysis عدم وجود فارق يُعتدّ به إحصائيّاً في الـ DFS بين مجموعات الأنماط الجينيّة الثّلاث حتّى بعد التّعديل للعوامل الإنذاريّة السّابقة (الجدول 4).
| الجدول (3): تواتر وتوزّع الأنماط الجينيّة للاستبدال 100C>T بين ذراعيّ الدّراسة | ||||
| النّمط الجينيّ | ذراع الشّاهد
n= 42 |
ذراع الحالة
n= 61 |
إجمالي المريضات
n=103 |
قيمة P |
| CC | 33 (78.6) | 45 (73.8) | 78 (75.7) | 0.827 |
| CT | 4 (9.5) | 8 (13.1) | 12 (11.7) | |
| TT | 5 (11.9) | 8 (13.1) | 13 (12.6) | |

| الجدول (4): نموذج انحدار Cox للمخاطر النّسبيّة لـDFS | ||||||
| Multivariate* | Univariate | |||||
| P | 95% CI | HR | P | 95% CI | HR | Genotype |
| – | – | Reference | – | – | Reference | CC |
| 0.744 | 0.476-2.822 | 1.159 | 0.712 | 0.542-2.450 | 1.152 | CT |
| 0.855 | 0.423-2.042 | 0.929 | 0.934 | 0.456-2.058 | 0.969 | TT |
*تم التّعديل من أجل المستقبلات الهرمونيّة والعقد اللمفاويّة ونمط الجراحة
HR, hazard ratio; CI, confidence interval
المناقشة Discussion
يُعدّ CYP2D6*10 الأليل الأكثر انتشاراً لدى الشّرق آسيويّين بنسبة تصل إلى 43.5% وبتواتراتٍ منخفضةٍ نسبيّاً عند باقي الإثنيّات، وتُقدّر نسبة تواتره 6.7% في الشّرق الأوسط(PharmGKB. CYP2D6 Frequency Table,2021) . في دراستنا الحالية، حملت 25 مريضة الأليل المتغيّر T وبتواترٍ قدره 18.4% في جمهرة الدّراسة. ولكن، تجدر الإشارة إلى أنّ الاستبدال 100C>T لا يُستعمل في استعراف الأليل *10 فحسب، بل يدخل في استعراف 22 أليلاً آخر، أهمّها الأليل *4المُعرّف بالاستبدال 1847G>A، لذلك وبالاستفادة من نتائج التّنميط الجينيّ لدراستيّ اسماعيل الخليل وزملائها (Ismail Alkhalil et al., 2021) والصّالحي وزملائها (AL Salhi et al., 2021) السّابقتين، استطعنا تحديد تواتر النّمط الفردانيّ haplotype للأليل *10 لدى 97 مريضة من جمهرة الدّراسة ذاتها والذي بلغ 7.2%، وهو أعلى من التّواتر المسجّل في دراسة Fuselli وزملائها على جمهرة من السورييّن والذي قُدّر بـ2.94%(Fuselli et al., 2004) . يمكن أن يعزى هذا الاختلاف إلى الفروقات بين جمهرتي الدّراسة، فبينما اقتصرت دراسة Fuselli على 51 فرداً سوريّاً من الشّمال السّوري، شملت دراستنا 103 امرأة من مريضات سرطان ثدي من مختلف المحافظات السّوريّة. لوحظ أيضاً وجود اختلافٍ في تواتر الأليل *10 في جمهرة دراستنا مقارنة بالجمهرات المدروسة في دول الجوار مثل العراق (13.4%)(Swadi et al., 2019) والأردن (14.8%)(Zihlif et al., 2012) وفلسطين (2%)(Sistonen et al., 2007) والذي يمكن أن يعزى إلى كيفيّة تعيين الأليل *10، حيث اعتمدت دراستا العراق والأردن على تعيين الأليل *10 بناءً على الاستبدال 100C>T فقط دون استبعاد الأنماط الفردانيّة الأخرى التي تحمل هذا الاستبدال، الأمر الذي قد يُؤدّي إلى تقديراتٍ خاطئةٍ تميل إلى الزّيادة في تعيين تواتر الأليل 10*، ومن المُتوقّع أن يكون تواتر الأليل CYP2D6*10 لدى العراقيّين والأردنيّين قريباً منه لدى للسوريّين نظراً لصغر الجمهرة المدروسة (n=51) في فلسطين (Alali et al., 2022).
أدّى تطوّر مفهوم الطّب المشخصن personalized medicine إلى انبثاق العديد من البحوث الجينيّة الدّوائيّة التي تحرّت تعدّد الأشكال الجينيّة لإنزيمات الاستقلاب وعلاقتها بالاختلافات في التّراكيز البلازميّة للأدوية ومستقلباتها الفعّالة وبالتّالي التّفاوتات في فعاليّة العلاج بين الأفراد. على الرّغم من أنّ التّفعيل الحيويّ للتاموكسيفين وتحولّه إلى مستقلبه الفعّال “الإندوكسيفين” يعتمد بشكل كبير على فعاليّة إنزيم CYP2D6 وأنّ تغاير النّمط الجينيّ لـCYP2D6 يمكن أن يفسّر ما نسبته 39–58% من التّباينات في تراكيز الإندوكسيفين لدى الأفراد(Schroth et al., 2017) ، إلّا أنّ نتائج الدّراسات حول العلاقة بين فعاليّة التاموكسيفين والنّمط الجيني لـ CYP2D6 عموماً، وCYP2D6*10 على وجه الخصوص، لا تزال متضاربة. وبالتّالي لا يوجد حتى الآن دليلٌ قاطعٌ على ضرورة التّوصية بالتّنميط الجيني لـ CYP2D6 بوصفه عاملاً تنبؤيّاً بفعّاليّة التاموكسيفين. ففي حين يُؤكّد الاتّحاد التّنفيذيّ لعلم الجينات الدّوائي السّريريClinical Pharmacogenetics Implementation Consortium (CPIC) على أهمية التّنميط الجيني لـ CYP2D6 في تحديد الاستجابة للتاموكسيفين ويوصي بإجرائه (Goetz et al., 2018)، لم تصدر كلٌّ من الجمعيّة الأوروبيّة للأورام الطّبيّة (ESMO) European Society for Medical Oncology والـ FDA حتّى تاريخ كتابة هذه المقالة توصياتها بإجراء التّنميط الجينيّ قبل بدء العلاج بـالتاموكسيفين (, FDA,2022 Cardoso, F et al., 2019). أفضت دراستنا إلى نتيجة تدعم عدم وجود فارقٍ يُعتدّ به إحصائيّاً لدى مقارنة تواترات الأنماط الجينيّة المتغايرة بين مجموعتي المريضات المستجيبات والناكسات ولا في وسيط الـDFS بين المجموعتين، وبالتّالي لا تدعم نتائجنا وجود علاقة بين النّمط الجيني لـ100C>T واختطار حدوث نكس سرطان الثّدي لدى المريضات المعالجات بالتاموكسيفين توافقاً مع نتائج دراستي Okishiro وزملائه (Okishiro et al., 2009) وToyama وزملائه (Toyama et al., 2009) اللتين أظهرتا عدم وجود فارقٍ في المحصّلات العلاجيّة السّريريّة للتاموكسيفين واختطار حدوث نكس سرطان الثّدي عند المريضات اللواتي يحملن الأليلCYP2D6*10 ، بينما خالفت نتائجنا ما توصّلت إليه دراسة Lim وزملائه(Lim et al., 2014) وY Xu وزملائه (Xu et al., 2008) وKiyotani وزملائه (Kiyotani et al., 2008)، وجميعها دعمت تزايداً في اختطار حدوث نكس سرطان الثّدي وقصر البقيا الخالية من المرض لدى المريضات المعالجات بالتاموكسيفين ذوات النّمط الجيني CYP2D6*10/*10 مقارنةً مع المريضات اللواتي يمتلكن النّمط الجينيّ CYP2D6*1/*10 أو CYP2D6*1/*1.
بالرّغم من أنّ التّفعيل الحيويّ للتاموكسيفين وتحوّله إلى المستقلب الفعّال الإندوكسيفين يعتمد بشكلٍ كبيرٍ على فعاليّة إنزيم CYP2D6، إلّا أنّه ليس الإنزيم الوحيد المنخرط في استقلاب التاموكسيفين، إذ تسهم إنزيمات أخرى (مثل CYP2C9 وCYP2C19 وCYP3A4 وإنزيمات الطور الثاني وأهمها sulfotransferases (SULTs)و UDP-glucuronosyltransferases (UGTs)) في الاستحالة الحيويّة للتاموكسيفين، وعلى الرّغم من محدوديّة دورها في استقلاب التاموكسيفين، إلّا أنّها أيضاً تتّصف بتعدّداتها الشّكليّة ويمكن أن تسهم في تفسير التّباينات في تراكيز الإندوكسيفين والمحصّلات العلاجيّة بين الأفراد (Helland et al., 2021). أشارت بعض الدّراسات إلى أنّ تراكيز الإندوكسيفين كانت أعلى بـ 1.4 ضعفاً لدى حاملات الأليل CYP3A4*22 مقارنة بالنّمط الشّائع (Helland et al., 2021)، كما أنّ المريضات الحاملات للأليل فائق الفعاليّة CYP2C19*17 لديهنّ قدرة أكبر على تفعيل التاموكسيفين وتحويله إلى مستقلباته الفعّالة، علماً بأنّ هذا الأليل شائع الانتشار لدى الشّرق أوسطيين، حيث تُقدّر نسبة انتشاره بـ21.7% (Ionova et al., 2020)، وما يقارب الـ 17% لدى السّوريّين (نتائج قيد النشر لحاج صالح وزملائها، 2022). وبالتّالي، فإنّ وجود هذه الألائل لدى نسبةٍ من المريضات يمكن أن يقوم بمعاوضة العوز الوظيفي لإنزيم CYP2D6.
تتباين تراكيز الإندوكسيفين البلازميّة بشكل كبير بين المريضات حيث تتراوح بين أقل من 5 وصولاً إلى أكثر من 100 نانومولار، وفي ظل عدم وجود عتبةٍ محدّدةٍ لتراكيز الإندوكسفين التي يغدو عندها قادراً على مناهضة المستقبلات الإستروجينيّة، تقترح بعض الدّراسات الاسترجاعيّة الكبرى أنّ المريضات اللواتي تقلّ مستويات الإندوكسيفين البلازميّة لديهنّ عن 15 نانومولار قد لا يُحقّقن الفوائد السّريريّة المرجوّة من المعالجة بالتّاموكسيفين، وهذا أكثر ما يكون جليّاً عند المريضات ضعيفات الاستقلاب الحاملات لنسختين من أليل معدوم الفعاليّة (Wigle et al., 2017)، أمّا لدى المريضات متوسّطات الاستقلاب، وعلى الرّغم من انخفاض فعاليّة الإنزيم لديهنّ، إلا أنّه قد لا يزال قادراً على تحويل التاموكسيفين إلى الإندوكسيفين بالتّراكيز البلازميّة الفعّالة التي يستطيع بها حجب مستقبلات الإستروجين. تتّفق هذه الفرضيّة مع النتائج السّريرية التي توصّلت إليها نتائج دراستنا مجتمعةً مع نتائج دراستي اسماعيل الخليل وزملائها (Ismail Alkhalil et al., 2021) والصالحي وزملائها (AL Salhi et al., 2021)، والتي أظهرت بقيا خالية من المرض أقصر لدى المريضات ضعيفات الاستقلاب (قُدّرت بـ28.5 شهراً) مقارنة بالبقيا لدى متوسطات الاستقلاب (43.8 شهراً) وطبيعيّات الاستقلاب (38.25 شهراً) ولكن افتقر هذا الفارق لدلالةٍ يُعتدّ بها إحصائيّاُ (P= 0.278) والذي يمكن أن يُعزى لقلّة عدد المريضات ضعيفات الاستقلاب في جمهرة الدراسة (n=4) (Ismail Al-khalil et al., 2022). تتمثّل محدوديّة دراستنا بافتقادها إلى تحرّي تضاعف جين CYP2D6 والذي يمكن أن يؤثّر في تحديد النّمط الظّاهريّ، وعليه يمكن أن تتحوّل المريضة من نمط “متوسّطة الاستقلاب” إلى “طبيعيّة الاستقلاب” في حال تعدّد نسخ الجين لديها. كما أنّ دراسة متغيّر أليلي واحد والتّعيين الافتراضيّ للأليل الشّائع *1 ذي الوظيفة الطّبيعيّة دون تعيين الألائل الأخرى يمكن أن يؤدّي إلى تعيينٍ افتراضيٍّ للمريضة على أنّها طبيعيّة الاستقلاب في حين قد تكون المريضة حاملةً لأليلٍ آخر ناقص الفعّالية أو معدوم الفعاليّة، وبالتّالي تكون متوسّطة أو ضعيفة الاستقلاب. ولا بدّ من التّنويه إلى أنّ نتائج التّنميط الجينيّ للأليلين *4 و *41بيّنت أنّه من أصل 77 مريضة حاملة للنّمط الجينيّ الشّائع CYP2D6*1/*1 في دراستنا كانت 17 مريضة منهنّ (22.1%) حاملةً لأليلٍ متغايرٍ آخر. كما أنّ دراسة الاستبدال 100C>T لوحده غير كافٍ لتعيين النّمط الجينيّ والظّاهريّ بدقّة، خاصّة أنّه يترافق مع العديد من الألائل الأخرى وعلى وجه الخصوص الأليل *4، وقد تبيّن في دراستنا بأنّ من أصل المريضات الإثنتي عشرة اللواتي نُمِّطن على أنّهنّ متوسّطات الاستقلاب IM كانت ثلاثٌ منهنّ PM وذلك بعد تعيين الأليل *4.
الاستنتاجات Conclusions
أسهمت دراستنا في استعراف تواتر الأليل CYP2D6*10 والأنماط الجينيّة للاستبدال 100C>T لدى جمهرة من مريضات ثدي سوريّات، كما بينّت غياباً لتأثير الأليل 10* في نكس سرطان الثّدي أثناء المعالجة بالتاموكسيفين. أكّدت دراستنا على ضرورة استقصاء ألائل أخرى وتضاعفات الجين المرمّزة لـ CYP2D6* والتي قد تؤثّر في فعاليّة إنزيم CYP2D6 وذلك بهدف تعيين الأنماط الجينيّة والظّاهريّة بدقّة أكبر ومكاملة البيانات وتفسير التّباينات في فعاليّة التاموكسيفين.
المراجع :- Sung, H., Ferlay, J., Siegel, R. L., Laversanne, M., Soerjomataram, I., Jemal, A., & Bray, F. (2021). Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: a cancer journal for clinicians, 71(3), 209–249.
- Hwang, G. S., Bhat, R., Crutchley, R. D., & Trivedi, M. V. (2018). Impact of CYP2D6 polymorphisms on endoxifen concentrations and breast cancer outcomes. The pharmacogenomics journal, 18(2), 201–208.
- Goetz, M. P., Sangkuhl, K., Guchelaar, H. J., Schwab, M., Province, M., Whirl-Carrillo, M., Symmans, W. F., McLeod, H. L., Ratain, M. J., Zembutsu, H., Gaedigk, A., van Schaik, R. H., Ingle, J. N., Caudle, K. E., & Klein, T. E. (2018). Clinical Pharmacogenetics Implementation Consortium (CPIC) Guideline for CYP2D6 and Tamoxifen Therapy. Clinical pharmacology and therapeutics, 103(5), 770–777.
- Drögemöller, B. I., Wright, G., Shih, J., Monzon, J. G., Gelmon, K. A., Ross, C., Amstutz, U., Carleton, B. C., & CPNDS Clinical Recommendations Group (2019). CYP2D6 as a treatment decision aid for ER-positive non-metastatic breast cancer patients: a systematic review with accompanying clinical practice guidelines. Breast cancer research and treatment, 173(3), 521–532.
- Wigle, T. J., Jansen, L. E., Teft, W. A., & Kim, R. B. (2017). Pharmacogenomics Guided-Personalization of Warfarin and Tamoxifen. Journal of personalized medicine, 7(4), 20.
- Binkhorst, L., Mathijssen, R. H., Jager, A., & van Gelder, T. (2015). Individualization of tamoxifen therapy: much more than just CYP2D6 genotyping. Cancer treatment reviews, 41(3), 289–299.
- Ingelman-Sundberg M. (2005). Genetic polymorphisms of cytochrome P450 2D6 (CYP2D6): clinical consequences, evolutionary aspects and functional diversity. The pharmacogenomics journal, 5(1), 6–13.
- Gaedigk A. (2013). Complexities of CYP2D6 gene analysis and interpretation. International review of psychiatry (Abingdon, England), 25(5), 534–553.
- Gaedigk, A. (2022) Pharmacogene Variation Consortium (PharmVar). Available at: https://www.pharmvar.org/gene/CYP2D6 (Accessed: 3 August 2022).
- Xu, Y., Sun, Y., Yao, L., Shi, L., Wu, Y., Ouyang, T., Li, J., Wang, T., Fan, Z., Fan, T., Lin, B., He, L., Li, P., & Xie, Y. (2008). Association between CYP2D6 *10 genotype and survival of breast cancer patients receiving tamoxifen treatment. Annals of oncology : official journal of the European Society for Medical Oncology, 19(8), 1423–1429.
- CYP2D6 Frequency Table [Internet]. Gene-specific Information Tables for CYP2D6. [cited 2022 June 15]. Available from: https://www.pharmgkb.org/page/cyp2d6RefMaterials
- Alkhalil, W. I., Aljamali, M. and Yousef, L. (2021). The Frequency of Reduced Function Allele CYP2D6*41 and Its Impact on Recurrence in Syrian Breast Cancer Patients on Tamoxifen Therapy. The Journal of Damascus University- Health Sciences.
- AL Salhi, L., Sleiman, S., and Youssef, L. (2021). Frequency of Null-Function CYP2D6*4 Allele and Impact on Responsiveness to Tamoxifen in Syrian Breast Cancer Patients. The Arab Journal of Pharmaceutical Sciences, 6, pp. 83–93.
- Fuselli, S., Dupanloup, I., Frigato, E., Cruciani, F., Scozzari, R., Moral, P., Sistonen, J., Sajantila, A., & Barbujani, G. (2004). Molecular diversity at the CYP2D6 locus in the Mediterranean region. European journal of human genetics : EJHG, 12(11), 916–924.
- Swadi, A. A., Mohammad, B. I., Hadi, N. R., & Al-Aubaidy, H. A. (2019). Correlation of CYP2D6 allelic polymorphism to outcome of acute coronary syndrome in mid-Euphrates Iraqi patients on metoprolol therapy. Gene, 703, 112–119.
- Zihlif, M., Imraish, A., & Irshaid, Y. M. (2012). Frequency of certain single-nucleotide polymorphisms and duplication of CYP2D6 in the Jordanian population. Genetic testing and molecular biomarkers, 16(10), 1201–1205.
- Sistonen, J., Sajantila, A., Lao, O., Corander, J., Barbujani, G., & Fuselli, S. (2007). CYP2D6 worldwide genetic variation shows high frequency of altered activity variants and no continental structure. Pharmacogenetics and genomics, 17(2), 93–101.
- Alali, M., Ismail Al-Khalil, W., Rijjal, S., Al-Salhi, L., Saifo, M., & Youssef, L. A. (2022). Frequencies of CYP2D6 genetic polymorphisms in Arab populations. Human genomics, 16(1), 6.
- Schroth, W., Winter, S., Mürdter, T., Schaeffeler, E., Eccles, D., Eccles, B., Chowbay, B., Khor, C. C., Tfayli, A., Zgheib, N. K., Eichelbaum, M., Schwab, M., & Brauch, H. (2017). Improved Prediction of Endoxifen Metabolism by CYP2D6 Genotype in Breast Cancer Patients Treated with Tamoxifen. Frontiers in pharmacology, 8, 582.
- Cardoso, F., Kyriakides, S., Ohno, S., Penault-Llorca, F., Poortmans, P., Rubio, I. T., Zackrisson, S., Senkus, E., & ESMO Guidelines Committee. Electronic address: clinicalguidelines@esmo.org (2019). Early breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Annals of oncology : official journal of the European Society for Medical Oncology, 30(8), 1194–1220.
- Table of Pharmacogenetic Associations (2022). Available at: https://www.fda.gov/medical-devices/precision-medicine/table-pharmacogenetic-associations#section3 (Accessed: 28 July 2022)
- Okishiro, M., Taguchi, T., Jin Kim, S., Shimazu, K., Tamaki, Y., & Noguchi, S. (2009). Genetic polymorphisms of CYP2D6 10 and CYP2C19 2, 3 are not associated with prognosis, endometrial thickness, or bone mineral density in Japanese breast cancer patients treated with adjuvant tamoxifen. Cancer, 115(5), 952–961.
- Toyama, T., Yamashita, H., Sugiura, H., Kondo, N., Iwase, H., & Fujii, Y. (2009). No association between CYP2D6*10 genotype and survival of node-negative Japanese breast cancer patients receiving adjuvant tamoxifen treatment. Japanese journal of clinical oncology, 39(10), 651–656.
- Lim, H. S., Ju Lee, H., Seok Lee, K., Sook Lee, E., Jang, I. J., & Ro, J. (2007). Clinical implications of CYP2D6 genotypes predictive of tamoxifen pharmacokinetics in metastatic breast cancer. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 25(25), 3837–3845.
- Kiyotani, K., Mushiroda, T., Sasa, M., Bando, Y., Sumitomo, I., Hosono, N., Kubo, M., Nakamura, Y., & Zembutsu, H. (2008). Impact of CYP2D6*10 on recurrence-free survival in breast cancer patients receiving adjuvant tamoxifen therapy. Cancer science, 99(5), 995–999.
- Helland, T., Alsomairy, S., Lin, C., Søiland, H., Mellgren, G., & Hertz, D. L. (2021). Generating a Precision Endoxifen Prediction Algorithm to Advance Personalized Tamoxifen Treatment in Patients with Breast Cancer. Journal of personalized medicine, 11(3), 201.
- Ionova, Y., Ashenhurst, J., Zhan, J., Nhan, H., Kosinski, C., Tamraz, B., & Chubb, A. (2020). CYP2C19 Allele Frequencies in Over 2.2 Million Direct-to-Consumer Genetics Research Participants and the Potential Implication for Prescriptions in a Large Health System. Clinical and translational science, 13(6), 1298–1306.
- Ismail Al-Khalil W, Al-Salhi L, Rijjal S, Aljamali M, Youssef LA. (2022). The frequencies of CYP2D6 alleles and their impact on clinical outcomes of adjuvant tamoxifen therapy in Syrian breast cancer patients. BMC cancer, 22(1), 1067.