تحضير وتقييم في الزجاج لأقراص مُعدَّلة التحرّر من السيفوروكسيم أكسيتيل ومقارنتها مع الأقراص التقليدية
2023-07-01 | المجلد السابع العدد الثاني - المجلد السابع | مقالات بحثيةمحمود شحرور | محمد عثمان
الملخص
تبدي الأشكال الصيدلانية الفموية معدلة التحرر ومديدة التحرر أفضلية على الأشكال التقليدية فيما يتعلق بتحسين التوافر الحيوي وزيادة مطاوعة المريض وتقليل الآثار الجانبية، تم في هذا البحث تحضير أقراص مديدة التحرر لمادة سيفوروكسيم أكسيتيل باستخدام بلمرات محبة للماء بتراكيز مناسبة، وصٌممت هذه الأقراص بحيث تبقى محتبسة في المعدة وتتمتع بخاصيتي الطفو والالتصاق الحيوي، وذلك بإضافة مادة مولدة للغاز تؤمن طفو القرص في المعدة، واختيار بلمرات ذات خواص لصوقة حيوياً تؤمن التصاق القرص بالغشاء المخاطي للمعدة. تم العمل على بلمرات الكاربوبول 934p والشيتوزان مرتفع الوزن الجزيئي (HMW) وHPMC K4M وHPMC K15M بنسب مختلفة ومشاركة أفضل الصيغ مع الكاربوبول 934p، ودراسة سلوك تحرّر المادَّة الفعالة منها في الزجاج في وسط ذوبان يحاكي حموضة المعدة، ودراسة التآثر الفيزيائي بين المادَّة الفعالة والسواغات باستخدام المسح الطيفي بالأشعة تحت الحمراء والمسح الحراري التفاضلي. أظهرت نتائج الدراسة أنَّ الصيغة الحاوية على مشاركة بلمر HPMC K4M بتركيز 15% مع الكاربوبول 934p بتركيز 5% توافق متطلبات دستور الأدوية 38 USP للأشكال المديدة خلال 12 ساعة.
كلمات مفتاحية : سيفوروكسيم أكسيتيل، بلمرات محبة للماء، الأشكال مديدة التَّحرّر، الأشكال الطافية واللصوقة حيوياً، حرائك التَّحرّر.
المقدمة Introduction
تبدي الأشكال الصيدلانية الفموية التقليدية مساوئ عديدة، من بينها الحاجة إلى تكرار الجرعة وخصوصاً في الأدوية ذات نصف العمر الحيوي القصير، إضافةً إلى تأرجح التراكيز البلازمية والذي يسبب تأثيرات جانبية غير مرغوبة. في حين أنَّ الأشكال الصيدلانية معدَّلة التحرّر تؤمن توافراً حيوياً أفضل، وتكرار جرعات أقلّ، ما يحسّن من مطاوعة المريض، ويزيد كفاءة العلاج، ويقلّل التأثيرات الجانبية [1]. تعد الأشكال ذات التحرّر المديد (Extended release) من الأشكال معدلة التحرر، حيث يتحرّر الدَّواء منها ببطء مع المحافظة على التراكيز البلازمية ضمن الهامش العلاجي لفترة طويلة من الوقت، تتراوح عادةً بين 8-12 ساعة [2]. تتميز الأشكال الجرعية مديدة التحرّر عن الأشكال ذات التحرّر التقليدي بما يلي:
- تخفيض تواتر وشدَّة التَّأثيرات الجانبية الجهازية والموضعية.
- استخدام كميّة كُليَّة أقل من الدَّواء.
- يخفّض استخدام الأشكال مديدة التحرر تموج مستويات الدَّواء البلازمية، وخاصَّةً الأدوية ذات النافذة العلاجية الضيّقة.
- تحكّم أكبر بتركيز الدَّواء في الدم، وبالتالي تحسُّن الفعالية العلاجية للدواء.
- تحسين مطاوعة المريض من خلال تخفيض عدد الجرعات المأخوذة وإمكانية المحافظة على التَّأثير الدوائي أثناء فترات النوم ليلاً حيث لا يوجد إمكانية لأخذ الدَّواء.
- خفض متوسط كلفة معالجة الأمراض المزمنة مقارنة بالأشكال التقليدية.
- تحسين التوافر الحيوي لبعض الأدوية. [3,4]
يمكن الوصول للتحرر المديد للأدوية باستخدام نظم مختلفة:
- نظم القوالب المحبة للماء Hydrophilic matrix systems.
- نظم القوالب البلمرية غير المنحلة Insoluble Polymer Matrix.
- النظم الحلولية Osmotic Systems.
- النظم مضبوطة التحرّر بالغشاء Membrane-Controlled Systems.
- نظم الاحتباس المعدي (Gastroretention Systems).[5]
تم في هذا البحث اختيار نظم القوالب المحبة للماء والمحتبسة معدياً، لتحضير أقراص مديدة التحرر لمادة سيفوروكسيم أكسيتيل، وفيها يُمزج الدَّواء مع بَلْمَر محب للماء وقابل للانتباج بشكل مسحوق أو حثيرات، ويُحضَّر القرص في النهاية بالضغط المباشر أو بالتحثير الجاف (الضغط المضاعف). عند تعرّض القرص للسوائل يبدأ البَلْمَر بالانتباج ويشكِّل هلامة مائية، يتحرّر منها الدَّواء المحتجز بين سلاسل البَلْمَر ببطء، أو يتحرّر الدَّواء عن طريق تآكل الهلامة وتحرّر الدَّواء المحتجز ضمنها، [5] ولضمان احتباس الشَّكل الجرعي في المعدة تمَّ إضافة بيكربونات الصوديوم كمادة مولدة للغاز عند تماسها مع الوسط المعدي الحمضي تؤَمن الطفو ، كما أنَّ البلمرات التي تمَّ اختيارها تبدي خواصّ التصاق حيوي جيدة.[6,7] مادة السيفوروكسيم أكسيتيل المستخدمة في هذا البحث هي طليعة دواء للصاد الحيوي السيفوروكسيم، والذي ينتمي إلى الجيل الثاني من السيفالوسبورينات، وهو فعّال تجاه مجموعة واسعة من الجراثيم إيجابية وسلبية الغرام، ويستخدم في الإنتانات الناجمة عن جراثيم متحسّسة له. يُصنف السيفوروكسيم أكسيتيل في نظام التصنيف الصيدلاني الحيوي Biopharmaceutical Classification System (BCS) ضمن أدوية الصف الثاني [8]، أي أنَّه يملك ذوبانية منخفضة ونفاذية عالية. يتراوح توافره الحيوي بين 37-52% مع أو دون وجود طعام في المعدة [9]. ونصف عمره الحيوي قصير نسبيَّاً يتراوح بين 1.2-1.6 ساعة [9]. يزيد استخدام الأشكال التقليدية للسيفوروكسيم أكسيتيل من خطورة تشكّل مقاومة جرثومية [10]، وتسبب تأثيرات جانبية هضمية مثل ألم في البطن والإسهال [9]. نجح Bansal وزملاؤه بتحضير أقراص طافية ولصوقة حيوياً مديدة التَّحرّر لمدة 24 ساعة، باستخدام نسب مختلفة من Poly Ethylene Oxide 303 (PEO 303) مع HPMC K100M LV CR [11]. كما نجح Rao وزملاؤه بتحضير أقراص طافية في المعدة لمدة 12 ساعة، عند استخدام نسب مناسبة من كلٍّ من HPMC K4M و HPMC K15M، وبالاستعانة ببيكربونات الصوديوم كمادة مولدة للغاز [12]. أمَّا Manohar وزملاؤه فقد نجحوا بتحضير أقراص طافية ولصوقة معديا مديدة التَّحرّر لمدة 12 ساعة باستخدام نسب مناسبة من HPMC K4M و Carbopol 934p وبيكربونات الصوديوم [13]. تمَّ التركيز غفي هذا البحث على الشيتوزان، والذي يعد الشيتوزان chitosan الأكثر بحثاً في الوقت الحالي، وهو عديد سكريد موجب الشحنة، يتميز بتوافقه الحيوي وقابليته للتحلل البيولوجي وسميته المنخفضة. كما يمتلك مرونة سلاسل كافية للاختراق ويوفر توصيل الدَّواء عبر آلية اللصق المخاطي لتعزيز الامتصاص عن طريق الخلايا المجاورة، وهذا سبب أهميته الكبيرة. [14]
المواد والطرائق Materials and methods
المواد Materials:
سيفوروكسيم أكسيتيل (Cefuroxime Axetil) من شركة (Covelant, India)، الكاربوبول p934(Carbopol 934p) من شركة (Lubrizol – India)، هيدروكسي بروبيل ميثيل سيللوز (HPMC K4M-K15M) من شركة (Lubrizol – India)، الشيتوزان (Chitosan) من شركة (Sigma, Germany) ، بيكربونات الصوديوم (NaHCO3) من شركة (Nitrika, India)، اللاكتوز المجفف بالإرذاذ (Spray-Dried Lactose) من شركة (Chempifine, India)، شمعات المغنيزيوم (Magnesium Stearate) من شركة (Nitrika, India)، ثاني أكسيد السيليكون الغرواني (Aerosil) من شركة (Chempifine, India).
الأجهزة Equipments:
مقياس الطيف الضوئيّ UV (UPS EAST 1500 VA, T80, UV Spectrophotometer)، سرعة الذوبان (Pharmatest)، آلة ضغط مخبرية وحيدة المكبس (ERWEKA AR 402, Type EK0, Germany)، ميزان حساس (Sartorius GP 2102,Germany)، ميزان حساس تحليلي (Sartorius weighing – Goettingen, Germany)، مناخل دستوريّة (CISA- Sieve Shaker RP -09, Spain)، قياس درجة حموضة الوسط (HANNA pH211- Microprocessor pH Meter)، الأمواج فوق الصوتيّة Digital ultrasonic cleaner PHYLO، lمقياس القساوة والقطر والسماكة ERWEKA TBH 300S، مقياس الهشاشة ERWEKA TAR 20، تقطير الماء Automatic water still DESA 0041 SHIN- SAENG.
الطرائق Methods:
- تحضير مختلف الصيغ المقترحة لأقراص السيفوروكسيم أكسيتيل:
حُضَّرت الأقراص الحاوية على السيفوروكسيم أكسيتيل (125مغ) بالضغط المباشر، استعملت في الصيغ الأربعة عشر المُحضَّرَة بيكربونات الصوديوم بتركيز 10% كعامل مولد للغاز، وشمعات المغنيزيوم بتركيز 2% كعامل مزلق، والأيروزيل بتركيز 0.5% كمحسن للانسياب، واللاكتوز المجفف بالإرذاذ كمية كافية حتى )300مغ) كعامل ممدد، بالإضافة إلى البلمرات المحبة للماء الموضحة في الجدول 1 والمستخدمة كعوامل رابطة ومشكلة للقالب، حُضرت الصيغ السابقة وفق الترتيب الآتي:
- نُخلت المكونات جميعها ما عدا الأيروزيل وشمعات المغنيزيوم على منخل رقم 60mesh قياس فتحاته 250 مكم.
- وُزن كل مسحوق على حدة باستخدام ميزان حساس.
- مُزجت كل من السيفوروكسيم أكسيتيل مع البلمرات المستخدمة وبيكربونات الصوديوم واللاكتوز المجفف بالإرذاذ.
- أُضيف الأيروزيل وشمعات المغنيزيوم مع المزج لمدة دقيقتين.
- ضُغط المزيج الناتج بآلة ضغط مخبرية ذات قطر مكبس 10 ملم.
- تحضير المحلول العياريّ والمسح الطيفي للسيفوروكسيم اكستيل:
أُجري مسح المادة الفعالة بواسطة مقياس الطيف الضوئيّ بالأشعة فوق البنفسجيّة ضمن مجال 190-400 نانومتر لتحديد طول موجة الامتصاص الأعظمي λmax. كما أُجري مسح طيفي لشاهد يحوي السواغات المستخدمة للتأكد من عدم وجود تداخل بين السيفوروكسيم أكسيتيل والسواغات المستخدمة قد يؤثر على الامتصاص. حُضَّرت سلسلة عيارية من محلول المادة الفعالة باستعمال وسط انحلال حمض كلور الماء ذي التركيز 0.07 N وذي 1.15 pH= على النحو الآتي: حُضَّر محلول أول للسيفوروكسيم أكسيتيل بتركيز 1000 مكغ/مل وذلك بإذابة 100 مغ في 100 مل من حمض كلور الماء (pH=1.15)، عُرَّض المحلول للأمواج فوق الصوتية لإتمام عملية الانحلال، ثم أُخذ من المحلول السابق 3 مل ومُدّدت في بالون معايرة 100 مل حتى خط العيار مع المزج, للحصول على محلول تركيزه يساوي 30 مكغ/مل، سُحب بعد ذلك باستخدام ممص معايَر أحجام مناسبة 1، 2، 3، 4، 5، 6، 7، 8 مل من المحلول السابق ومُدّد كلّ منها في بالون معايرة سعة 10 مل بوسط الانحلال المدروس لتحضير محاليل بتراكيز تبدأ من 3 مكغ/مل حتى 24 مكغ/مل، قيست هذه المحاليل باستخدام مقياس الطيف الضوئي عند طول موجة الامتصاص الأعظمي البالغة 280 nm، تم تكرار التجربة 3 مرات وأُخذَت قيم الوسطي وحُسَبَ الانحراف المعياري [15,16].
| الجدول (1): الصيغ المُحضَّرة من سيفوروكسيم أكسيتيل | ||||||
| HPMC K15M (%) mg | HPMC K4M
(%) mg |
Chitosan (%) mg |
Carbopol 934p
(%) mg |
Cefuroxime Axetil) mg) |
المادة
(مغ) الصيغ |
|
| (%5) 15 | 125 | F1 | ||||
| (%10) 30 | 125 | F2 | ||||
| (%15) 45 | 125 | F3 | ||||
| (%20) 60 | 125 | F4 | ||||
| (%10) 30 | 125 | F5 | ||||
| (%15) 45 | 125 | F6 | ||||
| (%10) 30 | 125 | F7 | ||||
| (%15) 45 | 125 | F8 | ||||
| (%20) 60 | (%5) 15 | 125 | F9 | |||
| (%20) 60 | (%10) 30 | 125 | F10 | |||
| (%15) 45 | (%5) 15 | 125 | F11 | |||
| (%15) 45 | (%10) 30 | 125 | F12 | |||
| (%10) 30 | (%5) 15 | 125 | F13 | |||
| (%10) 30 | (%10) 30 | 125 | F14 | |||
- الفحوص المطبقة على الأقراص بعد الضغط:
- اختبار اختلاف الوزن Weight Variation Test:
أجري هذا الفحص وفق دستور الأدوية البريطاني حيث تم انتقاء 20 قرص بشكل عشوائي من كل صيغة، وزنت الأقراص إفرادياً باستخدام ميزان حساس بدقة تعادل 0.01 غ ثم حسب المتوسط Average والانحراف النسبي المئوي Percentage Deviation. يصنف دستور الأدوية البريطاني 2020، الانحراف النسبي المئوي المسموح للاختلاف كما هو موضح في الجدول (2): [17]
| الجدول (2): قيم الانحراف النسبي المئوي المسموحة حسبBP 2020 | |
| الوزن الوسطيّ (ملغ)
Average Mass |
الانحراف النسبي المئوي المسموح
Percentage Deviation |
| 80 مغ أو أقل | 10% |
| أكبر من 80 مغ وأصغر من 250 مغ | 7.5% |
| أكبر أو يساوي 250 | 5% |
- اختبار القساوة والقطر والسماكة Hardness, Diameter and Thickness Test:
أُجري قياس القساوة والقطر والسماكة لعينات مؤلفة من 6 أقراص من كل صيغة من الصيغ المُحَضَّرَة باستخدام مقياس القساوة والقطر والسماكة ERWEKA TBH 300S. [18]
- اختبار الهشاشة Friability Test:
أُجري قياس النسبة المئوية لهشاشة الأقراص المُحَضَّرَة باستخدام مقياس الهشاشة ERWEKA TAR 20 حيث تم الاختبار بوزن 20 قرص ثم وضعها داخل الجهاز. شُغِّل الجهاز بسرعة 25 دورة بالدقيقة لمدة 4 دقائق، بعدها أُخذت الأقراص وأُزيل عنها الغبار ووزنت من جديد، تُحسب قيمة الهشاشية من العلاقة:
= (Wb-Wa) / Wb x 100الهشاشية %
حيث: Wb وزن الأقراص قبل الاختبار، Wa وزن الأقراص بعد الاختبار
وتكون النتيجة مقبولة دستورياً ما لم تتجاوز قيمة الهشاشية 1%.[19]
3-3- معايرة المحتوى من المادة الفعالة Drug Content:
أُجريت معايرة المادة الفعالة في مختلف الصيغ المُحَضَّرَة، حيث أُخذت 10 أقراص من كلّ صيغة وسُحقت، ثم أُخذت عينة مكافئة لِـ 125 ملغ ووضعت في بالون معايرة سعة 100 مل وتم الحل بمحلول حمض كلور الماء 0.07 نظامي بالاستعانة بالأمواج فوق الصَّوتيّة وأُكمل الحجم حتى خط العيار لنحصل على محلول تركيزه 1250 مكغ\مل، بعدها رُشَّحَ المحلول الناتج بمراشح 0.45 ميكرون وأُخذ من الرشاحة 1 مل ونُقلت إلى بالون معايرة سعة 100 مل، وأكمل الحجم حتى 100 مل بوسط الانحلال لنحصل على محلول تركيزه 12.5 مكغ\مل، تمت معايرة المادة الفعالة في المحلول النهائي من خلال أخذ عينة وقياس امتصاصها بمقياس الطيف الضوئي عند طول موجة (280 نانومتر) مقابل عياري بتركيز 12.5 مكغ\مل، وطُبِّق القانون:
معايرة المادة الفعالة = امتصاص المجهول / امتصاص العياري × 100 [20]
يجب أن تحتوي أقراص السيفوروكسيم أكسيتيل ما لا يقل عن 90%، وما لا يزيد عن 110% من الكمية المعنونة [21].
4- فحص الذوبان Dissolution Test:
أُجري الفحص على 6 أقراص من كلّ صيغة في جهاز فحص الذوبان حسب طريقة 38 USP وفق الشروط الآتية:
الجهاز: الثاني (المجداف)
الوسط: 900 مل من محلول حمض كلور الماء(0.07 N) و (pH=1.15)، [21]
سرعة الدوران: 50 دورة في الدقيقة.
درجة الحرارة: 37 درجة مئوية ± 0.5
زمن الاعتيان: 0.5، 1، 2، 3، 4، 5، 6، 8، 10، 12 ساعة.
الإجراء: سُحبت عينات حجم كلّ منها 1 مل عند الأزمنة السابقة وعُوّض وسط الذوبان بنفس الحجم من الوسط النقي، مُدّدت العينة في بالون معايرة سعته 10 مل، ثمَّ رُشحّت العينات المسحوبة بمراشح ميكرونية 0.45 مكم، قيس بعد ذلك الامتصاص لكل عينة بمقياس الطيف الضوئي عند طول موجة (280 نانومتر)، حُسبت تراكيز السيفوروكسيم أكسيتيل في وسط الذوبان باستخدام معادلة السلسلة العيارية . حُسبت النسبة المئوية لكمية الدواء المتحررة Q% كما يلي:
Q%= (C V dr 100)/Dose
Q%= (C 900 10 100)/125,000
Q%= 7.2 C
C: تركيز السيفوروكسيم أكسيتيل في وسط الذوبان.
dr: نسبة التمديد، وتساوي 10.
V: حجم وسط الذوبان، ويساوي 900 مل.
Dose: كمية السيفوروكسيم أكسيتيل في القرص المُحضَّر (مكغ). [11,12]
5- توافق نسب تحرّر الدواء من الصيغ مع الحدود الدستورية:
تمَّ التأكد من موافقة تحرّر سيفوروكسيم أكسيتيل من مختلف الصيغ المُحَضَّرَة للشروط الدستورية التي نص عليها USP38 – NF 33 للصيغ مديدة التحرّر، وحُدَّدت ثلاث نقاط كما في الجدول 3: [22,23]
- دراسة نماذج حركيّة تحرّر الدَّواء في الزجاج:
تمَّ حساب المتثابتات الخاصَّة بكلّ نموذج من نماذج الحركيّة المدروسة لكلِّ صيغة من الصيغ الخمس واختيار النموذج الأمثل الذي يعبر عن حركيّة تحرّر سيفوروكسيم أكسيتيل من الصيغة، بحيث يملك قيمة معامل الارتباط R² الأعلى. دُرست النماذج الرياضية الآتية لحركيّة التحرّر:
- الرّتبة صفر Zero order: Qt= K*t
- الرّتبة الأولى First order: Log Qt= Log Q0 –Kt/ 2.303
- هيغوتشي Higuchi: Qt = KHt1/2
- هيكسون-كرول Hixson-crowell: Q01/3 – Qt1/3 = KHC.
- كورسماير-بيباس Korsmeyer-Peppas: F = (Mt /M) = Kmtn
تستخرج قيمة (n) من الخط البياني لـ log [(Mt/M)] مقابل (log t). وتدل قيمة (n) على نمط التحرّر. فمن أجل الشّكل الاسطواني:
- إذا كانت قيمة (n) تساوي 0.45 أو أقلّ كان التحرّر وفق قانون فيك الأول (Fickian diffusion)، أي أنَّ آلية الانتشار هي العملية التي تضبط تحرّر الأدوية من نظام البلمر المستخدم.
- وإذا كانت قيمة (n) تتراوح ما بين 0.45 < n < 0.89: كان الانتشار شاذّ أو لا يتبع قانون فيك. ويكون التحرّر من الدرجة الأولى، أي أنَّ تحرّر الدَّواء يعتمد وبشكلٍ مُستمرّ على ظاهرة الانتشار عبر البلمر والانتباج والتآكل للبلمر المستخدم.
• وإذا كانت قيمة (n) أكبر أو تساوي 0.89 يكون التحرّر وفق قانون فيك الثاني، أي أنَّ تحرّر الدَّواء يكون مضبوطاً بظاهرة انتباج البلمر المستخدم فقط [24].
| الجدول (3): متطلبات دستور الأدوية الأمريكي USP38 – NF 33 للأشكال المديدة. | |
| المدة الزَّمنية | النسبة المئوية المتحرّرة من المادة الدَّوائيَّة |
| ربع المدة الزَّمنية (3 ساعات) | ضمن مجال 15-35% |
| نصف المدة الزَّمنية (6 ساعات) | ضمن مجال 40-60% |
| نهاية المدة الزَّمنية (12 ساعة) | أكبر من 85% |
3- دراسة التآثرات بين المادَّة الفعَّالة والسّواغات:
7-1- انعراج الأشعة السينية X-Ray diffraction:
تم تحليل سيفوروكسيم أكسيتيل باستخدام جهاز STOE Transmition Diffractometer System STADI P، المزود بـ [CuKα] كمصدر لأشعة X ذات طول موجة λ= 1.54 nm وموحد طول موجة من الجرمانيوم. كان نمط المسح2θ: ω، وتراوحت قيمة الزاوية 2θ بين 2-90°، بمُعدَّل مسح 0.5º 2θ/min، وذلك لمعرفة إذا كانت بنية سيفوروكسيم أكسيتيل بلورية crystalline أو لا بلورية amorphous.
7-2- المسح الطيفي بالأشعة تحت الحمراء FTIR Spectroscopy:
أجري المسح الطيفي بالأشعة تحت الحمراء باستخدام جهاز BRUKER ALPHA FT-IR spectrum ضمن مجال الأعداد الموجية wave number 4000 – 400 سم-1، بهدف تحري وجود تآثرات فيزيائية بين المادة الفعالة والسواغات المستخدمة بنسب 1:1.
7-3- المسح الحراري التفاضلي Differential Scanning Calorimetry (DSC):
أجري المسح الحراري التفاضلي بواسطة جهاز SETARAM DSC 131 ضمن مجال درجات حرارة متزايدة من 25 – 450º م، بمُعدَّل 10 درجات مئوية/دقيقة، وتحت تدفق غاز الأزوت N2 بمُعدَّل 100 مل/دقيقة، باستخدام بوتقة ألمنيوم بسعة 30 ميكرو ليتر. وذلك بوزن عينات 5 مغ بهدف تحري وجود تنافرات فيزيائية بين المادة الفعالة والسواغات المستخدمة بنسبة 1:1.
4- مقارنة الأقراص التجارية فورية التحرر مع أفضل صيغة تحرّر مديد:
تمَّ إجراء فحص الذوبان على 6 أقراص تجارية محليّة فورية التَّحرّر للسيفوروكسيم أكسيتيل ( 250 مغ) بنفس شروط فحص الذوبان للأشكال المديدة لمدة ساعة واحدة، ومقارنة النتائج مع نتائج التَّحرّر لأفضل صيغة تحرّر مديد.
النتائج والمناقشة Results and Discussion
- نتائج المسح الطيفي بالأشعة فوق البنفسجية وتحديد طول موجة الامتصاص الأعظمي:
لوحظَ عند إجراء المسح للسيفوروكسيم أكسيتيل في وسط حمض كلور الماء (0.07 N ) وجود قمة امتصاص أعظمي نوعية للدواء عند طول موجة (280 نانومتر).
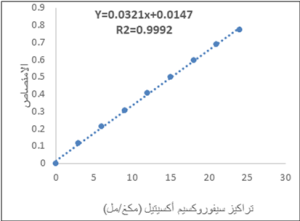
يظهر الشكل 1 نتائج التحقق من خطية الطريقة، حيث كان معامل الارتباط R2=0.9992، أي أنَّ طريقة المقايسة خطيَّة.
- نتائج الفحوص المطبقة على الأقراص بعد الضغط:
يظهر الجدول (4) نتائج الفحوص المطبقة على الأقراص بعد الضغط، والتي كانت جميعها ضمن الحدود المقبولة.
- نتائج فحصوص مُعدلات الذوبان :
دُرس منحني الذوبان للصيغ المختبرة خلال 12 ساعة في محلول حمض كلور الماء (0.07 N ) وذي (pH=1.15)، يبين الشكل 2 و3 نتائج هذا الاختبار عند كل النقط الزمنية، والتمثيل البياني لهذه النتائج.
أظهرت الصيغتان F1 وF2 المتضمنتان بلمر الكاربوبول 934p بتركيز 5% و10% على التوالي أبطأ معدلات تحرّر للسيفوروكسيم أكسيتيل، حيث لم يتحرَّر خلال 12 ساعة سوى حوالي 53% و35% على التوالي من المادَّة الفعالة، ويعزى ذلك إلى إنَّ بلمر الكاربوبول 934p هو بلمر متصالب ذو طبيعة حمضية (pKa=6) بسبب وجود المجموعات الكربوكسيلية في بنيته [25]، لذلك فهو لا يتأيّن في وسط التَّحرّر الحمضي (pH= 1.15)، وهذا يقلل من إماهة وانتباج البلمر، ويصعّب تحرّر جزيئات الدواء المحتجزة بين سلاسله المتصالبة، وتتفق هذه النتيجة مع دراسة Suma وزملائه [26].
| الجدول (4): نتائج الفحوص المطبقة على الأقراص بعد الضغط | |||||||
| الصيغ | الهشاشة% | السماكة (ملم) SD± |
القساوة (كغ/سم2) SD± |
القطر (ملم) SD± |
الوزن الوسطيّ (ملغ) SD± | معايرة المحتوى% SD± |
|
| F1 | 0.31 | 3.7±0.027 | 7.32±0.47 | 11.5±0.017 | 294.2±3.12 | 96.4±1.58 | |
| F2 | 0.26 | 3.72±0.033 | 7.56±0.59 | 11.49±0.022 | 296.7±3.81 | 98.3±1.15 | |
| F3 | 0.23 | 3.73±0.019 | 7.63±0.46 | 11.48±0.022 | 307.5±2.63 | 97.7±2.10 | |
| F4 | 0.34 | 3.75±0.024 | 7.76±0.016 | 11.47±0.019 | 302.9±3.54 | 99.3±1.67 | |
| F5 | 0.52 | 3.74±0.028 | 6.52±0.68 | 11.47±0.015 | 297.7±3.70 | 101.2±1.77 | |
| F6 | 0.42 | 3.75±0.029 | 6.86±0.42 | 11.47±0.018 | 296.4±2.42 | 98.4±2.03 | |
| F7 | 0.47 | 3.68±0.033 | 6.47±0.51 | 11.51±0.017 | 298.6±3.98 | 97.1±1.81 | |
| F8 | 0.36 | 3.69±0.027 | 7.72±0.4 | 11.52±0.021 | 304.1±3.12 | 102.3±1.31 | |
| F9 | 0.23 | 3.77±0.025 | 7.81±0.38 | 11.5±0.019 | 297.3±2.54 | 102.8±2.29 | |
| F10 | 0.11 | 3.78±0.018 | 7.98±0.32 | 11.48±0.018 | 303.5±2.43 | 101.7±1.91 | |
| F11 | 0.34 | 3.8±0.041 | 7.33±0.71 | 11.47±0.017 | 298.1 ±2.63 | 95.5±1.63 | |
| F12 | 0.23 | 3.82±0.037 | 7.53±0.34 | 11.46±0.017 | 297.8±3.91 | 97.4±2.32 | |
| F13 | 0.33 | 3.73±0.027 | 7.40±0.19 | 11.49±0.024 | 298.7±3.68 | 102.6±1.87 | |
| F14 | 0.25 | 3.74±0.016 | 7.27±0.51 | 11.48±0.017 | 302.4±2.12 | 98.6±2.37 | |
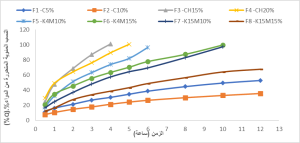
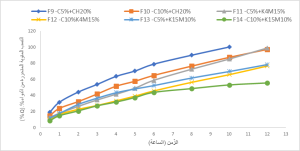
كما أظهرت الصيغتان F3 وF4 المتضمنتان على بلمر الشيتوزان بتراكيز 15% و20% على التوالي أسرع معدلات تحرر حيث تحرّر 100% من المادَّة الفعالة خلال 4 ساعات و5 ساعات على التوالي. يُعزَى ذلك إلى احتواء بلمر الشيتوزان في بنيته على مجموعات أمينية تتأين في وسط التَّحرّر الحمضي ليكتسب شحنة موجبة [27]، يزيد هذا التأيّن انحلالية البلمر في الماء ويدفع سلاسل البلمر للتنافر بعيداً عن بعضها، ممَّا يزيد من تميّه وانتباج البلمر ويسرّع تحرّر المادَّة الفعالة، وهذا يتفق مع دراسة Souza وزملائه [28]. يعتمد تحرّر السيفوروكسيم أكسيتيل في الصيغ F5-F8 المتضمنة على بلمر HPMC بنوعيه على لزوجة البلمر وتركيزه، حيث أنَّ زيادة التركيز واللزوجة أدَى إلى إبطاء معدل التَّحرّر، وهذا يتفق مع دراسة Rao وزملائه [12]. إنَّ مشاركة بلمر الكاربوبول 934p مع البلمرات السابقة غيَّر مرتسمات تحرّر السيفوروكسيم أكسيتيل مقارنةً بمرتسمات تحرّر الصيغ المتضمنة على البلمرات بشكل مفرد، وأدَّى إلى إبطاء معدلات التَّحرّر. من بين الصيغ المدروسة حرَّرت الصيغتان F10,F11 حوالي 100% من الجرعة المستخدمة خلال زمن التَّحرّر الكلّي 12 ساعة، ويعزى ذلك إلى ازدياد انتباج الشَّكل الجرعي ولزوجته في وسط الذوبان، ووجود الروابط المتصالبة بين سلاسل بلمر الكاربوبول 934p والذي ساهم في ضبط التَّحرّر. يبين الشكل (4) قرص الصيغة F10 المتضمنة على الشيتوزان بتركيز 5% وكاربوبول 934p بتركيز 10% على اليمين بعد انتهاء فحص الذوبان، وعلى اليسار قرص الصيغة F11 الحاوية على بلمر HPMC K4M بتركيز 15% والكاربوبول 934p بتركيز 5%.

1-نتائج توفق نسب تحرّر الدواء من الصيغ مع الحدود الدستورية:
حققت الصيغة F11 (HPMC K4M بتركيز 15% والكاربوبول 934p بتركيز 5% ) متطلبات USP38–NF 33 للأشكال المديدة خلال 12 ساعة عند النقاط الزمنية الثلاث المحددة، يبين الجدول (5) نسب التحرّر عند النقاط الزمنية المحددة دستورياً، وفيما إذا حقَّقت نسب التحرّر المتطلبات الدستورية.
- دراسات تحرّر الدَّواء في الزجاج:
بعد دراسة تحرّر الدَّواء من مختلف الصيغ المحضرة، دُرست أنماط التحرّر بواسطة برنامج Microsoft Excel 2007، وحُسبت قيم R2 لأنماط التحرّر الآتية: Zero-order، First-order، Higuchi، Hixson-Crowell، Korsmeyer- Peppas لمعرفة النموذج الذي يتوافق مع نمط تحرّر سيفوروكسيم أكسيتيل من كلّ صيغة. يبين الجدول (6) نتائج تحرر الدواء من كل صيغة من الصيغ ، ونموذج التحرر الموافق.
| الجدول (5): النسب المئوية المتحرّرة عند النقاط الزمنية المحددة دستورياً | |||||
| الصيغة | زمن التحرّر المطلوب (ساعة) |
(3 ساعات) | (6 ساعات) | (12 ساعة) | التوافق مع الدستور |
| F1 | 12 | 26.9% | 38.7% | 52.8% | غير موافقة عند الساعة 6 |
| F2 | 12 | 17.8% | 26.7% | 35.7% | غير موافقة عند الساعة 6 |
| F3 | 12 | 87.2% | – | – | غير موافقة عند الساعة 3 |
| F4 | 12 | 76.2% | – | – | غير موافقة عند الساعة 3 |
| F5 | 12 | 63.3% | 96.5% | – | غير موافقة عند الساعة 3 |
| F6 | 12 | 55.7% | 77.8% | – | غير موافقة عند الساعة 3 |
| F7 | 12 | 48.2% | 69.5% | – | غير موافقة عند الساعة 3 |
| F8 | 12 | 33.8% | 48.6% | 67.4% | غير موافقة عند الساعة 12 |
| F9 | 12 | 53.7% | 78.9% | – | غير موافقة عند الساعة 3 |
| F10 | 12 | 41.6% | 64.8% | 97.2% | غير موافقة عند الساعة 3 |
| F11 | 12 | 34.2% | 58.7% | 98.9% | موافقة |
| F12 | 12 | 27.5% | 45.6% | 78.3% | غير موافقة عند الساعة 12 |
| F13 | 12 | 36.6% | 52.3% | 78.1% | غير موافقة عند الساعة 3 |
| F14 | 12 | 26.8% | 43.6% | 55.4% | غير موافقة عند الساعة 12 |
| الجدول (6): نتائج تحرر السيفوروكسيم أكسيتيل من الصيغ المحضرة، ونماذج التحرر الموافقة | ||||||
| الصيغ | Korsmeyer-Peppas | Hixon-Crowell | Higuchi | First-Order | Zero-Order | |
| n | R² | R² | R² | R² | R² | |
| F1 | 0.499 | 0.998 | 0.895 | 0.998 | 0.986 | 0.958 |
| F2 | 0.4994 | 0.998 | 0.875 | 0.997 | 0.968 | 0.948 |
| F3 | 0.667 | 0.98 | 0.898 | 0.994 | 0.886 | 0.963 |
| F4 | 0.504 | 0.986 | 0.919 | 0.992 | 0.848 | 0.966 |
| F5 | 0.657 | 0.992 | 0.969 | 0.996 | 0.866 | 0.975 |
| F6 | 0.502 | 0.991 | 0.87 | 0.996 | 0.753 | 0.954 |
| F7 | 0.59 | 0.999 | 0.899 | 0.997 | 0.861 | 0.975 |
| F8 | 0.554 | 0.996 | 0.869 | 0.997 | 0.993 | 0.954 |
| F9 | 0.541 | 0.995 | 0.874 | 0.998 | 0.868 | 0.957 |
| F10 | 0.591 | 0.997 | 0.899 | 0.997 | 0.897 | 0.977 |
| F11 | 0.665 | 0.991 | 0.945 | 0.977 | 0.777 | 0.997 |
| F12 | 0.616 | 0.99 | 0.949 | 0.978 | 0.977 | 0.996 |
| F13 | 0.596 | 0.996 | 0.868 | 0.998 | 0.993 | 0.962 |
| F14 | 0.604 | 0.991 | 0.842 | 0.989 | 0.968 | 0.931 |
نلاحظ من الجدول (6) أنَّ الصيغ F1 وF2 وF7 وF14 قد توافقت أنماط تحرر الدواء منها مع Korsmeyer Peppas حَيث كانت قيم R2 هي الأعلى مقارنةً بالأنماط الأخرى، وكانت قيم معامل التَّحرّر الأسي (n) في الصيغتين F1 وF2 على التوالي 0.499 و 0.4994، في حين كانت قيم n تساوي 0.59 و0.604 في الصيغتين F7 وF14 على التوالي، وهذه القيم بين 0.45 و0.89، وهذا يدلّ على أنَّ الانتشار شاذّ ولا يتبع قانون فيك الأول في الانتشار، وتحرَّر الدواء يعتمد على ظاهرتي انتشار الدواء وانتباج البلمر المستخدم.
إنَّ الصيغ F3 وF4 وF5 وF6 وF8 وF9 وF10 وF13 قد أعطت تحرّر من نمط Higuchi حيث كانت قيم R2 هي الأعلى، أي أنَّ تحرّر الدواء من القالب يتناسب مع الجذر التربيعي للزمن، كما يشير إلى أنَّ الانتشار هي الآلية الأساسية للتحرر. إنَّ الصيغ F11 وF12 توافقت مع تحرّر من نمط Zero Order وهي الرّتبة المنشودة للأشكال المديدة، حيث كانت قيم R2 هي الأعلى مقارنةً بالأنماط الأخرى. إنَّ التحرّر من الرتبة Zero Order يشير إلى أنَّ سرعة تحرّر الدواء من القالب ثابتة خلال الزمن.
5-1 نتائج انعراج الأشعة السينية X-Ray diffraction:
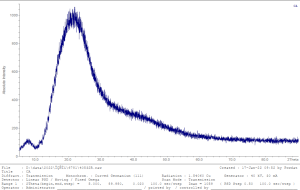
يظهر الشكل 5 مخطط انعراج الأشعة السينية لمادة سيفوروكسيم أكسيتيل أنَّها عديمة الشكل البلوري مع وجود آثار بنية بلورية [29,30].
-2- نتائج المسح الطيفي بالأشعة تحت الحمراء FTIR Spectroscopy:
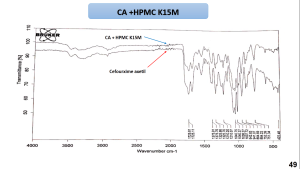
يظهر مخطط المسح الطيفي بالأشعة تحت الحمراء للسيفوروكسيم اكسيتيل أهم امتطاطات المجموعات الوظيفية المميزة للمادة كما هو موضح بالشكل (6) والجدول (7) [31].
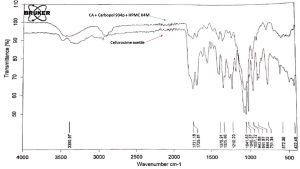
يظهر مخطط المسح الطيفي بالأشعة تحت الحمراء للمزائج الفيزيائية للسيفوروكسيم أكسيتيل مع الشيتوزان و HPMCK4M و HPMCK15 أن القمم الوصفية للمزائج كانت مشابهة لتلك القمم العائدة للسيفوروكسيم أكسيتيل النقي مما قد يشير إلى محدودية التآثرات بين المادة الدوائية والبلمرات السابقة. يظهر مخطط المسح الطيفي بالأشعة تحت الحمراء للمزيج الفيزيائي السيفوروكسيم أكسيتيل و الكاربوبول 934P اختفاء بعض امتطاطات القمم الوصفية للسيفوروكسيم أكسيتيل مما قد يشير الى وجود تآثر بين المادتين. يظهر مخطط المسح الطيفي بالأشعة تحت الحمراء للمزيج الفيزيائي للسيفوروكسيم أكسيتيل مع الكاربوبول 934p وHPMCK4M أنَّ القمم الوصفية للمزيج كانت مشابهة لتلك القمم العائدة للسيفوروكسيم أكسيتيل النقي مما قد يشير إلى محدودية التآثرات بين المادة الدوائية والبلمرات السابقة.
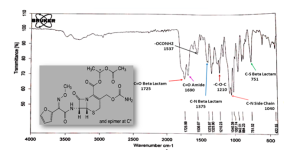
| الجدول (7): القمم الوصفية لمادة سيفوروكسيم أكسيتيل بالأشعة تحت الحمراء. | |
| المجموعة الوظيفية | العدد الموجي (cm-1) |
| C=O Beta Lactam | 1725 |
| C=O Amide | 1690 |
| -OCONH2 Carbamate | 1537 |
| C-N Beta Lactam | 1375 |
| -C-O-C Ether | 1210 |
| C-N Side Chain | 1040 |
| C-S Beta Lactam | 751 |
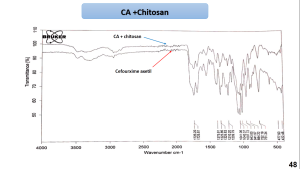
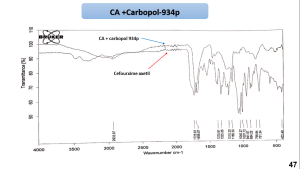
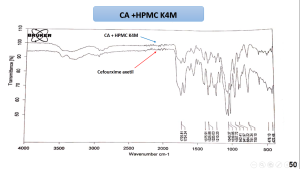
5-3- نتائج المسح الحراري التفاضلي DSC:
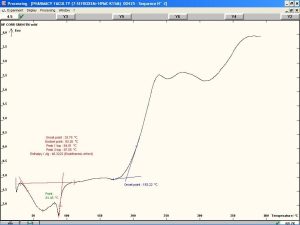
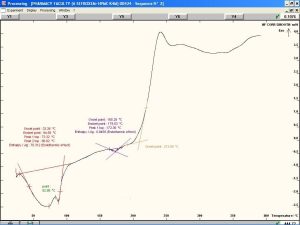
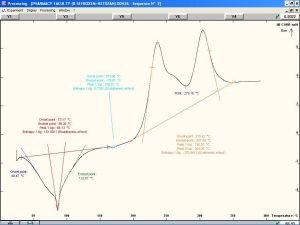
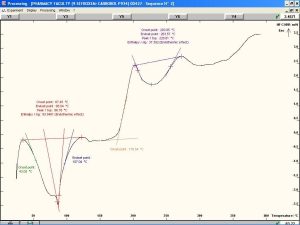
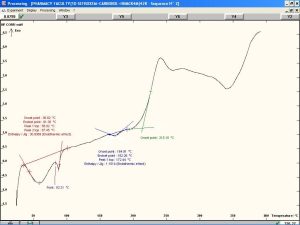
يظهر الشكل (12) وجود قمة ماصة للحرارة تصل ذروتها عند درجة حرارة °87.59، وهي تعبر عن درجة التحول الزجاجي للقسم اللابلوري من السيفوروكسيم أكسيتيل. كما نلاحظ وجود قمة ماصة للحرارة تصل ذروتها عند درجة حرارة °175.8 وهي تعبر عن درجة انصهار القسم البلوري من المادة [32]. نلاحظ أيضاً وجود قمة عريضة ناشرة للحرارة تصل ذروتها عند درجة حرارة °238.95 وهي تعبر عن تخرب وتفكك المادة الدوائية.[29]. تُظهر المخططات الحرارية للمزائج الفيزيائية للسيفوروكسيم أكسيتيل مع الشيتوزان و HPMC K4M مقارنةً بمخططات المواد النقية انزياحات بسيطة في القمم العائدة للدواء مما قد يشير إلى محدودية التآثرات بين المادتين.
تُظهر المخططات الحرارية للمزائج الفيزيائية للسيفوروكسيم أكسيتيل مع الكاربوبول 934p و HPMC K15M مقارنةً بمخططات المواد النقية وجود اختلافات واضحة مما قد يشير إلى وجود تآثرات تعزى إلى تفاعلات جزيئية بين المادتين. يُظهر المخطط الحراري للمزيج الفيزيائي للسيفوروكسيم أكسيتيل مع الكاربوبول 934p و HPMC K4M مقارنةً بمخططات المواد النقية انزياحات بسيطة في القمم العائدة للدواء مما قد يشير إلى محدودية التآثرات بين المادة الفعالة والبلمرات المستخدمة.

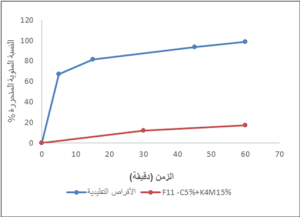
نتائج مقارنة الأقراص التجارية فورية التحرر مع أفضل صيغة تحرّر مديد (F11):
تظهر نتائج فحص الذوبان للأقراص التقليدية تحرّر كامل المادَّة الفعالة حوالي (98.9%) خلال الساعة الأولى، بينما لم يتحرر من الصيغة F11 سوى (17.5)% خلال المدة نفسها.
الاستنتاجات Conclusions
تم الحصول على أقراص ذات خواص فيزيوكيميائية جيدة للسيفوروكسيم أكسيتيل، وإنَّ زيادة نسب البلمرات في الصيغ يؤدي إلى إبطاء معدل تحرر الدواء، إنَ مشاركة الكاربوبول P934 مع بلمر HPMC K4M أدَّى إلى ضبط التحرّر، وحققت الصيغة F11 أفضل سلوك تحرّر خلال 12 ساعة، وفق متطلبات USP 38 – NF 33 للأشكال المديدة، مما يسمح بتحسين التوافر الحيوي وزيادة مطاوعة المريض وتقليل الآثار الجانبية مقارنةً بالأقراص التقليدية. أعطت أغلب الصيغ تحرراً وفق نمط Higuchi، بينما الصيغة F11 تتوافق مع نمط تحرّر من الرتبة صفر. وبينت نتائج المسح الطيفي بالأشعة تحت الحمراء والمسح الحراري التفاضلي وجود تآثر بين السيفوروكسيم أكسيتيل مع الكاربوبول 934p، ومحدودية التآثرات مع باقي البلمرات المستخدمة. يوصي البحث بإجراء دراسات ربط بين الزجاج والعضوية لاختبار قدرتها على الاحتباس في المعدة والطفو والالتصاق الحيوي، وتقييم فعاليتها.
المراجع :- Kinjal R. , Sunita A. Chaudhary2 TAM. Polyox (Polyethylene Oxide) Multifunctional Polymer in Novel Drug Delivery System. Int J Pharm Sci Drug Res. 2014. vol:6. iss:2. pp:95–101.
- Collett J, Moreton R. Modified-release peroral dosage forms. Aulton ME, editor. Pharmaceutics: the design and manufacture of medicines. 2nd ed. London: Churchill Livingstone; 2002. p. 289–305.
- Ratilal DA, D GP, H BV, P PS. A review on: sustained release technology. Int J Res Ayurveda Pharm. 2011. vol:2. iss:6. pp:1701–1708.
- Dixit N, Maurya S, Sagar B. Sustained release drug delivery system. Indian J Res Pharm Biotechnol. 2013. vol:1. iss:3. pp:305–310.
- McConnell EL, Basit AW. Modied-release oral drug delivery. Aulton ME, Taylor KMG, editors. Aulton’s Pharmaceutics The Design and Manufacture of Medicines. 4th ed. London: Churchill Livingstone; 2013. p. 550–565.
- Patil H, Tiwari R V., Repka MA. Recent advancements in mucoadhesive floating drug delivery systems: A mini-review. J Drug Deliv Sci Technol. 2016. vol:31. pp:65–71.
- Siraj S, Khurshid.I. DM. Current Trends in Gastroretentive Floating-Bioadhesive Drug Delivery System. Int J Pharm Pharm Res. 2016. vol:6. iss:1. pp:355–367.
- Israr F, Mahmood ZA, Hassan F, Hasan SMF, Jabeen S, Naz S, et al. Formulation design and evaluation of Cefuroxime axetil 125 mg immediate release tablets using different concentration of sodium lauryl sulphate as solubility enhancer. Brazilian J Pharm Sci. 2014. vol:50. iss:4. pp:943–954.
- Jammula S, Patra CN, Swain S, Panigrahi KC, Nayak S, Dinda SC, et al. Design and characterization of cefuroxime axetil biphasic floating minitablets. Drug Deliv. 2015. vol:22. iss:1. pp:125–135.
- Chavanpatil MD, Jain P, Chaudhari S, Shear R, Vavia PR. Novel sustained release, swellable and bioadhesive gastroretentive drug delivery system for ofloxacin. Int J Pharm. 2006. vol:316. iss:1–2. pp:86–92.
- Bansal S, Beg S, Garg B, Asthana A, Asthana GS, Singh B. QbD-Oriented Development and Characterization of Effervescent Floating-Bioadhesive Tablets of Cefuroxime Axetil. AAPS PharmSciTech. 2016. vol:17. iss:5. pp:1086–1099.
- Rao GK, Mandapalli PK, Manthri R, Reddy VP. Development and in vivo evaluation of gastroretentive delivery systems for cefuroxime axetil. Saudi Pharm J. 2013. vol:21. iss:1. pp:53–59.
- Manohar SD, Sanjay AN, Bhanudas SR. Formulation, Optimization And Evaluation Of Gastro Retentive Drug Delivery System Of Cefuroxime Axetil. World J Pharm Res. 2015. vol:4. iss:7. pp:1042–1060.
- Md S, Singh G, Ahuja A, Khar R, Baboota S, Sahni J, et al. Mucoadhesive microspheres as a controlled drug delivery system for gastroretention. Syst Rev Pharm. 2012. vol:3. iss:1. pp:4–14.
- Bavisia KD. Formulation and Evaluation of Floating Tablet of Cefuroxime. Int J Pharm Res Biosci. 2012. vol:1. iss:5. pp:184–192.
- Gurjar GS, Bhowmick M, Rathi V, Rathi J. Design and Evaluation of Extended-Release Cefuroxime Axetil Floating Tablets with Improved GI Absorption. J Drug Deliv Ther. 2017. vol:7. iss:1. pp:49–59.
- British-Pharmacopoeia-Commission. Appendix XII C. Consistency of Formulated Preparations. British Pharmacopeia. London, UK: Medicines and Healthcare products Regulatory Agency; 2020. p. A408–A431.
- <1217> TABLET BREAKING FORCE. The United States Pharmacopeia 38 – National Formulary33 (USP38- NF33). Rockville: The United States Pharmacopeial Convention; 2015. p. 1433.
- Brown WE. <1216> TABLET FRIABILITY. The United States Pharmacopeia 38 – National Formulary33 (USP38- NF33). Rockville: The United States Pharmacopeial Convention; 2015. p. 1432.
- Nagaraju B, Ramu B, Saibaba S V, Rajkamal B. Formulation and evaluation of floating bioadhesive Doxofylline tablets. Int J Drug Deliv. 2017. vol:8. iss:4. pp:134–141.
- Ahalya Wise MS. Cefuroxime Axetil Tablets. The United States Pharmacopeia 38 – National Formulary33 (USP38- NF33). Rockville: The United States Pharmacopeial Convention; 2015. p. 2708.
- Brown WE. <1092> THE DISSOLUTION PROCEDURE: DEVELOPMENT AND VALIDATION. The United States Pharmacopeia 38 – National Formulary33 (USP38- NF33). Rockville: The United States Pharmacopeial Convention; 2015. p. 1090.
- (CHMP) C for MP for HU. Guideline on quality of oral modified release products. European Medicine Agency. 2014. p. 1–16.
- Singhvi G, Singh M. REVIEW: IN-VITRO DRUG RELEASE CHARACTERIZATION MODELS. Int J Pharm Stud Res. 2011. vol:2. iss:1. pp:77–84.
- Draganoiu E, Rajabi-Siahboomi A, Tiwari. S. Carbomer. Raymond C Rowe, Paul J Sheskey MEQ, editor. Handbook of Pharmaceutical Excipients. 6th ed. London, UK: Pharmaceutical Press; 2009. p. 110–114.
- Suma R, Singh N, Ajay D, Gangadhar B, S. A, G.N. R. Formulation and In vitro Evaluation of Floating Tablets of Deglycyrrhinized licorice. Acta Pharm Sin. 2008. vol:50. pp:129–136.
- Jones. D. Chitosan. Rowe RC, Sheskey PJ, Quinn ME, editors. Handbook of Pharmaceutical Excipients. 6th ed. London, UK: Pharmaceutical Press; 2009. p. 159–161.
- Souza MPC de, Sábio RM, Ribeiro T de C, Santos AM dos, Meneguin AB, Chorilli M. Highlighting the impact of chitosan on the development of gastroretentive drug delivery systems. Int J Biol Macromol. 2020. vol:159. iss:January. pp:804–822.
- Sapte S, Pore Y. Inclusion complexes of cefuroxime axetil with β-cyclodextrin: Physicochemical characterization, molecular modeling and effect of L-arginine on complexation. J Pharm Anal. 2016. vol:6. iss:5. pp:300–306.
- Talaczyńska A, Lewandowska K, Jelińska A, Garbacki P, Podborska A, Zalewski P, et al. Application of vibrational spectroscopy supported by theoretical calculations in identification of amorphous and crystalline forms of cefuroxime axetil. Sci World J. 2015. vol:2015.
- Nagar M, Yadav A V. Chitosan-based intragastric delivery of cefuroxime axetil: Development and in-vitro evaluation of mucoadhesive approach. Artif Cells, Blood Substitutes, Biotechnol. 2012. vol:40. iss:6. pp:406–418.
- Varshosaz J, Hassanzadeh F, Mahmoudzadeh M, Sadeghi A. Preparation of cefuroxime axetil nanoparticles by rapid expansion of supercritical fluid technology. Powder Technol. 2009. vol:189. iss:1. pp:97–102.