صياغة هلامة موضعية محملة بجسيمات مكرومترية اسفنجية حاوية على الكليندمايسين لمعالجة العد الشائع وتقييمها في الزجاج
2022-04-01 | المجلد السادس العدد العاشر - المجلد السادس | مقالات بحثيةآلاء خطاب | أ.عبد الحكيم نتوف
الملخص
تهدف هذه الدراسة إلى صياغة الكليندمايسين ضمن جسيمات مكرومترية اسفنجية محملة بأساس هلامي لإعطاء تحرر مضبوط للدواء وتقليل تأثيراته الجانبية في علاج العد الشائع. جرى تحضير أربع صيغ من الجسيمات الحاوية على الكليندمايسين تختلف فيما بينها بنسبة الدواء إلى البلمر ونسبة العامل الفعال على السطح باستخدام طريقة اانتشار المحل الشبيه بالمستحلب. قُيّمت الخواص الفيزيائية لهذه الصيغ ودراسة التداخلات بين الدواء والسواغات المستخدمة باستخدام المسح بالأشعة تحت الحمراء FTIR)). أظهرت صور المجهر الالكتروني الماسح أن الجسيمات مسامية وكروية الشكل. أظهرت نتائج الخواص الفيزيائية أن الصيغ C1,C3 هي الأفضل من حيث كفاءة التمحفظ والمردود وأبعادها أصغر من 30 مكم. كما بيّن طيف الـ FTIR)) عدم وجود تداخلات بين الكليندمايسين والسواغات المستخدمة. استخدمت هذه الصيغ بتحضير هلامات باستخدام الكاربوبول وقُيّمت ضمن الزجاج. كانت الصيغة C10 هي الأفضل، حيث حررت ( 88.08% ) من الدواء على مدى 12 ساعة، وبلغت قيمة اللزوجة لها (21454 ± 42) سنتي بواز، وقيمة المحتوى الدوائي (99.38 ± 0.14)، وقيمة الباهاء (6.3 ± 0.09).
كلمات مفتاحية : كليندمايسين clindamycin، العد الشائع acne، ايتيل سللوز ethyl cellulose، جسيمات مكرومترية اسفنجية Microsponge، انتشار المحل الشبيه بالمستحلب Solvent diffusion method
المقدمة Introduction:
يعتبر العد الشائع او ما يعرف بحب الشباب أكثر الاضطرابات الجلدية شيوعا، حيث يظهر لدى 35-90% من المراهقين واليافعين.غالبا ما يبدأ ظهوره بعمر(7-12 سنة)، ويستمر الى مرحلة البلوغ أو قد يبدأ ظهوره في هذه المرحلة ويشفى تلقائيا في العقد الثالث من العمر. كما يمكن أن يلاحظ العد الشائع عند الأطفال بحالات نادرة ويكون ناتجا فيها عن أمراض أخرى مرافقة. يصيب العد الشائع الوحدة الشعرية الزهمية التي تشمل الجريب الشعري والغدد الدهنية. وتظهر الاصابة على شكل زؤانات مفتوحة (رؤوس سوداء)، أو زؤانات مغلقة (رؤوس بيضاء)، أو حطاطات، أو بثرات، أو عقد، أو كيسات على الوجه، والرقبة، والجذع، والكتفين، وقد يترك ندبات أو تصبغات على الجلد لذلك يعاني الأشخاص المصابون بالعد الشائع من الحرج الشديد وقلة الثقة بالنفس والاكتئاب وهذا ما يسبب لهم مشاكل في حياتهم الاجتماعية والمهنية.(1) ان كيفية تطور هذه الافات غير واضحة حتى الان لكن قد تعزى الى تفاعل وتداخل عدة عوامل أهمها: شذوذ في تكاتر وتمايز الخلايا الكييراتينية، التنبيه الاندروجيني للغدد الزهمية، اختلال التوازن بين المكروبات الموجودة في الجريب الشعري الزهمي وخاصة جرثومة البروبيونية العدية (Propionibacterium acnes)(جرثومة لاهوائية تعتبرمكون طبيعي لنبيت الجلد)، التفاعل الالتهابي، والاستجابة المناعية الخلوية والذاتية، كما يمكن ان تتاثر بعوامل اخرى كالوراثة والنظام الغذائي. (2) تتراوح شدة الاصابة من آفات طفيفة بسيطة الى آفات التهابية شديدة ومشوهة، ويصنف حب الشباب حسب عدد ونمط الأفات التي تصيب الفرد الى خفيف، متوسط الشدة، وشديد.(1) تختلف معالجة المرض اعتمادا على عدة عوامل مثل: شدة المرض، نوع البشرة، وجود تصبغات، ندبات، أو أمراض اخرى مرافقة. لكن عموماً تستخدم المعالجة الموضعية للعد الخفيف أو المتوسط الشدة وتشمل بشكل أساسي مشتقات فيتامين (أ) أو المضادات المكروبية أو المشاركة بينهما، بينما تستخدم المعالجة الجهازية للعد الشديد أو المتوسط الشدة وتشمل غالبا الصادات الحيوية أو الأدوية الهرمونية أوالايزوتريتينوئين، كما تستخدم معالجات أخرى مساعدة مثل المعالجة المعتمدة على الضوء او الليزر. يعد البنزوئيل بيروكسيد والصادات الحيوية ( الكليندمايسين، والاريترومايسين) من اشيع مضادات المكروبات الموضعية المستخدمة. حيث تتجمع الصادات الحيوية في الجريب الشعري وتقوم بتأثيرها من خلال الالية المضادة للالتهاب والمضادة للبكتيريا، هذه الأدوية تكون فعاليتها افضل ما يمكن عند مشاركتها مع البنزوئيل بيروكسيد او الريتينوئيدات وعند مشاركتها مع البنزوئيل بيروكسيد تقل المقاومة البكتيرية لها، وغالبا ما ينصح باضافتها الى الخطة العلاجية عند وجود عد شائع التهابي. يعتبر الكليندمايسين افضل صاد حيوي موضعي لمعالجة حب الشباب، وهو من زمرة اللينكوزاميد، يتوافر على شكل جل، ومحلول، ولوشن، ورغوة بتركيز 1%. حيث أن فعاليته تعادل أو تفوق فعالية التتراسيكلين الفموي في معالجة العد الخفيف أو المتوسط الشدة ، كما أنه أقل تأثرا بالمقاومة البكتيرية مقارنة مع الاريترومايسين. ان الاشكال الصيدلانية الموضعية التقليدية التي يتوافر بها الكليندمايسين حاليا تحرر الدواء عند تطبيقها على سطح الجلد بتركيز عالٍ نسبيا يمتص سريعا فتكون فيها مدة تأتيرالدواء قصيرة، أي أن الجسم يتعرض للدواء بكمية فائضة لمدة قصيرة ثم يتبع ذلك مدة طويلة لا يتعرض فيها الجسم للدواء، مما يقود لحدوث تأثيرات جانبية للدواء متمثلة بجفاف الجلد، والتهيج، والحكة، والطفح الجلدي والتهاب الجلد التماسي التحسسي، كما تسبب هذه الأشكال الصيدلانية وتسرع حدوث مقاومة جرثومية للدواء. وهذا ما يخفض من فعالية العلاج ومطاوعة المريض له لذلك دعت الحاجة الى ايجاد نظام ايتاء للدواء يزيد الى أقصى حد ممكن من مدة وجود الدواء على سطح الجلد او ضمن البشرة (epidermis) ويقلل الى أقصر حد ممكن من عبوره عبر الجلد الى الدوران الجهازي.(3)(4) تعد الكريات الميكرومترية الاسفنجية نظام ايتاء بلمري تشبه الاسفنج باحتوائها على عدد هائل من الفجوات المتصلة فيما بينها ضمن بنية غير قابلة للتخرب ، قادرة على احتباس نسبة عالية من الدواء تصل الى 60%، وهي عبارة عن كريات صغيرة يتراوح قطرها بين 5-300 ميكرومتر، خاملة ، لا تعبر الجلد وانما تتجمع ضمن الحفر والأخاديد الموجودة فيه ، وتبدأ بتحرير الدواء المحتبس بداخلها ببطء لمدة تصل الى 12 ساعة حسب حاجة الجلد له نتيجة تحريضها عند تطبيق الضغط أو اختلاف درجة حرارة الجلد أو اختلاف مدروج تركيز الدواء، ومن ثمّ تمنع التراكم الفائض للدواء ضمن البشرة (epidermis) والأدمة (dermis) فتقلل من حدوث التهيج وباقي التاثيرات الجانبية له دون التقليل من فعاليته. تتوافق هذه الكريات مع العديد من المواد الدوائية ويمكن صياغتها ووضعها ضمن اشكال صيدلانية مختلفة كالمضغوطات، والكبسولات، والهلامات، والكريم، والغسول، وغيرها ، كما تتميز بثباتيتها العالية ضمن درجة PH تتراوح من 1-11 ودرجة حرارة تصل الى 130ºC، تعد هذه الكريات ايضا عقيمة ذاتيا ( self-sterilizing ) لأن متوسط حجم المسام فيها 0.25 مكرومتر وهذا ما يجعل البكتيريا غير قادرة على العبورمن خلالها، وهي غير محسسة، وغير مخرشة، وغير مطفرة، وغير سامة. (5–8) وقد ذكرت الدراسات استخدام تقانة الكريات المكرومترية الإسفنجة في العديد من التطبيقات فمثلا جرت صياغة دواء البنزوئيل بيروكسيد بواسطتها بهدف علاج العد الشائع وسعفة القدم (athlete’s foot)(9)، كما جرت من خلالها صياغة دواء أسيكلوفير الصوديوم لمعالجة الانتانات المسببة بفيروسات الحلا البسيط (herpes simplex virus infections ) (10)، وايضا تم استخدامها حديثا لتهديف وايصال الدواء إلى الكولون (colon specific drug delivery)(11) يهدف هذا البحث الى صياغة هلامات جلدية حاوية على دواء الكليندامايسين محملاً ضمن كريات مكرومترية إسفنجية لإعطاء تحرر مضبوط ومديد للدواء وتركيزه ضمن الجلد والحد من امتصاصه الجهازي مما يقلل من تأثيراته الجانبية ويقلل من تكرار الجرعة الدوائية كما تسمح بتغليف الدواء وزيادة ثباتيته وتحسن من مظهر المستحضر الصيدلاني المطبق على الجلد وهذا بالمجمل يحسن من طواعية المريض لاستخدام الدواء. ولا يوجد حتى الآن اي دراسة قامت بعمل شكل صيدلاني جلدي مديد من الكلينداميسين.
المواد Material
جرى الحصول على الكليندمايسين هيدروكلورايد من شركة Sigma-Aldrich (Germany)، بولي فينيل الكحول Riedel-De HaenAgseelze-Hannover (Germany)، دي كلوروميتان من شركة Avon chem (UK)، الايتيل سللوز والكاربوبول 934 Sigma-Aldrich (Germany)، الغليسرين من شركة (Hutong Global-China).
الطرائقMethod
مقايسة الكليندمايسين باستخدام جهاز الاستشراب السائل الرفيع الإنجاز HPLC .
جرى تحليل الكليندمايسين باستخدام جهاز الاستشراب السائل الرفيع الإنجاز HPLC (SHIMADDZO, Japan) وفق الطريقة التي وردت بدستور الأدوية الأمريكي USP مع إجراء بعض التعديلات، حيث تألف الجهاز من مضخة LC20A وزود بمكشاف أشعة فوق بنفسجية (SPD-20A prominence uv/vis detector) واستخدم فيه عمود من نمط C18 (5um, 4.6x150mm) بدرجة حرارة 25º C. تألف الطور المتحرك من الأسيتونتريل والإيتانول والماء المنزوع الشوارد بنسبة 30:30 :40 ح/ح/ح على الترتيب، وكان معدل التدفق 2 مل/دقيقة. جرى كشف ومقايسة الكليندمايسين في موجة طولها 210 نانومتر، حيث كان حجم الحقن 20 مكرولتر. وجرى تحديد تركيز الكليندمايسن في عينة التحليل من خلال المعادلة التالية:
C2 = * C1
حيث C1: تركيز محلول عياري معلوم التركيزمن الكليندمايسين، C2: تركيزالعينة قيد التحليل،AUC1: المساحة تحت القمة المعبرة عن الكليندمايسين التي ظهرت عند حقن عينة المحلول العياري، AUC2: المساحة تحت القمة المعبرة عن الكليندمايسين التي ظهرت عند حقن عينة المحلول قيد التحليل. وضُبطت مصدوقية الطريقة التحليلية المتبعة بإجراء دراسة الانتقائية لهذه الطريقة.
تحضير الجسيمات المكرومترية الإسفنجية ((microsponge:
جرى تحضير الطور الداخلي ضمن بيشرعن طريق اضافة كمية محددة من الدواء وبلمر الإيتيل سللوز (EC) الى كمية مناسبة من محل دي كلوروميتان (DCM) ثم وضع البيشر ضمن حمام أمواج فوق الصوتية (ultrasonic bath) مدة 30 دقيقة بدرجة حرارة الغرفة من أجل التحريك وتمام الانحلال. بينما تم تحضير الطور الخارجي في بيشر آخر باضافة كمية معينة من العامل الفعال عىلى السطح (بولي فينيل الكحولPVA ) الى كمية مناسبة من الماء وأيضا وضع هذا البيشر في حمام أمواج فوق الصوتية مدة 30 دقيقة بدرجة حرارة الغرفة لكي يتم التحريك وتمام الانحلال. ثم أُضيف الطور الداخلي الى الطور الخارجي ببطء عبر محقنة (syringe)، ووضع المزيج السابق على محرك مغناطيسي لمدة ساعتين بسرعة rpm 1500 و بدرجة حرارة الغرفة. بعدها جرى ترشيح المزيج السابق بمراشح 0.45 مكرومتر ثم جفّف داخل الفرن بحرارة 40 º Cمدة 12 ساعة.
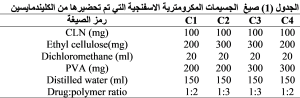
التبعثر الجيد، بعد ذلك ترك المزيج السابق لمدة 24 ساعة من أجل تمام انتباج البلمر، ثم عدل المزيج بإضافة تري ايتانول أمين TEA له نقطة فنقطة حتى الوصول الىPH = 6.5 ± 0.2. تم أخذ كمية تعادل 100 غ من الهلامة ومزجها مع كمية من الكريات المكرومترية الإسفنجية ( الصيغتين C1, C3) حاوية على دواء الكليندمايسين بمقدار 1 غ للحصول على هلامة حاوية على كريات مكرومترية إسفنجية محملة بنسبة 1% مادة الدوائية.
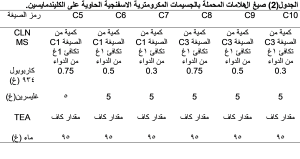 تقييم الهلامات :
تقييم الهلامات :
جرى التقييم العياني وقياس درجة الباهاء واللزوجة والمحتوى الدوائي لجميع الصيغ الهلامية المحضرة ثم عمل اختبار الانتشار ضمن الزجاج ودراسة حركية الانتشار للصيغ الهلامية التي اجتازت اختبارات تقييم الهلامات السابقة.
قياس قيمة الباهاء ال PH
تم تحديد قيمة باهاء الهلامات المحضرة باستخدام مقياس ال PH (HANNA 211)، وذلك بوضع رأس القطب الكهربائي (electrode) ضمن الهلامة ثم تسجيل النتيجة الظاهرة على شاشة الجهاز بعد دقيقتين.
الفحص العياني للهلامات (visual examination):
فُحصت الهلامات المحضرة بالعين المجردة عن طريق مد طبقة منها على صفيحة زجاجية بواسطة ملوق معدني وملاحظة لون واتساق وتجانس الهلامة.
قياس اللزوجة ( viscosity Measurement) :
حُدّدت لزوجة الهلامات المحضرة باستخدام مقياس اللزوجة نمط (Rotary viscometer STS-2011) ، حيث ملئ وعاء جمع العينة بكمية مناسبة منها ثم وضع ضمن حمام مائي موصول بجهاز مقياس اللزوجة للحفاظ على درجة حرارة تعادل 25 º C، بعد ذلك تم تدوير محور الجهاز(spindle R7) بسرعة مناسبة لقياس لزوجة العينة.
قياس محتوى الدواء(drug content) :
وُضع 1 غ من الهلامة في بيشر، ثم أضيف لها 100 مل ايتانول 95%، بعد ذلك وضع البيشر في حمام أمواج فوق الصوتية لمدة ساعة، ثم رشح المزيج السابق بمراشح 0.22 مكرومتر، وتم تحديد محتوى الدواء ضمن الهلامة من خلال قياس تركيزالدواء في الرشاحة عن طريق تحليلها بواسطة ال HPLC عند طول موجة 210 نانومتر.
دراسة الانتشار في الزجاج In- vitro diffusion studies:
أجريت دراسة الانتشار في المختبر باستخدام خلية فرانزالمعدلة للانتشار وأغشية نترات السلولوز ذات المسام 0.45 مكرومتر، حيث وُضع حوالي 0.5 غ من الهلامة المطلوب دراسة الانتشار لها ضمن حجرة المعطي(donor phase) للخلية، وعلى تماس مع غشاء نترات السللوز ذي مساحة سطح انتشار 2.54 سم 2، استخدم الكحول الايتيلي 70% كوسط للاستقبال (receptor medium) وذلك لتحقيق شرط الاغراق (sink condition) حيث بلغ حجم الوسط 9.5 مل وحرك مغناطيسيا بسرعة ثابتة، وضُبطت الحرارة بدرجة 32 ± 0.1 º C، سحبت العينات من وسط الاستقبال بحجم 2 مل خلال الفواصل الزمنية ( 0.5 ، 1، 2 ، 3 ، 4 ، 5 ، 6 ، 7 ، 8 ، 9 ،10 ،11 ، 12 ، 24 ساعة) . ورشحت عبر مراشح ميلليبور 0.45 مكم وتم التعويض بحجوم مساوية من وسط الاستقبال في كل مرة، ثم حُدّدت كمية الدواء المتحررة من الهلامة عن طريق قياس تركيز الدواء في العينة المسحوبة من الوسط المستقبل من خلال تحليلها بواسطة الHPLC عند طول موجة 210 نانومتر.
دراسة أنماط حركية انتشارالدواء في الزجاج:
جرت دراسة نمط حرائك تحرر الدواء من الصيغتين (C7, C10) باستخدام عدة نماذج للتحرر، وهي :
- نمط التحرر من الرتبة صفر Zero Order Model
- نمط التحرر من الرتبة الأولىFirst Order Model
- نمط التحرر هيكسون كراول Hixson-Crowell
- نمط التحرر وفق هيغوشي Higuchi Release
- نمط التحرر وفق كورس ماير- بيباس Korsmeyer- Peppas
واستخدام برنامج مايكروسوفت Excel 2010 لإيجاد المعادلات الرياضية الخاصة بكل نموذج من النماذج السابقة وتحديد قيمة معامل الارتباط R2 (correlation coefficient) ، حيث اعتبر النمط الذي امتاز بأعلى قيمة لمعامل الإرتباط r2 هو النمط الأفضل.
الدراسة الإحصائية:
دُرست الفروقات الإحصائية باستخدام اختبار Student’s t-test. تم التعبير عن النتائج باستخدام قيم المتوسط الحسابي SD±، واعتبرت الفروق معتداً بها احصائياً عند مستوى الدلالة (P<0.05). تم اجراء الدراسة باستخدام (برنامج Microsoft excel 2010).
النتائج والمناقشة:
تقييم الجسيمات المكرومترية الاسفنجية:
حساب كفاءة التمحفظ Encapsulation efficiency EE% ومحتوى الدواء drug content DC % والمردود Production yield PY %:
عند مقارنة نسب كفاءة التمحفظ والمحتوى الدوائي والمردود بين الصيغ ( C2، C1، C3، C4 ) نلاحظ أن الصيغة C3 تمتلك نسب EE% وDC% وPY% أعلى بشكل مهم احصائياً من الصيغة C2 عند مستوى دلالة (P=0.05)، بينما كانت نسب EE% وDC% وPY% للصيغ (C2، C3) أعلى بشكل هام احصائياً (0.05>P) من الصيغة C1، وكانت أقل نسب EE% وDC% وPY% في الصيغة C4 بفرق مهم احصائياً (0.05>P).(الجدول 3)
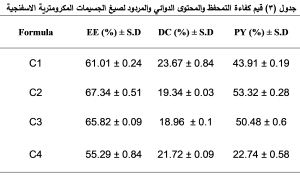
أكد (Sabyasachi) وزملاؤه أن زيادة نسبة البلمر في صياغة الجسيمات المكرومترية الاسفنجية تزيد نسب EE% و DC% و PY% (13)، وهذا يتفق مع النتائج السابقة حيث نلاحظ نسب EE% و DC% و PY% في الصيغة (C2) (67.34 ± 0.51، 19.34± 0.03، 53.32 ± 0.28) على الترتيب أعلى من نسب EE% و DC% و PY% في الصيغة (C1) (61.01 ± 0.24، 23.67 ± 0.84، 43.91 ± 0.19) على الترتيب ونسب EE% و DC% و PY% في الصيغة (C3) (65.82 ± 0.09،18.96 ± 0.1، 50.48 ± 0.6) على الترتيب أعلى من نسب EE% و DC% و PY% في الصيغة (C4) (55.29 ± 0.84، 21.72 ± 0.09، 22.74 ± 0.58) على الترتيب. وقد كان الاختلاف الوحيد بين الصيغ السابقة هو نسبة البلمر (الايتيل سللوز) المستخدمة فكانت النسبة الأعلى (300 ملغ) في الصيغ ( C2، C3 ) والنسبة الأقل (200 ملغ) في الصيغ (C1، C4 ). ويمكن تفسير ذلك بأن استخدام كمية أقل من البلمر يتنج عنها لزوجة أقل للطور العضوي مما يسرع انتشاره الى الطور المائي الخارجي وتبخره في الهواء وهذا ما ينقص الزمن اللازم للالتحام وتشكل الكريات ويسبب تصلب نسبة من البلمر والدواء قبل تشكل الكريات ودون أن تشكل كريات مما يخفض المردود والمحتوى الدوائي ضمن الكريات، أما عند استخدام البلمر بنسبة أعلى فذلك يزيد من لزوجة الطور العضوي مما يؤخر من انتشاره خارجاً ومن ثمّ يؤخر من ترسب البلمر وهذا ما يؤمن الزمن الكافي لالتحام كل أجزاء البلمر وتشكيل كريات أكبر حاوية على كمية أكبر من الدواء ، وأيضاً زيادة لزوجة الطور العضوي تعيق حركة الدواء إلى خارج القطيرات المتشكلة وتزيد من احتباس الدواء ضمن الكريات فيؤدي ذلك بالنهاية الى زيادة المردود وكفاءة التمحفظ. (13). نلاحظ من الجدول (3) أن زيادة نسبة العامل الفعال على السطح (PVA) تنقص من كفاءة التمحفظ والمحتوى الدوائي والمردود. حيث كانت نسب EE% و DC% و PY% في الصيغة (C3) (65.82 ± 0.09،18.96± 0.1، 50.48 ± 0.6) على الترتيب أقل من نسب EE% و DC% و PY% في الصيغة (C2) (67.34 ± 0.51، 19.34 ± 0.03، 53.32 ± 0.28) على الترتيب ونسب EE% و DC% و PY% في الصيغة (C4) (55.29 ± 0.84، 21.72 ± 0.09،22.74 ± 0.58 ) على الترتيب أقل من نسب EE% و DC% و PY% في الصيغة (C1) (61.01 ± 0.24، 23.67 ± 0.84، 43.91 ± 0.19) على الترتيب. وجميع الصيغ السابقة تختلف فيما بينها بالنسبة المستخدمة من العامل الفعال على السطح فقط حيث كانت نسبتة (200 ملغ) في الصيغ ( C2، C1) وهي أقل من نسبتة في الصيغ ( C3، C4) التي بلغت (300 ملغ). وقد يعزى انخفاض كفاءة التمحفظ والمحتوى الدوائي والمردود بزيادة العامل الفعال على السطح إلى كون العامل الفعال على السطح المستخدم هو PVA وهو عامل استحلابي غير متشرد، لذلك عند زيادة تركيزه يعمل على تشكيل مناطق كارهة للماء تسبب انحلال (solubilization) قسم من كمية البلمر والمادة الدوائية وهذا ما يسبب انخفاضاً في نسب EE% و DC% و PY%، أما عند استخدام نسبة أقل من PVA فذلك يقلل من انحلالية الدواء والبلمر في الطور الخارجي ومن ثمّ يقلل من خسارتهما فيزيد من نسب EE% و DC% و PY%، وهذا يتفق مع الدراسات السابقة (14). لابد من التنويه إلى حدوث التصاق للبلمر بجدران الوعاء وتشكل القليل من التكتلات أثناء عملية التحضير في جميع الصيغ وهذا بدوره أدى إلى انخفاض إضافي في المردود. بالنظر إلى الأثر المشترك لزياد نسبة البلمر وانخفاض نسبة العامل الفعال على السطح على زيادة كفاءة التمحفظ والمحتوى الدوائي والمردود نجد أن الصيغة C2 التي احتوت على النسبة الأعلى من الإيتيل سللوز والنسبة الأقل من PVA تمتلك أعلى نسب من EE% و DC% و PY%، والصيغة C4 التي احتوت على النسبة الأقل من الإيتيل سللوز والنسبة الأعلى من PVA تمتلك أقل نسب من EE% و DC% ومردود منخفض جداً وغير مقبول.
قياس أبعاد الكريات Particle size (PS) :
إن زيادة نسبة بلمر الإيتيل سللوز تؤدي إلى زيادة مهمة في أبعاد الكريات (0.05>p ) (جدول4)، ونلاحظ ذلك عند مقارنة الصيغة C2 ذات الأبعاد 34.58 ± 0.71 مع الصيغة C1 ذات الأبعاد 22.31 ± 0.02 ، ومقارنة الصيغة C3 ذات الأبعاد 25.21 ± 1.62 على الترتيب مع الصيغة C4 ذو الأبعاد 16.69± 0.09. حيث كانت أبعاد الصيغ (C2,C3) الحاوية على النسبة الأعلى من البلمر (300 ملغ) أكبر من أبعاد الصيغ (C1,C4) الحاوية على النسبة الأقل من البلمر (200 ملغ).
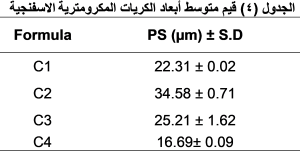
يمكن تفسير ذلك بأن استخدام كمية أكبر من البلمر في صياغة الكريات تؤدي إلى زيادة تركيز البلمر حول أجزاء الدواء وهذا بدوره يزيد من ثخانة الجدار البلمري مما يقود إلى زيادة في أبعاد الكريات المتشكلة (15). يظهر لنا الجدول (4) أيضاً أن زيادة العامل الفعال على السطح (PVA) تسبب انخفاضاً مهماً في أبعاد الكريات المتشكلة (0.05>p). حيث نجد أن أبعاد الصيغة C3 البالغة 25.21 ± 1.62 أصغر من أبعاد الصيغة C2 التي تبلغ 34.58 ± 0.71، وأبعاد الصيغة C4 البالغة 16.69± 0.09 على الترتيب أصغر من أبعاد الصيغة C1 التي تبلغ 22.31 ± 0.02، وقد كانت الصيغ (C3,C4) التي أبعادها أصغر هي الحاوية على النسبة الأكبر من PVA (300 ملغ)، أما الصيغ (C2,C1) التي أبعادها أكبر فهي الحاوية على النسبة الأقل من PVA (200 ملغ). ويعزى ذلك إلى انخفاض التوتر السطحي بين الطور الداخلي والطور الخارجي عند زيادة كمية العامل الفعال على السطح مما يسمح بتشكل قطيرات استحلابية أصغر تتصلب فيما بعد مشكلة كريات مكرومترية بأبعاد أقل. كما أن زيادة كمية العامل الفعال على السطح تضمن ثباتاً أفضل للنظام الاستحلابي تجاه تجمع والتحام القطيرات الاستحلابية مما يقود إلى تشكل كريات أصغر وأيضاً ثبات النظام الاستحلابي ينتج عنه توزع أبعاد أجزاء أضيق وأكثر تجانساً(16). وبالتالي فإن أبعاد الكريات المكرومترية تزيد بزيادة كمية البلمر وانقاص كمية العامل الفعال على السطح والعكس صحيح، لذلك جرى الحصول على أصغر أبعاد للكريات في الصيغة C4 الحاوية على النسبة الأقل من الإيتيل سللوز والنسبة الأكبر من PVA، والحصول على أكبر أبعاد في الصيغة C2 الحاوية على النسبة الأكبر من الإيتيل سللوز والنسبة الأقل من العامل الفعال على السطح. يفضل ألا تزيد أبعاد الكريات المكرومترية المستخدمة للإعطاء الجلدي عن 30 مكرومتر لذلك تم استبعاد الصيغة C2 ولم تُحضّر هلامة منها.
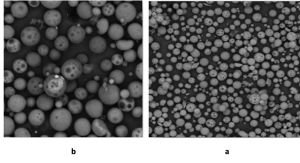
دراسة حجم وشكل وخصائص سطح الكريات باستخدام المجهر الالكتروني الماسح (SEM):
أعطت الصيغ (C1,C3) جسميات مكرومترية لها شكل كروي ومسامية عالية وسطح أملس( الشكل3)، لوحظ عدم وجود تجمع او تكتل للجسيمات في هذه الصيغ وهذا ما يدل على عدم وجود شحنات على السطح. وقد أكد (Mahesh) وزملاؤه أن المسامات تتولد نتيجة تبخر المحل من سطح الجسيمات المكرومترية.(17)
طيف الأشعة تحت الحمراء (Fourier transform infrared spectroscopy FTIR):
جرى الحصول على طيف الأشعة تحت الحمراء لكل من الكليندمايسين وبلمر الإيتيل سللوز، والمزيج الفيزيائي لهما بنسبة 1:3، والصيغة المثالية C3 ، والكاربوبول 934، والمزيج الفيزيائي للكاربوبول مع الكليندمايسين بنسبة 1:1، لدراسة امكانية حدوث تداخلات بين المواد الدوائية والسواغات الداخلة في تركيب الصيغ المحضرة. (الجدول5,6,7 ) والشكل (4,5,6).
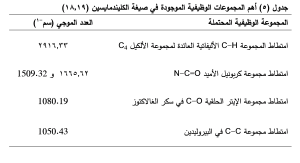
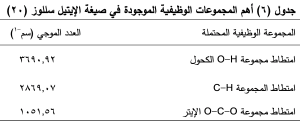
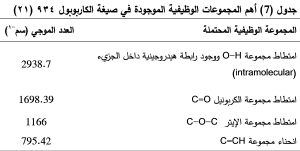
يوضح الشكل (4) طيف الأشعة تحت الحمراء للكليندمايسين وللصيغة C2، حيث يظهر في طيف الأشعة تحت الحمراء للصيغة C2 غياب بعض القمم العائدة لدواء الكليندمايسين وتخامد شدة بعضها الآخر ويعزى ذلك إلى توضع الدواء داخل الجسيمات المكرومترية، دون حدوث أي تداخل بين الدواء والسواغات المستخدمة في الصيغة بسبب عدم ظهور أي قمم جديدة. (22)
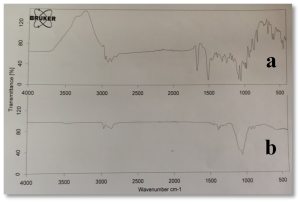
لم يُلاحظ تغيرات مهمة في مواقع القمم الوصفية للكليندمايسين ضمن المزيج الفيزيائي للايتيل سللوز والكليندمايسين بنسب 1:3، الشكل (5-c).
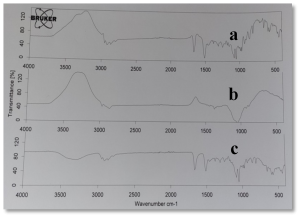
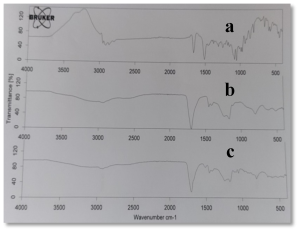
يوضح الشكل (6) طيف الأشعة تحت الحمراء للكليندمايسين والكاربوبول 934 كلاً على حدة وللمزيج الفيزيائي لهما بنسبة 1:1، حيث يظهر بقاء عصابات امتصاص الكليندمايسين الأساسية ضمن المزيج الفيزيائي مع انزياحات طفيفة. وتخامد قمة اهتزاز C-H (2916.33 سم-1) العائدة للكليندمايسين وقد يشير ذلك الى تشكيل رابطة هيدروجينية بينها وبين مجموعة O-H (2938.7 سم-1) العائدة للكاربوبول.
تحضير الهلامات:
جرى تحضير الهلامات من الصيغ (C1,C3) لأنها امتلكت نسب كفاءة تمحفظ ومحتوى دوائي ومردود عالية وأبعاد أصغر من mµ30 مناسبة للإعطاء الجلدي. واختيرت الهلامات لتحميل الجسيمات المكرومترية فيها لأن لها مظهراً تجميلياً أفضل من بقية الأشكال الصيدلانية الجلدية وغير مخرشة وذو طبيعة مائية مناسبة للحالة المرضية قيد الدراسة.
تقييم الهلامات:
الفحص العياني للهلامات:
أظهر الفحص العياني للهلامات أنها متجانسة وشفافة في جميع الصيغ الحضرة عدا الصيغ (C5,C8) حيث كانت الهلامات فيها عاتمة قليلا ومتكتلة وصعبة المد.
قياس الباهاء (Ph):
حيث تراوحت قيم باهاء الهلامات المحضرة ضمن المجال (6 ± 0.05 – 6.5 ± 0.04) (الجدول 8)، فكانت جميعها مناسبة للتطبيق على الجلد دون أن تسبب تخريش له.
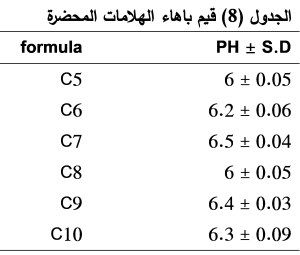
قياس اللزوجة:
نلاحظ في الجدول (9) اختلافاً واضحاً في قيم اللزوجة باختلاف تركيز الكابوبول المستخدم، حيث ارتفعت قيم اللزوجة من (22641 ± 32) سنتي بواز إلى (33567 ± 58) سنتي بواز بارتفاع تركيز الكاربوبول من (0.3%) إلى (0.5%)، وأيضا ارتفعت أكثر إلى (40538 ± 56) سنتي بواز عند استخدام تركيز أكبر من الكاربوبول (0.75%). حيث تؤدي زيادة نسبة الكاربوبول إلى زيادة كثافة تصالب الشبكة البلمرية التي يكونها مما يرفع من قوام الهلامة ويجعلها أكثر تكتلاً وهذا يتوافق مع نتائج الفحص العياني التي وجدناها سابقا.(23) لذلك استُبعدت الصيغ (C5,C8) من أجراء الفحوص اللاحقة عليها بسبب لزوجتها المرتفعة جداً ومظهرها الغير مقبول.
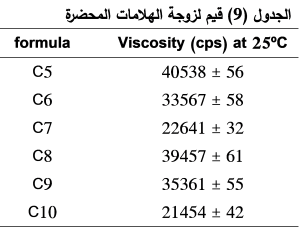
قياس محتوى الدواء(drug content) :
نلاحظ من الجدول (10) أن جميع صيغ الهلامات (C6,C7,C9,C10) متجانسة في المحتوى، حيث تراوحت قيم المحتوى الدوائي لها بين (98.57 ± 0.06) و (100.28 ± 0.02) وجميعها قيم مقبولة.
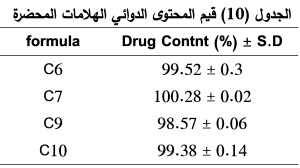
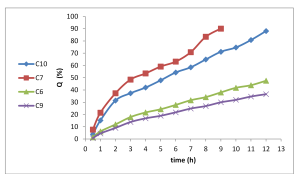
دراسة الانتشار في الزجاج In- vitro diffusion studies:
نلاحظ من الشكل (7) أن الصيغ (C6,C9) الحاوية على تركيز 0.5% من الكاربوبول لم تحرر سوى نسبة تراوحت بين (36.58%) و (47.55%) من المادة الدوائية خلال 12 ساعة، في حين زادت النسبة المئوية المتحررة بشكل هام (0.05>p) إلى قيم تراوحت بين (88.08%) و (90.09%) عند انخفاض تركيز الكاربوبول إلى 0.3% في الصيغ (C7,C10). كما ذكرنا سابقاً عند مناقشة نتائج لزوجة الهلامات بأن زيادة تركيز الكاربوبول تزيد كثافة تصالب الشبكة البلمرية التي يكونها وتزيد لزوجة الهلامة وهذا ما يسبب طريق أطول وأصعب لانتشار الدواء مما يعيق من تحرره من الهلامة.(23). إن زيادة نسبة الإيتيل سللوز تؤدي إلى معدل تحرر أقل بفرق مهم احصائياً (0.05>p)، وهذا ما نجده في الصيغة (C10) الحاوية على 300 ملغ من الإيتيل سللوز حيث حررت 88.08% من الدواء على مدى 12 ساعة، أما الصيغة (C7) الحاوية على 200 ملغ من الإيتيل سللوز حررت 90.09% من الدواء خلال 9 ساعات فقط. وكان معدل تحرر الدواء من الصيغة (C6) أعلى بشكل واضح (0.05>p) من الصيغة (C9) عند جميع النقاط الزمنية. ويمكن تفسير ذلك من خلال نتائج فحوص تقييم أبعاد الكريات المكرومترية، حيث وجدنا أن زيادة نسبة الإيتيل سللوز أدت إلى زيادة في أبعاد الكريات ولعل هذا ينتج عنه طريق أطول لانتشار الدواء عبر الكريات وخروجه منها ومن ثم يسبب ذلك تحرراً أبطئاً له منها. أما أبعاد الكريات الأصغر الناتجة عن استخدام كمية أقل من الإيتيل سللوز تؤمن طريقاً أقصر لانتشار وتحرر الدواء كما تكون الكريات الأصغر لديها مساحة سطح نوعية على تماس مع وسط التحرر أكبر وذلك كله يجعل معدل تحرر الدواء منها أعلى.(24)
دراسة حركية تحرر الدواء:
نلاحظ من الجدول (11) أن الكليندمايسين يتحرر من الصيغ (C7,C10) وفق نموذج هيغوتشي. كما نلاحظ أن قيمة أس الانتشار (n) في الصيغتين السابقتين أكبر من 0.5 وبالتالي فإن التحرر لا يتبع قانون فيك ويتم بآليتن هما الانتشار وتآكل البلمر.(25)
الاستنتاجات Conclusion
جرى تحضير جسيمات مكرومتريّة اسفنجية microsponge بشكل ناجح باستخدام طريقة انتشار المحل الشبيه بالمستحلب emulsion solvent diffusion method، تم تحميل الجسيمات المكرومترية ضمن أساس هلامي من الكاربوبول. أعطت الهلامة تحرراً مديداً وعالياً حيث بلغ 88.08% خلال 12 ساعة . كانت الجسيمات الصلبة كروية ومسامية، كما أظهرت صور الـ SEM. لم يبدُ تداخل بين الكليندمايسين والايتيل سللوز وظهر توضع الدواء ضمن الجسيمات بنتيجة الـ FTIR.
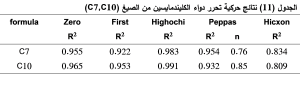
- Vary JC. Selected Disorders of Skin Appendages-Acne, Alopecia, Hyperhidrosis. Med Clin North Am. 2015;99(6):1195–211.
- Hazarika N. Acne vulgaris: new evidence in pathogenesis and future modalities of treatment. J Dermatolog Treat. 2019;5(9):50-91.
- Zaenglein AL, Pathy AL, Schlosser BJ, Alikhan A, Baldwin HE, Berson DS, et al. Guidelines of care for the management of acne vulgaris. J Am Acad Dermatol. 2016;74(5):945-973.e33.
- Brayfield A. Martindale the complete drug reference, 38th Edition. In Pharmaceutical Press; 2014. p. 1696,1695,325,269-272,1724.
- Badhe KP, Saudagar RB. A Review on Microsponge a Novel Drug Delivery System. Asian J Pharm Res. 2016;6(1):51.
- Mahant S, Kumar S, Nanda S, Rao R. Microsponges for dermatological applications: Perspectives and challenges. Asian J Pharm Sci. 2020;15(3):273–91.
- Pravin Gupta DKMK. Microsponge Technology as a Versatile Drug Delivery Vehicle: Review. Glob J Pharm Educ Res. 2018;6(1–2):1–6.
- Singhvi G, Manchanda P, Hans N, Dubey SK, Gupta G. Microsponge: An emerging drug delivery strategy. Drug Dev Res. 2019;80(2):200–8.
- Jelvehgari M, Siahi-Shadbad MR, Azarmi S, Martin GP, Nokhodchi A. The microsponge delivery system of benzoyl peroxide: Preparation, characterization and release studies. Int J Pharm. 2006;308(1–2):124–32.
- Yasmeen BR, Chakravarthi RN. Preparation and Evaluation of Microsponge Loaded. 2012;3(2):96–102.
- Lembhe S, Dev A. Design Development and Evaluation of Mesalamine Loaded Microsponge Compressed Into Tablet for Colon. World J Pharm Res Pharm Pharm Sci. 2016;5(7):1235–66.
- Patent application publication. crystaline clindamycin free base. 2003: Pub.No: CA2458644A1.
- Maiti S, Kaity S, Ray S, Sa B. Development and evaluation of xanthan gum-facilitated ethyl cellulose microsponges for controlled percutaneous delivery of diclofenac sodium. Acta Pharm. 2011;61(3):257–70.
- Kalkotwar RS. “Ethyl Cellulose Based Microsponge Delivery System for Anti-Fungal Vaginal Gels of Tioconazole.” J Drug Deliv Ther. 2013;3(6):14–20.
- Aggarwal G, Nagpal M. Development and Comparison of Nanosponge and Niosome based Gel for the Topical Delivery of Tazarotene. Pharm Nanotechnol. 2016;(January 2018).
- Obiedallah MM, Abdel-Mageed AM, Elfaham TH. Ocular administration of acetazolamide microsponges in situ gel formulations. Saudi Pharm J. 2018;26(7):909–20.
- Kumar PM, Ghosh A. Development and evaluation of silver sulfadiazine loaded microsponge based gel for partial thickness (second degree) burn wounds. Eur J Pharm Sci. 2017;96:243–54.
- Sangnim T, Limmatvapirat S, Nunthanid J, Sriamornsak P, Sittikijyothin W, Wannachaiyasit S, et al. Design and characterization of clindamycin-loaded nanofiber patches composed of polyvinyl alcohol and tamarind seed gum and fabricated by electrohydrodynamic atomization. Asian J Pharm Sci. 2018;13(5):450–8.
- Mohamed AI, Abd-Motagaly AME, Ahmed OAA, Amin S, Ali AIM. Investigation of drug-polymer compatibility using chemometric-assisted UV-spectrophotometry. Pharmaceutics. 2017;9(1).
- Mahmoud DBED, Shukr MH, ElMeshad AN. Gastroretentive Microsponge as a Promising Tool for Prolonging the Release of Mitiglinide Calcium in Type-2 Diabetes Mellitus: Optimization and Pharmacokinetics Study. AAPS PharmSciTech. 2018;19(6):2519–32.
- Sahoo S, Chakraborti CK, Mishra SC, Naik S, Nanda UN. FTIR and Raman Spectroscopy as a Tool for Analyzing Sustained Release Hydrogel of Ciprofloxacin/Carbopol Polymer. Int J Pharm Sci Res. 2011;2(2):268–77.
- Patel MR, Patel RB, Parikh JR, Patel BG. Formulation consideration and skin retention study of microemulsion containing tazarotene for targeted therapy of acne. J Pharm Investig. 2016;46(1):55–66.
- Naji* GH, Al-Hameed SNA. Study the Effect of Variables on Piroxicam Microsponge Formulated as Topical Gel for Transdermal Drug Delivery System Ghada. Int J Pharm Sci Rev Res. 2017;42(1):241–9.
- Osmani RAM, Aloorkar NH, Ingale DJ, Kulkarni PK, Hani U, Bhosale RR, et al. Microsponges based novel drug delivery system for augmented arthritis therapy. Saudi Pharm J. 2015;23(5):562–72.
25. Dash S, Murthy PN, Nath L, Chowdhury P. Kinetic modeling on drug release from controlled drug delivery systems. Acta Pol Pharm – Drug Res. 2010;67(3):217–23.