تأثير التعدّد الشكلي مفرد النيكليوتيد لجينSLCO1B1 في الاعتلال العضلي المُحرَّض بالأتورفاستاتين لدى جمهرة من السورييــن
2024-09-01 | المجلد السابع العدد الرابع - المجلد السابع | مقالات بحثيةثريا نجم العريان | لمى علي يوسف
الملخص
خلفيّة البحث وهدفه: تُعدّ الستاتينات (مثبطات أنزيم HMG-Co A reductase) “المعيار الذّهبي” لتدبير فرط الكوليستيرول في الدّم. وعلى الرغم من تحمّلها الجيّدٍ لدى معظم المرضى، يحيط بالستاتينات مخاوف بشأن مأمونيّتها نظراً للاعتلالات العضليّة التي قد تحدثها، ممّا يؤدّي لضعف المطاوعة وإيقاف العلاج. يُنسَب الاعتلال العضلي المُحدث بالستاتين (SAM) إلى جملةٍ من العوامل البيئيّة والجينيّة، ومنها التعدُّد الشكلي مفرد النيكليوتيد T521C في جين SLCO1B1. هَدَفتْ هذه الدراسة إلى تحرّي ارتباط أليل الخطورة “C”في جين SLCO1B1 بـ SAM لدى جمهرة من المرضى السوريّين المتداوين بالأتورفاستاتين.
تصميم الدراسة والطرائق: تضمّنت هذه الدراسة الرصديّة من نمط حالات–شواهد 67 مريضاً معالجين بالأتورفاستاتين؛ توزّعوا بين 26 مريضاً ممن عانوا SAM، مع أو دون ارتفاع في إنزيم كرياتين كيناز CK)) المصلي، و41 شاهداً لم يُعانِ SAM. نُمِّطَ مرضى المجموعتين جينيّاً بطريقة السَلْسَلَة لمنتجات التضخيم النوعيّة لتفاعل البوليميراز التَسَلْسلي (PCR) لمنطقة التّعدّد الشّكلي المدروس في جين SLCO1B1، حُسبت تواترات الألائل والأنماط الجينيّة وقورنت بين المجموعتين وحُلِلّت البيانات إحصائيّاً باستخدام برمجية SPSS (إصدار26).
النّتائج: بلغ تواتر أليل الخطورة “C” نسبةً قَدرُها 21.2% و8.5% في الحالات والشواهد، على التّرتيب، وبفارقٍ معتدٍّ به إحصائيّاً (p=0.032). كانت غالبية مرضى الدراسة من النمط الجيني الشائع TT (65.4% مقابل 82.9%، p= 0.19) متبوعاً بالنمط الجيني متخالف الزيجوت TC (26.9% مقابل 17.1%، p=0.55) في مجموعتي الحالات والشواهد، على الترتيب. اقتصر النمط الجيني متماثل الزيجوت CC على مريضي SAM وبنسبة تواتر بلغت 7.7% (p= 0.026). تحقّق توزّع الأنماط الجينيّة توازن Hardy Weinberg في كلتا مجموعتي الحالات والشواهد (p= 0.189 وp= 0.513، على الترتيب). انتفت علاقة الارتباط بين SAM وأيٍّ من العوامل اللاجينيّة (مثل العمر والجنس وBMI والتدخين وجرعة الأتورفاستاتين).
الاستنتاجات: برهنت نتائج دراستنا الحاليّة تواتراً مرتفعاً نسبيّاً لأليل الخطورة C في جينSLCO1B1 لدى مرضى سوريين عانوا SAM بالمقارنة مع الشّواهد، ودعمت انخراط النمط الجينيCC في زيادة الاستعداد للاعتلال العضلي المُحرَّض بالأتورفاستاتين مع انتفاء دور العوامل اللاجينيّة المدروسة.
كلمات مفتاحية : SLCO1B1، أتورفاستاتين، تعدّد شكلي مفرد النيكليوتيد (SNP)، اعتلال عضلي محدث بالستاتين، سوريون، atorvastatin, single nucleotide polymorphism (SNP), statin associated myopathy, Syrians
المقدمة
تتصدّر مثبطات إنزيم هيدروكسي ميتيل غلوتاريل كو إنزيم A ريدوكتازHydroxy Methyl Glutaryl Coenzyme A (HMG CoA) (الستاتينات) الخيارات الدوائيّة المعتمدة لتدبير فرط كوليسترول الدم hypercholesterolemia، والوقاية الأوليّة والثانويّة من الحوادث القلبيّة الوعائية1، حيث حاز كلٌّ من أتورفاستاتينAtorvastatin وسيمفاستاتين Simvastatin وروزوفاستاتين Rosuvastatin وبرافاستاتينPravastatin المراتب الأولى والثالثة عشرة والسابعة عشرة والرابعة والثلاثين، على الترتيب في قائمة الأدوية الأكثر وصفاً لعام 2022 في الولايات المتحدة الأمريكيّة والعالم2,3، تمثّل الستاتينات مضاهيات مشابهة بنيويّاً ومثبطات تنافسية لإنزيم HMG CoA Reductase، مما يُعيق اصطناع الميفالونات، وهي الخطوة المفصليّة في عملية الاصطناع الحيويّ للكوليسترول ضمن الكبد، وتعدّ الستاتينات المعيار الذهبي لخفض البروتين الشحمي منخفض الكثافة Low Density Lipoprotein (LDL) وبمعدل يتراوح بين 55% إلى 06% بالجرعات القصوى، وذلك بآلية تفضي لزيادة عدد المستقبلات عالية الألفة لـ LDL، تمهيداً لقبطه من الدوران وإدخاله إلى الخلايا الكبديّة.4,5,6 كما تمتلك الستاتينات فعاليّات مستقلة عن خفض الـ LDL، وذلك عبر تثبيطها لكلّ من تشكّل العصاد وهجرة الخلايا العضليّة الملس6، وتنخرط في عمليّة كبح الوسائط الالتهابيّة6،7، وتحفّز اصطناع أكسيد النتريك ضمن بطانة الأوعية الدموية 6،8. تتمتّع الستاتينات بهامش مأمونيّةsafety واسع لدى غالبية المرضى، غير أنّها قد تسبب تأثيرات عضليّة وكبدية ضارّة adverse effects . تمثّل التأثيرات العضليّة الضارّة على وجه التحديد مشكلةً صحيّة تتسبّب بانخفاض مطاوعة المرضى للعلاج طويل الأمد وفشل في تحقيق المحصلات العلاجيّة، مما يؤثر سلباً في نوعيّة حياة المريض من حيث النشاط الفيزيائي والقوة العضليّة وقيامه بالنشاطات اليوميّة9. وتشمل أعراض الاعتلال العضلي المُحرَّض بالستاتينات Statin Associated Myopathy (SAM) كلّاً من التعب والألم والتكزّز في العضلات والضعف العضلي، وتميل هذه الأعراض لتكون مُعمّمة وتتفاقم لدى بذل أي مجهود. تتراوح فترة ظهور هذه الأعراض بين أسبوع وثلاث سنوات وغالباً ما تكون في مواقع متناظرة من الجسم10. تتباين التظاهرات السريريّة المعبّرة عن خطورة الاعتلال العضلي بشدّة، وهذا ما تبيّنه التوصيفات السريريّة، حيث تتراوح بين تكزّز عضلي مؤلم وتصلّب في العضلات وهو ما يشار إليه بالألم العضلي Myalgia وصولاً إلى حالة انحلال الرُبيدات في العضلات المُخططة Rhabdomyolysis المهدّدة للحياة9، يُنسَب الاعتلال العضلي المُحرَّض بالستاتينات إلى جملة من العوامل البيئيّة والسريريّة الداخليّة مثل التقدّم بالعمر وانخفاض منسب كتلة الجسم Body Mass Index (BMI)، كما تُعدّ النساء أكثر عرضةً للإصابة من الرجال. وتؤدي الأمراض الاستقلابيّة دوراً في تفاقم الاستعداد لحدوث التأثيرات العضليّة الضارّة المُرافقة للتداوي بالستاتينات،11–13،14 وتشمل العوامل الخارجيّة كلّاً من: التداوي بالجرعات العالية من الستاتينات، وعلى الأخص الستاتينات ذات الألفة الأكبر للدسم مثل سيمفاستاتين وأتورفاستاتين ولوفاستاتين لقابلية نفاذيتها الأكبر عبر الأغشية الخلويّة إلى النسج المختلفة، إضافة إلى التناول المفرط للكحول 11–13. كما تبيّن أنّ المعالجة المتزامنة بالستاتينات مع بعض الأدوية قد تؤدي إلى زيادة المستويات المصليّة للستاتينات وزيادة الاستعداد لحدوث الاعتلال العضلي.15 فضلاً عن تأثير العوامل الجينيّة في الحرائك الدوائيّة للستاتينات. يأتي في طليعة هذه العوامل جين Solute Carrier Organic Anion Transporter member 1B1 (SLCO1B1) والتي تُرمِّز للبروتين الناقل للأيونات العضويّة الذوابة Organic Anion Transporter من النمط B11 (OATP1B1)13، حيث تدخل الستاتينات الخلايا الكبدية بتواسط بروتين OATP1B1، وهي خطوة مفصليّة لنفاذيتها إلى موقع تأثيرها، وكذلك إنزيمات استقلابها. تتوضّع جين SLCO1B1 في الذراع القصير للصبغي الثاني عشر وتتضمّن 14 إكسوناً مرمّزاً لـ 691 حمضاً أمينيّاً16، وتخضع هذه الجين لتعدّدات شكليّة عديدة لعلّ أبرزها التعدّد الشكلي مفرد النيكليوتيدSingle Nucleotide Polymorphism (SNP) في الموقع 521 في الإكسون السادس، والذي يؤدي إلى استبدال الأساس النيكليوتيدي السيتوزين بالتايمين استبدالاً غير مرادفnonsynonymous ينجم عنه توضّع الحمض الأميني الألانين بدلاً عن الفالين في الموقع 174 من البروتين الناتج وبالتالي نقص التعبير عنه على سطح الخلية، مما يؤدي إلى ارتفاع التراكيز المصليّة للستاتينات وازدياد احتمال حدوث التأثيرات الضارّة وعلى رأسها الاعتلال العضلي. 12 ,14, ,17 18, 19 يتباين تأثير SLCO1B1 c.521C>T في زيادة التراكيز المصليّة للستاتينات، حيث ينجم عنه تبدّلات ملحوظة في الحرائك الدوائيّة لكلّ من البرافاستاتين والروزوفاستاتين والبيتافاستاتين وحمض السيمفاستاتين، دون تأثير يُذكر على الشكل اللاكتوني له لكونه أكثر ألفة للدسم وغير متأيّن في pH البلازما على النقيض من حمض السيمفاستاتين الذي لا يمكنه عبور الأغشية الخلوية للخلايا الكبديّة بآليّة الانتشار اللا فاعل passive diffusion نظراً لتأيّنه. والأمر ذاته بالنسبة للستاتينات ذات الألفة العالية للماء، مما يتسبب بنقص توافرها في موقع التأثير داخل الخلوي وما يترتّب على ذلك من انخفاض في الفعاليّة العلاجيّة، إضافةً إلى ازدياد التراكيز المصليّة وزيادة احتمال حدوث التأثيرات الضارّة، مما يعني انزياحاً في توازن الفوائد والمخاطر للمعالجة.18 تتباين استجابة المرضى للستاتينات مقدّرةً بانخفاض مستويات الـ LDL، والمدة الزمنية اللازمة للوصول لأفضل استجابة، كما تتباين أُهبة المرضى لحدوث الاعتلال العضلي المترافق مع التداوي بالستاتينات، ويعزى ذلك إلى التبدّلات الجينيّة المؤثرة في الحرائك والديناميكيّة الدوائيّة بين الأفراد. حيث ينجم عن وجود نسختين من الأليل C ازدياداً في خطورة حدوث الاعتلال العضلي المُحرَّض بالستاتينات بمقدار 16.9 ضعف19,20، لذلك يُوصى بخفض جرعة الستاتينات لدى الأفراد الحاملين لنسخة واحدة من أليل الخطورة C، وتخفيضها بشكل أكبر في حالة الأفراد الحاملين لنسختين من الأليل C، كما يمكن استبدال الستاتين المستعمل بالفلوفاستاتين الذي لم يظهر ازدياداً في التراكيز المصليّة له لدى الأفراد الحاملين لأليل الخطورة C.21 تتجلى أهميّة تنميط جين SLCO1B1 في مساهمته بشخصنة المعالجة بالستاتينات بحيث يمكن تحديد الأفراد ذوي الاختطار الأعلى لتطور اعتلال عضلي. تجدر الإشارة إلى تباين SLCO1B1 c.521C>T باختلاف العرق، حيث يبلغ أقصى انتشار وبنسبة تصل إلى 8– 20% لدى المنحدرين من أصل أوروبي، و1%-2% لدى الأمريكيين من أصل إفريقي، و9%-16% لدى الآسيويين.22 ولذلك فقد أصدرت العديد من الهيئات المختصّة في علم الجينات الدوائي مثل التحالف التنفيذي لعلم الجينات الدوائي السريري Clinical Pharmacogenetics Implementation Consortium (CPIC)، توصيات بالاختبارات الهادفة إلى شخصنة التداوي بالستاتينات اعتماداً على تحرّي وجود التعدّدات الشكليّة المؤثرة في الفعاليّة العلاجيّة أو المُؤهِّبة لحدوث التأثيرات الضارّة، حيث شملت هذه التوصيات تحرّي التعدّد الشكليّ c.521T>C لجين SLCO1B1 وربط النمط الجيني بالنمط الظاهري لدى المرضى المتداوين بكلّ من الأتورفاستاتين واللوفاستاتين والبيتافاستاتين والبرافاستاتين إضافةً إلى السيمفاستاتين وذلك وفقاً لآخر التحديثات الصادرة في شباط عام 232022، موضحةً إمكانيّة وصف الجرعة المُفَضلة من الستاتينات وفق حالة المريض لدى الأفراد الذين يمتلكون نمطاً ظاهرياً طبيعيّاً أو نمطاً ظاهرياً فائق الفعاليّة، في حين تنوعت التوصيات باختلاف الستاتين الموصوف لدى الأفراد الذين يمتلكون فعاليّة منقوصة أو ضعيفة.26,25,24,23 نظراً لأهميّة T521>C SLCO1B1 وعلاقته بالاستعداد لحدوث الاعتلال العضلي المُحرَّض بالستاتينات فقد دُرِسَ تواتره لدى جمهرات سكانيّة مختلفة ومن ضمنها شعوب البلدان العربيّة، إلا أنّه لم تُجرَ أي دراسة بحدود علمنا لاستقصاء تواتر انتشاره لدى السوريّين لتقييم علاقته بالاعتلال العضلي المترافق مع التداوي بالأتورفاستاتين. ولذلك، فقد هدَفَت دراستنا إلى تحرّي تواتر انتشار التعدّد الشكلي T521>C لدى مجموعة من المرضى السوريين المتداوين بالأتورفاستاتين ممن عانوا اعتلالاً عضليّاً مرافقاً، ومقارنة الانتشار مع مجموعة شاهدة لأفراد لم يعانوا أي أعراض عضليّة مرافقة للمعالجة، إضافةً إلى تحرّي العوامل اللاجينيّة والتداخلات الدوائية المؤثّرة في الإصابة بالاعتلال العضلي المرافق للستاتينات ومقارنتها بين المجموعتين.
المواد والطرائق
الاعتيان والعمل المخبري
صُمِّمَت دراستنا لتكون استرجاعيّة من نمط حالات – شواهد Retrospective Case-Control Study حيث شملت مجموعة الحالات Case group المرضى الذين عانوا اعتلالاً عضليّاً مرافقاً للتداوي بالأتورفاستاتين في أيّ مرحلة كانوا، في حين شملت مجموعة الشواهد Control group المرضى المتداوين بالأتورفاستاتين ممن لم يعانوا أيّ تأثيرات عضليّة ضارّة. حظيت هذه الدراسة بموافقة لجنة أخلاقيات البحث العلمي في جامعة دمشق رقم /433/ بتاريخ 3/2/2020. وأجريت بشقّها السريريّ في مستشفى الأسد الجامعي وعدد من العيادات الخاصّة، حيث تمت مراجعة سجلات المرضى الطبيّة لتقييم أهليتهم للمشاركة وتحقيقهم لمعايير التضمين في أحد مجموعتي الدراسة ثم التواصل معهم لضمان موافقتهم على المشاركة والاعتيان. في حين أُنجِزَ الشقّ المخبري في مخابر التقانات الحيويّة الصيدلانيّة والمناعيّة في الهيئة العامة للتقانة الحيويّة. بُزِلَت عينة دم محيطي يتراوح حجمها بين (1-3 مل) من مرضى الدراسة إلى أنابيب حاوية على مضاد تخثر EDTA (Ethelyn Diamine Tetra Acetic Acid)، وحُفِظَت في المُجمِّدة بدرجة حرارة (-20°C) لحين استخلاص الحمض الريبي النووي منقوص الأوكسجين الجينومي Genomic Deoxy Ribonucleic Acid (gDNA)، تمّ استخلاص الدنا الجينومي gDNA باستخدام عتيدة Blood DNA Preparation – Solution Kit من شركة Jena Bioscience الألمانية بعد إذابة العينات المُجمَّدة وفق تعليمات الشركة المُصنِّعة، ثمّ قيسَت تراكيز ونقاوة الدنا باستخدام جهاز NanoDrop من شركة MaestroGen التايوانيّة، في حين اقتُبِسَت المُرَئِسات Primers من الأدبيّات الطبيّة27 وصُنِّعَت من قبل شركة Macrogen (كوريا الجنوبيّة) وفق التسلسل 5’.CCCCAGCCATGAGGAACTAT.3’ للمُرَئِس التقدّميForward Primer ، والتسلسل 5’.TCCCCTATTCCACGAAGCA.3’ للمُرَئِس العكسي Reverse Primer ، وتمّ التحقّق من تضخيمها للتسلسلات الحاوية على التعدّد الشكلي المدروس في جين SLCO1B1 باستخدام أداة Primer BLAST (Basic Local Alignment Search Tool)، ثم التحقّق من نوعيّتها باستخدام موقع MFEprimer. أُجري تفاعل البوليميراز التسلسلي PCR باستخدام جهاز المدوّر الحراري من شركة SENSEQUEST® الألمانيّة. اعتُمِدَت الشروط الواردة في الجدول (1) في تفاعل الـ PCR بعد أن خضعت لعمليات الأمْثَلَة، حيث تطلّب التفاعل: 50 نانوغرام من الدنا الجينومي، 5 بيكومول من كلٍّ من المُرَئِسين التقدّمي والعكسي، و10 ميكرولتر من المزيج الرئيسي Master Mix 2X، وتم إتمام الحجم حتى 20 ميكرولتر بالماء المقطّر. رُحِّلَت منتجات تضخيم تفاعل الـ PCR على هُلامة أغاروز (GeneDireX، تايوان) بتركيز 1.5% لمدة 25 دقيقة في جهاز الرحلان الأفقي، وتم ذلك بالتزامن مع ترحيل سلم عياري من الدنا DNA Ladder 100 bp، ظُهِرَت منتجات الرحلان باستخدام الأشعة فوق البنفسجيّة بوجود بروميد الإيتيديوم (Euroclone، إيطاليا) للتحقق من وجود عصابة وحيدة وفق الطول المتوقع للمنتج، نُقيَت المنتجات إنزيميّاً ثمّ سُلْسِلَت العينات من قبل شركة Macrogen® في كوريا الجنوبية باستخدام تقنية الرحلان الكهربائي الشعري (CES) Capilliary Electrophoresis Sequencing باستعمال جهاز ABI 3730XL sequencer وعتيدة السَلْسَلَة ABI BigDye™ Terminator Cycle Sequencing Kit. قمنا بقراءة النتائج باستخدام برمجيّة Geneious للتأكّد من تطابق التسلسل الناتج لتسلسل الجين المستهدفة، ولتحديد النمط الجيني لكلّ عينة.
التحليل الإحصائي
تم تحليل البيانات إحصائياً باستعمال برنامج الحزمة الإحصائية للعلوم الاجتماعية SPSS بإصدارها 26، تمّ التحقّق أن الأنماط الجينيّة المدروسة محقّقة لمعادلة هاردي واينبيرغHardy Weinberg Equilibrium (HWE) واعتُمِدَ اختبار كاي مربع للمقارنة بين تواتر النمط الجيني المُستَعرَف وتواتر النمط الجيني المتوقع. دُرِسَت العلاقة بين النمط الجيني والعوامل اللاجينيّة مع حدوث الاعتلال العضلي المُحرَّض بالأتورفاستاتين. واعتُمِدَت قيمة الدلالة p-value < 0.05 لجميع الاختبارات الإحصائيّة المُطبّقة.
الجدول (1): الشروط المعتَمَدة لإجراء تفاعل الـ PCR الخاصّة بالكشف عن التعدّد الشكلي مفرد النيكليوتيد 521T>C في جين SLCO1B1
| الخطوة Step | درجة الحرارة Temperature (C⁰) | المدة Duration | |
| تمسّخ بدئي Initial Denaturation | 96 | 10 دقائق | |
| 35 دورة | تمسّخ Denaturation | 96 | 30 ثانية |
| ارتباط المُرَئِسات بالتسَلْسُلات المتممة
Primer Annealing |
56 | 30 ثانية | |
| استطالة Elongation | 72 | 1 دقيقة | |
| استطالة نهائية Final Elongation | 72° | 10 دقائق | |
النتائج
سير الدراسة
قمنا بغربلة 34776 قيمة مخبريّة لإنزيم كرياتين كيناز CK مجراة لـ 12217 مريضاً من سجلات المختبرات الطبيّة لمستشفى الأسد الجامعي في دمشق والمُجراة خلال الفترة الواقعة بين 1\1\2019 و19\8\2021. استُبعِدَ جميع المرضى الذين كانت قيم إنزيم CK طبيعيّة لديهم، ثمّ استُبعِدَ المرضى الذين عانوا ارتفاعاً في قيم CK مقترناً مع ارتفاع في قيم النظير القلبي لإنزيم كرياتين كيناز CKMB، أو ارتفاع في قيم التربونينTroponin. نتج عن استقصاء البياناتdata screening 130 نتيجة تعود لمرضى عانوا ارتفاعاً في قيم CK غير مفسّرة لعدم ترافقها مع ارتفاع في أي من CKMB أو التربونين. أتبعنا ذلك بمراجعة السجلات الطبيّة الخاصّة للمرضى الذين حققوا CK كلي مرتفع، تروبونين سلبي، وCKMB منخفض، لتوصيف الخصائص السريريّة والتواصل معهم في حال تحقيقهم لمعايير التضمين الأخرى في مجموعة الحالات. حقّق 55 مريضاً معايير التضمين ضمن مجموعة الحالات، وتمّ التواصل معهم جميعاً. شملَت الدراسة 13 مريضاً عانوا اعتلالاً عضليّاً مُحرَّضاً بالعلاج بالأتورفاستاتين، وترافق ذلك مع ارتفاع قيم إنزيم CK المصليّة، في حين لم نتمكّن من تضمين باقي المرضى لعدّة أسباب تشمل (فقدان التواصل وعدم القدرة على الاعتيان ورفض المشاركة والوفاة) كما هو موضّح في الشكل (1). ومن جهة أخرى قمنا بمقابلة 13 مريضاً ضمن العيادات الخاصّة ممّن عانوا تأثيرات عضليّة ضارّة مُحرَّضة بالتداوي بالأتورفاستاتين دون أن تترافق مع ارتفاع قيم CK.
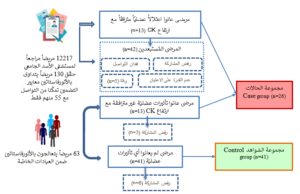
الشكل 1. مخطط مجريات الدراسة وفقاً لتعزيز الإبلاغ عن الدراسات الرصدية في علم الأوبئة STROBE (Strengthening the Reporting of Observational studies in Epidemiology)
وافق 13 مريضاً منهم على المشاركة في الدراسة في حين رفض ثلاثة مرضى. بلغ مجموع المرضى في مجموعة الحالات 26 مريضاً (13 مريضاً منهم لديهم ارتفاع في قيم الـ CK و 13 مريضاً لديهم قيم CK طبيعيّة أو غير محدّدة). مجموعة الشواهد: أجرينا مقابلات مع 63 مريضاً ضمن العيادات الخاصّة، ممن يتداوون بالأتورفاستاتين دون أن يعانوا أي تأثيرات عضليّة ضارّة، وافق 41 مريضاً منهم على المشاركة في الدراسة.
توصيف جمهرة الدراسة
تراوحت أعمار مجمل مرضى الدراسة بين 19 و84 سنة، وبلغ متوسط العمر±الانحراف المعياريSD (54.31 ±13.2) عاماً.وشكّل الذكور نسبة (73%) من جمهرة الدراسة، في حين كانت نسبة (63%) من المرضى المُتضمنين في الدراسة من المدخنين، وبلغ متوسط قيم منسب كتلة الجسم BMI ±الانحراف المعياري (27.8 ±4.35) كغ/م2 ويبيّن الجدول (2) توصيف كل من مجموعتي الحالات والشواهد من حيث العمر والجنس والتدخين وقيم الـ BMI، دون وجود فوارق ذات دلالة إحصائيّة بين المجموعتين (بقيم p value تساوي 0.852 و0.577 و0.087 و 0.346، على الترتيب).
الجدول (2): الخصائص الديموغرافيّة لمرضى الدراسة
| مجموعة الحالات (n=26) | مجموعة الشواهد (n=41) | p-Value | ||
| متوسط العمر ±الانحراف المعياري (عاماً) | (57.8 ±13.3) | (52.1 ±12.7) | 0.852 | |
| الجنس
n (%) |
الذكور | 20 (%76.9) | (%70.7) 29 | 0.577 |
| الإناث | (%23.1) 6 | (%29.3) 12 | ||
| عدد ونسبة المدخنين n (%) | (%50) 13 | (%70.7) 29 | 0.087 | |
| متوسط قيم منسب كتلة الجسم BMI ±الانحراف المعياري ( كغ/م2) | (28.5 ±4.93) | (27.5 ±3.76) | 0.346 | |
تقيّيم تأثير العوامل اللاجينيّة لجمهرة الدراسة في حدوث الاعتلال العضلي المُحرَّض بالأتورفاستاتين
لم نجد علاقة ارتباط ذات دلالة إحصائيّة بين كلّ من العمر والجنس وارتفاع قيم الـ BMI وحدوث التأثيرات العضليّة الضارّة، حيث بلغت قيم p-Values لعلاقة الجنس وقيم الـ BMI بالاستعداد لحدوث التأثيرات العضليّة الضارّة: 0.577 و0.18 ، على الترتيب. في حين برزت نزعة لوجود علاقة إحصائيّة معتد بها لدى دراسة علاقة ارتباط ازدياد العمر مع حدوث التأثيرات العضليّة الضارّة بقيمة p value مساوية لـ 0.087.
تقيّيم جرعة الأتورفاستاتين في حدوث الاعتلال العضلي المُحرّض بالأتورفاستاتين
بلغ متوسط جرعة الستاتين (35.34 ±10.478) مغ في مجموعة الشواهد، مقارنةً بمتوسط جرعة أخفض وقدرها (31.92 ±15.237) مغ في مجموعة الحالات وبفارق غير معتدّ به إحصائيّاً (p=0.28).
تأثير التداخلات الدوائيّة في حدوث الاعتلال العضلي المُحرَّض بالأتورفاستاتين
لدى حساب عدد الأدوية ذات التداخلات المُحتملَة مع الأتورفاستاتين التي يتناولها مرضى الدراسة بلغ متوسط عدد هذه الأدوية (1.08 ±1.164) لدى المرضى الذين عانوا تأثيرات عضليّة ضارّة سواء ترافقت أم لم تترافق مع ارتفاع قي تراكيز إنزيم الـ CK، في حين بلغ المتوسط (0.78 ±0.988( لدى المرضى الذين لم يعانوا تأثيرات عضليّة ضارّة، وذلك بفارق غير معتدّ به إحصائيّاً (p=0.268). بلغت نسبة المرضى المُعالجين بدواء واحد على الأقل يتداخل مع الأتورفاستاتين 50.7% من مرضى الدراسة.
نتائج العمل الجزيئي والتنميط الجيني
بلغ متوسط تركيز الدنا المعزول (60.8 ±24.21) نانوغرام/مكل. ولدى ترحيل منتجات تفاعلات البوليميراز التسلسلي على هلامة الأغاروز للتأكد من نجاح التفاعل ظهر منتج بالطول المتوقّع (328 زوج أساس)، كما هو مبيّن في الشكل (2a). كان كلٌّ من النمط الشائعWild Type (TT) والنمط متخالف الزيجوت (TC) الأعلى تواتراً في جمهرة الدراسة الكليّة وبنسبة بلغت 76.1% 20.9,% على الترتيب، في حين لم يتجاوز تواتر النمط متماثل الزيجوت(CC) Homozygote نسبة 3%. يُمثّل الشكل (b2) الأنماط الجينيّة الثلاثة: النمط الشائع (TT)، النمط متخالف الزيجوت (TC)، النمط متماثل الزيجوت(CC) ، التي أظهرت السَلْسَلَة وجودها في الموقع T521>C في مجموعة الحالات Cases group بعد السَلْسَلَة وفقاً للمُرَئِس التقدّمي، في حين اقتصرت الأنماط الجينيّة على النمطين TT و TC في مجموعة الشواهد controls group، مع غياب تام للنمط الجيني .CC
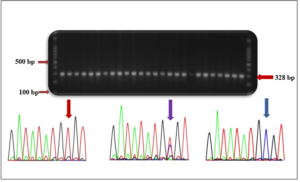
الشكل (2): صورة ممثلة لإحدى هُلامات الأغاروز بتركيز 1.5% بعد ترحيل منتجات تضخيم الـ PCR بالتزامن مع ترحيل سلم عياريّات DNA (A) والمخططات الاستشرابيّة Chromatogram لتَسُلْسُل الدنا في الموقع 521 في جين SLCO1B1 للأنماط الجينيّة الثلاثة: النمط متماثل الزيجوت الشائع Wild Type (TT) والنمط متخالف الزيجوت Heterozygote (TC)، والنمط متماثل الزيجوت Homozygote (CC) (B)
تقيّيم علاقة النمط الجيني بالتأثيرات العضليّة الضارّة المُحرَّضة بالأتورفاستاتين
تبيّن أنّ تواتر النمط الجيني TT كان الأعلى في كلّ من مجموعتي الحالات والشواهد وبنسبة بلغت 65.4% و 82.9%، على الترتيب دون وجود فارق ذي دلالة إحصائيّة (p=0.19)، في حين بلغ تواتر النمط الجيني TC في كلتا المجموعتين 26.9% و 17.1%، على الترتيب وبفارق غير
الجدول (3): تواتر الأنماط الجينيّة والألائل لدى جمهرة الدراسة الكلية وكلّ من مجموعتي الحالات والشواهد
| النمط الجيني | جمهرة الدراسة | مجموعة الحالات | مجموعة الشواهد | P value | |
| TT | العدد (%) | 51 (76.1%) | 17 (65.4%) | 34 (82.9%) | 0.19 |
| TC | العدد (%) | 14 (20.9%) | 7 (26.9%) | 7 (17.1%) | 0.545 |
| CC | العدد (%) | 2 (3%) | 2 (7.7%) | 0 (0%) | 0.026 |
| الألائل | جمهرة الدراسة | مجموعة الحالات | مجموعة الشواهد | P value | |
| T | النسبة المئويّة (%) | 86.6% | 78.8% | 91.5% | 0.032 |
| C | النسبة المئويّة (%) | 13.4% | 21.2% | 8.5% | |
معتدّ به إحصائيّاً (p=0.545)، كما انعدم تواتر النمط الجيني CC في مجموعة الشواهد وبلغ 7.7% في مجموعة الحالات وبفارق معتدّ به إحصائيّاً (p=0.026). كما هو مبيّن في الجدول (3) .
المناقشة
برزت أهميّة دراسة التعدّدات الشكليّة مفردة النيكليوتيد في ـجين SLCO1B1عَقِبَ استعراف دور البروتين OATP1B1 الذي يرمّزه في نقل وإدخال العديد من الرُكازات داخليّة وخارجيّة المنشأ إلى الخلايا الكبديّة. وبناءً على البيّنات التي خَلُصَ إليها العديد من الدراسات السابقة، حَظِيَ التعدّد الشكلي مفرد النيكليوتيد في الموقع 521T>C في جين SLCO1B1 اهتمام الهيئات العالميّة المعنيّة بوضع التوصيات والأدلة الإرشاديّة السريريّة بعلم الجينات الدوائي، نظراً لارتباط هذا التعدّد الشكلي بحدوث الاعتلال العضلي المُحرّض بالستاتينات. حيث أوصى عددٌ من هذه الهيئات بضرورة تنميط جين SLCO1B1 بهدف شخصنة العلاج بالستاتينات ويأتي على رأسها التحالف التنفيذي لعلم الجينات الدوائي السريري CPIC والشبكة الفرنسية لعلم الجينات الدوائي The French National Network of Pharmacogenetics (RNPGX)، وتأتي أهميّة هذه الدراسة في أنّها الأولى من نوعها بحسب علمنا، التي تحرّت تواتر 521T>C في جمهرة سكانيّة من المرضى السوريّين المتداوين بالأتورفاستاتين، وقيّمت ارتباطه بالاعتلال العضلي المُترافق مع المعالجة بالأتورفاستاتين، آخذةً بعين الاعتبار العوامل اللّاجينيّة محتملة التأثير. صُمِمَت دراستنا من نمط حالات – شواهد لتقارن تواتر انتشار التعدّد الشكلي مفرد النيكليوتيد 521T>C وأليل الخطورة C بين المرضى الذين يعانون تأثيرات عضليّة ضارّة مُرافقة للتداوي بالأتورفاستاتين (مجموعة الحالات)، والمرضى الذين لم يعانوا أيّاً من هذه التأثيرات العضليّة (مجموعة الشواهد). وجاءت نتائجنا لتبيّن أن الأليل T هو الأليل الأشيع في جمهرتنا المدروسة وبتواتر قدره 86.6%، في حين بلغ تواتر أليل الخطورة C نسبة 13.4% من مجمل جمهرة الدراسة كاملةً، ويعدّ هذا التواتر منخفضاً نسبيّاً مقارنةً بالتواتر المدروس في البلدان العربيّة حيث بيّنت دراسة الباحث Jithesh وزملاؤه في قطر نسبة تواتر بلغت (32.3%) 28، وقارب التواتر المسجّل في شمال إفريقيا (28%) في دراسة الباحثة Chaouch وزملائها 27، ولدى الإماراتييّن في دراسة Al Mahayri وزملائه (18.7%)29، ولدى السعوديّين في دراسة Alghalyini وزملائه (24%)30، في حين قارب التواتر المُسجّل في دراستنا التواتر الموثّق لدى اللبنانيّين في دراسة الباحثة Zgheib وزملائها والذي بلغ (14.2%)31، وكانت جميع التواترات تفوق التواتر الموثّق لدى الشيشان القاطنين في الأردن والذي لم يتجاوز (8%) في دراسة الباحث Al Eitan وزملائه.32 وقد يُفسّر ذلك باختلاف الجمهرة المدروسة في كلّ من هذه الدراسات حيث تنوعت بين الأصحاء في دراستي Al-Mahayri و Jithesh وزملائهما في قطر والإمارات 28,29، ، في حين كانت الجمهرة المدروسة مرضى فرط كوليسترول الدم، وأطفال مصابين بفقر الدم المنجلي في دراستي Alghalyini و Chaouch وزملائهما في السعوديّة30 وتونس27على الترتيب. وانفردت الدراسة التي أُجريَت في الأردن من قبل الباحث Al Eitan وزملائه 32 باقتصارها على أقليّة إثنيّة (الشيشان). وشملت الدراسة الأحدث (2022) للباحث Jithesh وزملائه 6218 فرداً من مجموعات سكانيّة مختلفة تعود أصولها إلى مجموعات عرقيّة متنوعة28، إضافةً إلى القطريّين. كما قارب التواتر في جمهرة دراستنا التواترات المنشورة في تركيا (12.2%)، وبلغ في بعض البلدان الأوروبيّة مثل ألمانيا (15%) وفق ما وثّقته دراسة Mwinyi وزملاؤه33، بينما كانت التواترات أعلى في كلّ من رومانيا (17.2%) وهنغاريا (18.9%) وفق دراسة Nagy وزملائه16 والتشيك (19.9%) وفق دراسة Hubacek وزملائه 34، و(20.2%) في فنلندا 35. في حين كان تواتر الأليل C في جمهرة دراستنا أعلى بكثير من التواترات المسجّلة لدى القارة الإفريقيّة (3.9%) وفق دراسة Mwinyi وزملائه33، ولم يتجاوز التواتر (1.7%) في الدراسة التي أجراها Cachon وزملاؤه في المكسيك36، وقد يُفسّر ذلك بتباعد التركيبات الجينيّة المؤلفة للشعوب المدروسة عن جمهرتنا. في حين لم نلحظ اختلافات كبيرة لدى مقارنة نتائج دراستنا مع التواتر المدروس في دول شرق آسيا مثل الصين في دراسةQiang Fu وزملائه (16.2%)37 واليابان في دراسةNozawa وزملائه (11%) 38، رغم التباعد عرقياً بين جمهرتنا المدروسة وشعوب الشرق الأقصى. ويبيّن الجدول (4) تواتر الأليل الطافر C لدى بعض الجمهرات السكانيّة والمجموعات العرقيّة.
صنفنا عوامل الخطورة المرتبطة بحدوث الاعتلال العضلي المُحرَّض بالأتورفاستاتين إلى ثلاث فئات: العوامل الجينيّة والعوامل السريريّة والديموغرافية.
علاقة التعدّد الشكلي مفرد النيكليوتيد 521T>C بحدوث الاعتلال العضلي المُحرَّض بالأتورفاستاتين
تحرّت دراستنا فيما إذا كان لوجود الأليل الطافر C في جين SLCO1B1 دوراً في حدوث التأثيرات العضليّة الضارّة للستاتينات، وأظهرت نتائجنا انتشار الأليل الطافر C في مجموعة الحالات بنسبة 21.2% مقارنةً بتواتر لم يتجاوز نسبة .58% في مجموعة الشواهد وبفارق معتدّ به إحصائيّاً (p=0.032). تؤيّد دراستنا بالاعتماد على مقارنة تواتر التعدّد الشكلي مفرد النيكليوتيد 521T>C بين مجموعتي الحالات والشواهد انخراط الأليل C باختطار حدوث الاعتلال العضلي المُحرّض بالأتورفاستاتين، وافقت نتائج بحثنا التحليل التلوي الذي أجراه Turongkaravee وزملاؤه39 في عام 2021 لـ 15 دراسة شملت 4311 فرداً متداوين بستاتينات متنوعة، وأظهر أن المرضى الحاملين للأليل C أكثر عرضة للإصابة بالتأثيرات العضليّة الضارّة المرافقة للستاتينات بمقدار الضعف بحال وجود نسخة واحدة من الأليل C، كما أظهرت الدراسة التي أجراها Hoste وزملاؤه40 في عام 2024 انخراط الأليل C في زيادة الاستعداد للإصابة بالتأثيرات العضليّة الضارّة المرافقة للأتورفاستاتين.
الجدول (4): تواتر الأليل الطافر C لدى بعض الجمهرات السُّكانيّة والمجموعات العرقيّة في المنطقة العربيّة والعالم
| المجموعة العرقيّة | حجم الجمهرة | الجمهرة المدروسة | تواتر الأليل C | P value | المرجع |
| سوريّون | 100 | مرضى فرط شحميات الدم متداوون بالأتورفاستاتين | 13.4% | دراستنا | |
| لبنانيّون | 127 | مرضى اللوكيميا اللمفاوية الحادّة | 14.2% | 0.89 | 31 |
| إمارتيّون | 100 | أصحاء | 18.7% | 0.335 | 29 |
| سعوديّون | 50 | مرضى فرط شحميات الدم | 24% | 0.068 | 30 |
| قطريّون | 6218 | أصحاء من مجموعات سكانيّة متنوعة إضافةً إلى القطريّين | 32.3% | 0.002 | 28 |
| أردنيّون | 166 | الشيشان القاطنون في الأردن | 8% | 0.357 | 32 |
| تونسيّون | 102 | أطفال مصابون بفقر الدم المنجلي | 28% | 0.014 | 27 |
| أتراك | 94 | أصحاء | 12.2% | 1 | 33 |
| ألمانيّون | 300 | أصحاء | 15% | 0.839 | 33 |
| تشيكيّون | 3294 | مرضى متداوون بالستاتينات | 19.9% | 0.253 | 34 |
| رومانيّون | 470 | عيّنات DNAمتنوعة لمرضى من البنك الحيوي | 17.2% | 0.553 | 16 |
| هنغاريّون | 442 | عيّنات DNAمتنوعة لمرضى من البنك الحيوي | 18.9% | 0.335 | 16 |
| فنلنديّون | 468 | أصحاء | 20% | 0.253 | 35 |
| صيننيّون | 363 | مرضى فرط شحميات الدم | 16.2% | 1 | 37 |
| يابانيّون | 267 | أصحاء | 11% | 0.828 | 38 |
| برازيليّون | 143 | مرضى اضطراب الشحميات العائلي | 14% | 1 | 41 |
| مكسيكيّون | 60 | أصحاء | 1.7% | 0.005 | 36 |
| أفارقة | 115 | أصحاء | 3.9% | 0.04 | 33 |
ومن جهة أخرى فإن هذه النتيجة تخالف ما توصّل إليه الباحث Jansen وزملاؤه42 في عام 2023 في دراسته والتي شملت 1136 مريضاً وبيّنت عدم وجود علاقة بين وجود الأليل الطافر C وحدوث التأثيرات العضليّة الضارّة المرافقة لكلّ من الأتورفاستاتين والسيمفاستاتين، وقد يعود سبب هذا الاختلاف لاستخدام الباحث Jansen وزملاؤه لأدوات التحرّي الإلكترونية لاستقصاء المرضى الذين خضعوا لتعديلات في نمط المعالجة إما بتبديل نوع الستاتين أو إيقافه أو تخفيض جرعته دون تضمين المرضى الذين عانوا اعتلالً عضليّاً دون تعديل الأنظمة العلاجيّة في حين قمنا بتضمينهم في دراستنا.
تأثير العوامل الديموغرافيّة في حدوث الاعتلال العضلي المُحرَّض بالأتورفاستاتين
لم يظهر فارق معتد به إحصائيّاً بين أعمار المرضى في كلّ من مجموعتي الحالات والشواهد وهذا يوافق ما أظهره التحليل التلوي الذي أجرته Reith وزملاؤها43 في عام 2022 لـ 19 دراسة شملت 51288 مريضاً متداوٍ بأحد الستاتينات وبيّن عدم وجود تأثير لازدياد العمر في ازدياد حدوث الاعتلال العضلي المُحرَّض بالستاتينات، في حين يخالف ما أظهره التحليل التلوي الذي أجراه Irwin وزملاؤه44 في عام 2018 لـ 135 دراسة شملت 8775 مريضاً متداوٍ بأحد الستاتينات، حيث تبيّن ازدياد الاستعداد لحدوث الاعتلال العضلي بشكل ضئيل مع التقدّم بالعمر. ومن الجدير بالذكر اختفاء هذه العلاقة لدى حذف دراسة واحدة من الدراسات المُتضمنة في التحليل، وبالتالي يُمكن تفسير تصنيف التقدّم بالعمر عامل خطورة للإصابة بالاعتلال العضلي المُحرَّض بالستاتينات بتزايد الإمراضيات وظاهرة تعدّد الأدوية المترافقة مع التقدّم بالعمر، وليس بتغيرات فيزيولوجيّة مرتبطة بالعمر. بلغت نسبة الذكور 76.9% و 70.7% في كلّ من مجموعتي الحالات والشواهد على الترتيب، ولم تبيّن دراستنا وجود فارق معتد به إحصائيّاً بين الجنسين من حيث تواتر حدوث الاعتلال العضلي المُحرَّض بالأتورفاستاتين بين الذكور والإناث، وقد يعود ذلك إلى صغر حجم العينة المدروسة نسبياً وتشكيل الذكور للنسبة الأعلى في كلتا المجموعتين، وهذا يوافق ما أظهرته التحاليل التلوية التي أجراها كل من Irwin وزملائه44 و Nguyen وزملائه45 وReith وزملائها43 من حيث عدم وجود علاقة بين الجنس والاستعداد لحدوث الاعتلال العضلي المُحرَّض بالستاتينات. في حين افترض بعض الدراسات أُهبة أعلى لدى الإناث للإصابة بالاعتلال العضلي المُحرَّض بالستاتينات وقد يعود ذلك إلى الإبلاغ عن الأعراض بصورة أكبر من الذكور إضافةً لامتلاكهن كتلة عضليّة كليّة أقل من الذكور46. يعدّ منسب كتلة الجسم BMI معلَماً لا يُفرِّق بين كتلة الدهون والكتلة العضليّة46 لذلك قد تشير القيم المنخفضة لـ BMI لانخفاضٍ على حساب الكتلة العضليّة، وتُعدّ دراستنا إحدى الدراسات القليلة التي قيّمت تأثير قيم الـ BMI في حدوث الاعتلال العضلي. ولدى تقيّيمنا لتأثير قيم وفئات الـ BMI لم يتبيّن وجود تأثير لأيّ منها في حدوث الاعتلال العضلي، وهذا يوافق ما أظهره تحليلان تلويّان أجراهما كل من Irwin وزملائه44 وReith وزملائها43 وبيّنا عدم وجود تأثير لقيم BMI في زيادة والاستعداد لحدوث الاعتلال العضلي.
تأثير العوامل السريريّة في حدوث الاعتلال العضلي المُحرَّض بالأتورفاستاتين
تتسبب الجرعات الأعلى من الستاتينات بتراكيز مصليّة أعلى من الدواء، وهي بذلك تزيد احتمال حدوث التأثيرات العضليّة الضارّة، إلا أنّ الدراسات التي تحرّت علاقة الجرعة بحدوث الاعتلال العضلي المُحرَّض بالستاتينات لا تزال متضاربة من حيث إمكانيّة تعميم عدّ زيادة الجرعة عاملاً مؤهباً لحدوث الاعتلال العضلي، في حين لم تُظهِر دراستنا تأثيراً لجرعة الأتورفاستاتين في حدوث التأثيرات العضليّة الضارّة وهذا يوافق ما توصّل إليه التحليل التلوي الذي أجراه Irwin وزملاؤه44 والذي بيّن عدم ازدياد الاستعداد للإصابة بالاعتلال العضلي المُحرَّض بالستاتينات مع ازدياد الجرعة العلاجيّة، إلا أنّه يخالف ما أظهره التحليل التلوي الذي أجراه Nguyen وزملاؤه45 وبيّن فيه ارتباط الجرعة بازدياد الاستعداد لحدوث الاعتلال العضلي، إلا أن دلالة هذه العلاقة إحصائيّاً اقتصرت على الجرعات القصوى من السيمفاستاتين (80 مغ) مع غياب هذه الدلالة مع الجرعات الأخفض، مما يشير إلى إمكانيّة أداء جرعة الستاتين دوراً تآزريّاً مع عوامل أخرى مثل العمر ونوع الستاتين والعوامل الجينيّة والتداخلات الدوائيّة من حيث زيادة الاستعداد للإصابة بالاعتلال العضلي المُحرَّض بالستاتينات.
الاستنتاجات
تعدّ دراستنا الأولى في استعراف تواتر التعدّد الشكلي مفرد النيكليوتيد 521T>C لجين SLCO1B1 لدى مرضى سوريّين متداوين بالأتورفاستاتين، وتحديد ارتباط هذا التعدّد الشكلي بالاستعداد لحدوث التأثيرات العضليّة الضارّة المُترافقة مع التداوي بالأتورفاستاتين. أظهرت دراستنا انخراطاً للأليلC في رفع أُهبة الإصابة بالاعتلال العضلي المُحرَّض بالأتورفاستاتين لدى مرضى سوريين متداوين بالأتورفاستاتين وما يترتب على ذلك من تأثيرات سلبية في نوعيّة حياة المرضى المتداوين بهذه الزمرة وتقليل مطاوعتهم للعلاج. كما وضّحت دراستنا عدم وجود علاقة بين العوامل اللاجينيّة مثل (العمر، والجنس، وBMI) والاستعداد للإصابة بالاعتلال العضلي المُحرَّض بالأتورفاستاتين. لم تبدِ جرعة الأتورفاستاتين المُستعمل في المعالجة تأثيراً في حدوث التأثيرات العضليّة الضارّة المُرافقة للستاتينات. بيّنت دراستنا إمكانيّة إجراء التنميط الجيني للمرضى بتقنيات موثوقة بهدف الارتقاء بمستوى الرعاية الصحيّة للمرضى وشخصنة العلاج، وتوصي دراستنا بتحرّي التعدّد الشكلي 521T<C لدى جمهرة أكبر من المرضى بهدف اعتماد التنميط الجيني مشعراً تنبؤي يفيد في أمثَلَة المعالجة بالستاتينات وتقليل التأثيرات الضارّة المُترافقة معها، إضافةً لإجراء دراسة لتحديد الجدوى الاقتصادية لتطبيق التنميط الجيني في الممارسة السريرية قبل الشروع بالمعالجة بالأتورفاستاتين وفق توصيات الهيئات العالميّة المختصة بعلم الجينات الدوائي مثل CPIC و RNPGX، ومدى ملاءمته وفق الظروف والإمكانيّات والتحديات في نظام الرعاية الصحيّة في سورية.
المراجع :1. Buettner C, Davis RB, Leveille SG, Mittleman MA, Mukamal KJ. Prevalence of musculoskeletal pain and statin use. J Gen Intern Med. 2008;23(8):1182-1186. doi:10.1007/s11606-008-0636-7
2. Lewis S, Sellers AD. The Top 50 Drugs Prescribed in the United States . Healthgrades.
3. Melo MS, Balanco L, Branco CC, Mota-Vieira L. Genetic variation in key genes associated with statin therapy in the Azores Islands (Portugal) healthy population. Ann Hum Biol. 2015;42(3):283-289. doi:10.3109/03014460.2014.955056
4. Panus PC, Jobst EE, Masters SB, Katzung B, Tinsley SL, Trevor AJ. Chapter 26. Antihyperlipidemic Drugs. Pharmacology for the Physical Therapist. Published online 2009.
5. Lardizabal JA, Deedwania PC. Benefits of statin therapy and compliance in high risk cardiovascular patients. Vasc Health Risk Manag. 2010;6(1):843-853. doi:10.2147/VHRM.S9474
6. Wang CY, Liu PY, Liao JK. Pleiotropic effects of statin therapy: molecular mechanisms and clinical results. Trends Mol Med. 2008;14(1):37-44. doi:10.1016/j.molmed.2007.11.004
7. Trendelenburg G, Dirnagl U. Glia and Stroke. In: Encyclopedia of Neuroscience. Elsevier; 2009:721-729. doi:10.1016/B978-008045046-9.01763-0
8. Pahan K. Lipid-lowering drugs. Cell Mol Life Sci. 2006;63(10):1165-1178.
9. Taylor BA, Thompson PD. Muscle-related side-effects of statins: From mechanisms to evidence-based solutions. Curr Opin Pediatr. 2015;26(3):221-227. doi:10.1097/MOL.0000000000000174
10. Rosenson RS, Baker SK, Jacobson TA, Kopecky SL, Parker BA. An assessment by the statin muscle safety task force: 2014 update. J Clin Lipidol. 2014;8(3 SUPPL). doi:10.1016/j.jacl.2014.03.004
11. Mancini GBJ, Tashakkor AY, Baker S, et al. Diagnosis, prevention, and management of statin adverse effects and intolerance: Canadian working group consensus update. Canadian Journal of Cardiology. 2013;29(12):1553-1568. doi:10.1016/j.cjca.2013.09.023
12. Ward NC, Watts GF, Eckel RH. Statin Toxicity: Mechanistic Insights and Clinical Implications. Circ Res. 2019;124(2):328-350. doi:10.1161/CIRCRESAHA.118.312782
13. Mancini GBJ, Baker S, Bergeron J, et al. Diagnosis, Prevention, and Management of Statin Adverse Effects and Intolerance: Canadian Consensus Working Group Update (2016). Canadian Journal of Cardiology. 2016;32(7):S35-S65. doi:10.1016/j.cjca.2016.01.003
14. Kitzmiller JP, Mikulik EB, Dauki AM, Murkherjee C, Luzum JA. Pharmacogenomics of statins: Understanding susceptibility to adverse effects. Pharmgenomics Pers Med. 2016;9:97-106. doi:10.2147/PGPM.S86013
15. Bellosta S, Paoletti R, Corsini A. Safety of statins: Focus on clinical pharmacokinetics and drug interactions. 2004;109(23 SUPPL.). doi:10.1161/01.CIR.0000131519.15067.1f
16. Nagy A, Sipeky C, Szalai R, et al. Marked differences in frequencies of statin therapy relevant SLCO1B1 variants and haplotypes between Roma and Hungarian populations. BMC Genet. 2015;16(1). doi:10.1186/s12863-015-0262-4
17. Pasanen MK, Fredrikson H, Neuvonen PJ, Niemi M. Different effects of SLCO1B1 polymorphism on the pharmacokinetics of atorvastatin and rosuvastatin. Clin Pharmacol Ther. 2007;82(6):726-733. doi:10.1038/sj.clpt.6100220
18. Pasanen MK, Neuvonen M, Neuvonen PJ, Niemi M. SLCO1B1 Polymorphism Markedly Affects the Pharmacokinetics of Simvastatin Acid.; 2006.
19. The SEARCH Collaborative Group. SLCO1B1 Variants and Statin-Induced Myopathy — A Genomewide Study . New England Journal of Medicine. 2008;359(8):789-799. doi:10.1056/nejmoa0801936
20. Kellick KA, Bottorff M, Toth PP. A clinician’s guide to statin drug-drug interactions. J Clin Lipidol. 2014;8(3 SUPPL). doi:10.1016/j.jacl.2014.02.010
21. Superko HR, Momary KM, Li Y. Statins Personalized. Medical Clinics of North America. 2012;96(1):123-139. doi:10.1016/j.mcna.2011.11.004
22. Niemi M. Role of OATP transporters in the disposition of drugs. 2007;8(7):787-802. doi:10.2217/14622416.8.7.787
23. Cooper-DeHoff RM, Niemi M, Ramsey LB, et al. The Clinical Pharmacogenetics Implementation Consortium Guideline for SLCO1B1, ABCG2, and CYP2C9 genotypes and Statin-Associated Musculoskeletal Symptoms. Clin Pharmacol Ther. 2022;111(5):1007-1021. doi:10.1002/cpt.2557
24. Oshiro C, Mangravite L, Klein T, Altman R. PharmGKB very important pharmacogene: SLCO1B1. Pharmacogenet Genomics. 2010;20(3):211-216. doi:10.1097/FPC.0b013e328333b99c
25. Ramsey LB, Gong L, Lee S, et al. PharmVar GeneFocus :SLCO1B1. Clin Pharmacol Ther. 2023;113(4):782-793. doi:10.1002/cpt.2705
26. Wilke RA, Ramsey LB, Johnson SG, et al. The clinical pharmacogenomics implementation consortium: CPIC guideline for SLCO1B1 and simvastatin-induced myopathy. Clin Pharmacol Ther. 2012;92(1):112-117. doi:10.1038/clpt.2012.57
27. Chaouch L, Kalai M, Darragi I, et al. Genetic link with cholelithiasis among pediatric SCA Tunisian patients: Examples of UGT1A1, SLCO1A2 and SLCO1B1. Hematology. 2016;21(2):121-125. doi:10.1179/1607845415Y.0000000030
28. Jithesh PV, Abuhaliqa M, Syed N, et al. A population study of clinically actionable genetic variation affecting drug response from the Middle East. NPJ Genom Med. 2022;7(1). doi:10.1038/s41525-022-00281-5
29. Al-Mahayri ZN, Patrinos GP, Wattanapokayakit S, et al. Variation in 100 relevant pharmacogenes among emiratis with insights from understudied populations. Sci Rep. 2020;10(1). doi:10.1038/s41598-020-78231-3
30. Alghalyini B, El Shamieh S, Salami A, Visvikis Siest S, Fakhoury HM, Fakhoury R. Effect of SLCO1B1 gene polymorphisms and Vitamin D on statin-induced myopathy. Drug Metab Pers Ther. 2018;33(1):41-47. doi:10.1515/dmpt-2017-0030
31. Zgheib NK, Akra-Ismail M, Aridi C, et al. Genetic polymorphisms in candidate genes predict increased toxicity with methotrexate therapy in Lebanese children with acute lymphoblastic leukemia. Pharmacogenet Genomics. 2014;24(8):387-396. doi:10.1097/FPC.0000000000000069
32. Al-Eitan LN, Rababa’h DM, Hakooz NM, Alghamdi MA, Dajani RB. Analysis of comprehensive pharmacogenomic profiling of vip variants among the genetically isolated chechen subpopulation from Jordan. Pharmgenomics Pers Med. 2020;13:199-215. doi:10.2147/PGPM.S254677
33. Mwinyi J, Köpke K, Schaefer M, Roots I, Gerloff T. Comparison of SLCO1B1 sequence variability among German, Turkish, and African populations. Eur J Clin Pharmacol. 2008;64(3):257-266. doi:10.1007/s00228-007-0409-y
34. Hubáček JA, Dlouhá D, Adámková V, et al. SLCO1B1 polymorphism is not associated with risk of statin-induced myalgia/myopathy in a Czech population. Medical Science Monitor. 2015;21:1454-1459. doi:10.12659/MSM.893007
35. Pasanen MK, Backman JT, Neuvonen PJ, Niemi M. Frequencies of single nucleotide polymorphisms and haplotypes of organic anion transporting polypeptide 1B1 SLCO1B1 gene in a Finnish population. Eur J Clin Pharmacol. 2006;62(6):409-415. doi:10.1007/s00228-006-0123-1
36. León-Cachón RBR, Bamford AD, Meester I, Barrera-Saldaña HA, Gómez-Silva M, Bustos MFG. The atorvastatin metabolic phenotype shift is influenced by interaction of drug-transporter polymorphisms in Mexican population: results of a randomized trial. Sci Rep. 2020;10(1). doi:10.1038/s41598-020-65843-y
37. Fu Q, Li YP, Gao Y, et al. Lack of association between SLCO1B1 polymorphism and the lipid-lowering effects of atorvastatin and simvastatin in Chinese individuals. Eur J Clin Pharmacol. Published online 2013.
38. NOZAWA T, NAKAJIMA M, TAMAI I, NODA K, JUN-ICHI. Genetic Polymorphisms of Human Organic Anion Transporters OATP-C (SLC21A6) and OATP-B (SLC21A9): Allele Frequencies in the Japanese Population and Functional Analysis NEZU.; 2002. http://jpet.aspetjournals.org
39. Turongkaravee S, Jittikoon J, Lukkunaprasit T, Sangroongruangsri S, Chaikledkaew U, Thakkinstian A. A systematic review and meta-analysis of genotype-based and individualized data analysis of SLCO1B1 gene and statin-induced myopathy. Pharmacogenomics J. 2021;21(3):296-307. doi:10.1038/s41397-021-00208-w
40. Hoste E, Haufroid V, Deldicque L, Balligand JL, Elens L. Atorvastatin-associated myotoxicity: A toxicokinetic review of pharmacogenetic associations to evaluate the feasibility of precision pharmacotherapy. Clin Biochem. 2024;124:110707. doi:10.1016/j.clinbiochem.2024.110707
41. Santos PCJL, Gagliardi ACM, Miname MH, et al. SLCO1B1 haplotypes are not associated with atorvastatin-induced myalgia in Brazilian patients with familial hypercholesterolemia. Eur J Clin Pharmacol. 2012;68(3):273-279. doi:10.1007/s00228-011-1125-1
42. Jansen ME, Rigter T, Fleur TMC, et al. Predictive Value of SLCO1B1 c.521T>C Polymorphism on Observed Changes in the Treatment of 1136 Statin-Users. Genes (Basel). 2023;14(2):456. doi:10.3390/genes14020456
43. Reith C, Baigent C, Blackwell L, et al. Effect of statin therapy on muscle symptoms: an individual participant data meta-analysis of large-scale, randomised, double-blind trials. The Lancet. 2022;400(10355):832-845. doi:10.1016/S0140-6736(22)01545-8
44. Irwin JC, Khalesi S, Fenning AS, Vella RK. The effect of lipophilicity and dose on the frequency of statin-associated muscle symptoms: A systematic review and meta-analysis. Pharmacol Res. 2018;128:264-273. doi:10.1016/j.phrs.2017.09.013
45. Nguyen KA, Li L, Lu D, et al. A comprehensive review and meta-analysis of risk factors for statin-induced myopathy. Eur J Clin Pharmacol. 2018;74(9):1099-1109. doi:10.1007/s00228-018-2482-9
46. Abramowitz MK, Hall CB, Amodu A, Sharma D, Androga L, Hawkins M. Muscle mass, BMI, and mortality among adults in the United States: A population-based cohort study. PLoS One. 2018;13(4):e0194697. doi:10.1371/journal.pone.0194697