نسبة الريزيستين إلى الأديبونيكتين بوصف عاملاً تنبؤياً بمقاومة الأنسولين وعوامل الاختطار القلبية الوعائية الاستقلابية والالتهابية عند عينة من السوريين المصابين بالنمط الثاني من الداء السكري
2022-04-01 | المجلد السادس العدد العاشر - المجلد السادس | مقالات بحثيةرهام المقبل | رويده أبو سمره | يوسف بركات
الملخص
الخلفية: يسهم الداء السكري ومضاعفاته الوعائية القلبية في عدد كبير من حالات المراضة والوفيات عالمياً. ولا تزال الفرضيات التي تفسر الارتباط بين النمط الثاني من هذا الداء وكل من البدانة والمضاعفات القلبية الوعائية غير وافية لتمكننا من تجنب هذه المضاعفات. يفرز النسيج الشحمي العديد من بروتينات الإشعار التي تسهم في ضبط الكثير من النواحي الاستقلابية والالتهابية في الجسم، ومنها الأديبونكتين والريزيستين. إن الأفعال المتعاكسة لهذين الهرمونين تجاه وظائف الأنسولين توحي باحتمال إسهامهما في مقاومة الأنسولين والداء السكري وعوامل اختطار المرض القلبي الإقفاري.
الغرض: استكشاف تبدلات مستويات الأديبونكتين والريزيستين ونسبتهما بين الأصحاء والمصابين بالنمط الثاني من الداء السكري، مع المرض القلبي الإقفاري ودونه؛ ودراسة علاقة هذه المستويات مع بعض عوامل الاختطار القلبية الوعائية ومدى قدرتها التنبؤية بالمرض القلبي الإقفاري.
الطرائق: شملت الدراسة 159 شخصاً سورياً (40 من الأسوياء ظاهرياً عينةً قياسية ضابطة، و60 مصاباً بالنمط الثاني من الداء السكري دون وجود اضطرابات قلبية وعائية و59 من المصابين بالنمط الثاني من الداء السكري مع إصابة بمرض قلبي إقفاري). جرى قياس بعض عوامل الاختطار لدى المشاركين وهي منسب كتلة الجسم وضغط الدم وبروفيل الشحميات ومقاومة الأنسولين HOMA-IR والبروتين الارتكاسيCRP C، فضلاً عن الأديبونكتين والريزيستين. ومن ثم جرت الدراسات الإحصائية باستخدام الإصدار 22 من برمجيات SPSS واعتمدت قيمة P الأقل من 0.05 للاعتداد الإحصائي.
النتائج: انخفضت مستويات الأديبونكتين وارتفعت مستويات كل من الريزيستين ونسبتها إلى الأديبونكتين عند مرضى النمط الثاني من الداء السكري مقارنة بالأسوياء، وكانت هذه التبدلات في أقصاها عند المصابين بمرض القلب الإقفاري من هؤلاء المرضى. وقد ارتبطت هذه التغيرات إيجابياً مع شدة عوامل الاختطار القلبية الوعائية عند المصابين بالمرض القلبي الإقفاري.
الاستنتاج: يمكن أن تكون معايرة مستويات الريزيستين والأديبونكتين والنسبة بينهما عند مرضى السكري المصابين بمرض القلب الإقفاري مهمةً بصفتها واصمات حيوية مفيدة وعوامل تنبؤية وأهداف علاجية في حالات البدانة وما يرافقها من مقاومة للأنسولين والنمط الثاني من الداء السكري ومرض القلب الإقفاري.
كلمات مفتاحية : الأديبونكتين؛ الالتهاب؛ البدانة؛ البروتين الارتكاسي C؛ الريزيستين؛ مرض القلب الإقفاري؛ مقاومة الأنسولين؛ النمط الثاني من الداء السكري.
المقدمة Introduction:
الأمراض القلبية الوعائية هي السبب الأول للوفيات عالمياً، وهي المسؤولة عن ثلث الوفيات العالمية تقريباً.[1-3] والأكثر انتشاراً بين هذه الأمراض هو مرض القلب الإقفاري ischemic heart disease IHD، والذي يدعى أيضاً داء القلب التاجي coronary artery disease CAD والداء القلبي الوعائي العصيدي atherosclerotic cardiovascular disease ACD، وهو أول الأسباب المفردة للوفيات وفقدان سنوات العمر المصححة وفق الإعاقة في العالم. وتعود زيادة هذه الأمراض عالمياً إلى الزيادة العالمية في كل من معدلات التشيّخ وعوامل الاختطار القلبية الوعائية المختلفة.[2-4] والعملية الإمراضية الرئيسة في مرض القلب الإقفاري هي التصلب العصيدي، وهي عبارة عن حدثية التهابية شريانية تترافق مع ترسب الشحميات والتبدلات الاستقلابية الناجمة عن عوامل الاختطار القلبية الوعائية المختلفة والتي تشمل بشكل رئيس الغذاء غير الصحي ونقص النشاط البدني واضطراب شحميات الدم وفرط سكر الدم وارتفاع ضغط الدم والبدانة والعمر وغيرها.[1-7] الداء السكري واحدٌ من أسرع الحالات الطارئة الصحية العالمية انتشاراً في القرن الحادي والعشرين، وقد بلغ عدد المصابين به في العام 2019 في سوريا نحو 1.2 مليون (بمعدل انتشار نحو 12.3%)، ومن المُقدَّر أن يصل عدد المصابين به في العالم عام 2045 إلى 700 مليون. وقد بلغ عدد الوفيات لأسباب تتعلق بالداء السكري في العام 2019 قد يلغ نحو 4.2 مليون عالمياً.[8] ويتميز النمط الثاني من الداء السكري T2DM، والذي يشكل نحو 90% من حالات الداء السكري عالمياً،[8] بآلية إمراضية تبدأ بالبدانة وتبدلات في النسيج الشحمي ووظيفة الخلية الشحمية تترافق مع حدثية التهابية مما يقود إلى مقاومة الأنسولين (تعطيل عمل الأنسولين) والمتلازمة الاستقلابية وتبدلات في وظيفة خلايا بيتا البنكرياسة. وتعمل هذه الآليات المترابطة، ذات التأثير المتبادل، على تسريع حدوث الداء السكري ومضاعفاته المزمنة الاستقلابية والقلبية الوعائية،[3, 8-21] والتي تعتبر مصدر خطورة الداء السكري الذي يزيد اختطار مرض القلب الإقفاري بمقدار 2-3 أضعاف مقارنة بغير السكريين.[8, 21, 22] وبذلك، فالداء السكري هو أحد عوامل اختطار الأمراض القلبية الوعائية الإقفارية المستقلة فضلاً عن ترافقه بعوامل اختطار أخرى ومنها ارتفاع ضغط الدم والحالة الالتهابية والبروفيل الشحمي العصيدي (ارتفاع مستويات كل من الكوليسترول الإجمالي TC وثلاثيات أسيل الغليسيرول TAG وكولسترول البروتينات الشحمية منخفضة الكثافة LDL-C، مع انخفاض كولسترول البروتينات الشحمية مرتفعة الكثافة HDL-C في المصل) الناجم عن مقاومة الأنسولين.[6-9, 14, 18, 21, 22]. البدانة مرض استقلابي متعدد العوامل ينجم عن تآثر عوامل جينية مع عوامل متعلقة بنمط الحياة وتتميز بزيادة مفرطة في دهون الجسم بسبب عدم التوازن بين كمية الطعام ومصروف الطاقة. وهي مشكلة صحة عمومية عالمية تتزايد باضطراد بسبب زيادة نمط الحياة الكسول والغذاء الغني بالشحميات والأطعمة المعلبة.[23-28] وقد أظهرت الدراسات الوبائية خطورة البدانة في تطور أمراض مختلفة مثل مقاومة الأنسولين والمتلازمة الاستقلابية والأمراض القلبية الوعائية والنمط الثاني من الداء السكري وارتفاع ضغط الدم وبعض السرطانات.[5-7, 23-25, 29-32] وتفيد الدراسات بأن البدانة تترافق مع وجود مستويات عالية من السيتوكينات الالتهابية وحالة من الالتهاب المزمن منخفض الدرجة،[5, 7, 9, 12, 21, 33] والبدانة الحشوية خصوصاً والالتهاب داخل النسيج الشحمي الأبيض يمكن أن يكونا خطوة حاسمة في الإسهام في ظهور مقاومة الأنسولين والنمط الثاني من الداء السكري والتصلب العصيدي.[5-7, 9, 18, 21, 29, 31, 33-35] لم يعد مقبولاً النظر إلى النسيج الشحمي على أنّه عضو خامل تقتصر وظيفته على خزن الطاقة، فقد أظهرت الدراسات أنه يُنتج كمية كبيرة من مواد الإشعار الفعالة التي تمارس تأثيرات على عمليات بيولوجية مختلفة بما في ذلك الالتهاب والعمليات الاستقلابية.[31, 36, 37] ويُذكرُ هنا إفراز النسيج الشحمي للعديد من الهرمونات الببتيدية مثل الأديبونيكتين adiponectin والريزيستين resistin، فضلاً عن مجموعة متنوعة من مواد الإشعار البروتينية protein signals التي تدعى مجتمعةً باسم السيتوكينات الشحمية (المحركات الخلوية الشحمية أو الأديبوسيتوكينات adipocytokines)،[38] والتي تشارك جميعها في تنظيم الطاقة واستقلاب الشحميات والسكريات وتنظيم ضغط الدم. وقد رُبطت المحركات الخلوية الشحمية بطريقة تطور مقاومة الأنسولين والحالة الالتهابية والمتلازمة الاستقلابية والنمط الثاني من الداء السكري واضطراب شحميات الدم والأمراض القلبية الوعائية.[5, 7, 9, 13, 18, 21, 29, 31, 34, 36-38]
الأديبونكتين adiponectin
هو أحد المحركات الشحمية الإشعارية وينتجه النسيج الشحمي تحت الجلد بشكل رئيس، ويتكون من 244 حمضاً أمينياً بوزن جزيئي يبلغ نحو 28-30 كيلو دالتون.[31, 39-41] يعمل الأديبونكتين عبر نوعين من المستقبلات هما AdipoR1 وAdipoR2 يوجدان في النسيج الشحمي والكبد بينما يحتوي العضل الهيكلي على النوع الأول فقط.[31, 42, 43] وتتضمن تأثيراته المتنوعة زيادة الحساسية للأنسولين (التأثير المضاد للسكري) وزيادة أكسدة الحموض الدهنية وإنقاص تحرر الغلوكوز من الكبد (نقص استحداث الغلوكوز) وزيادة قبط الغلوكوز وتخليق الدهون فضلاً عن زيادة استقلاب الغلوكوز وأكسدة الحموض الدهنية في العضل الهيكلي.[31, 43-45] وتشير الدراسات إلى أن مستويات الأديبونكتين تنقص عند البدينين ومرضى الاضطرابات الاستقلابية القلبية، وتزداد مع انخفاض الوزن. كما ينقص إفرازه في حالات فرط أنسولين الدم والكرب التأكسدي والالتهاب الملحوظة في البدانة. وكذلك ينقص إفرازه بفعل الوسائط الالتهابية مما يوحي بأن الالتهاب قد يكون العامل الرئيس المسهم في نقص مستويات الأديبونكتين في حالات مقاومة الأنسولين والبدانة.[31, 44-49] كما توحي الدراسات بأن الأديبونكتين قد يمنع التصلب العصيدي من خلال أفعاله المذكورة أعلاه فضلاً عن خفض تشكيل الخلايا الرغوية والحدثية الالتهابية.[31, 50] والمعطيات السابقة كلها توحي بدور للأديبونكتين في إمراضية النمط الثاني من الداء السكري مع احتمال وجود علاقة بين مستوياته وبعض عوامل الاختطار القلبية الوعائية التي تزيد عند مرضى السكري مثل اضطراب الشحميات والحالة الالتهابية ومقاومة الأنسولين وغيرها.
الريزيستين Resistin
هو عديد ببتيد غني بالسيستئين ويتكون من 108 حموض أمينية، ويبلغ وزنه الجزيئي 11.3 كيلو دالتون. ويفرز عند البشر بشكل رئيس من البالعات والوحيدات ضمن النسيج الشحمي ومن طلائع الخلايا الشحمية.[31, 51] إنه يقاوم عمل الأنسولين، ومن هنا جاء اسمه، ويحدث خللا في استتباب الغلوكوز عند الجرذان مما يقود إلى تطور النمط الثاني من الداء السكري. ويبدو أنه الرابط بين البدانة الحشوية ومقاومة الأنسولين.[51-53] منذ اكتشاف الريزيستين في العام 2001، والتعارض موجود حول دوره في الإنسان. ورغم المعطيات القوية عن تأثيراته المرضية في الجرذان، بما في ذلك استتباب الأنسولين ومقاومته[54, 55]، إلا أنه، ولسوء الحظ، لم يكن ممكناً تطبيق هذه المعلومات على البشر لأسباب عدة أهمها المستوى المنخفض من التجانس بين ريزيستين البشر والجرذان والذي لم يتجاوز 35% من الحموض الأمينية[52]. وبقيت العلاقة بين مستوياته المصلية والنمط الثاني من الداء السكري أو مقاومة الأنسولين أو البدانة غير واضحة عند الإنسان كما بقي ارتباط المستويات العالية منه مع هذه الحالات المرضية مثاراً للجدل[31, 51, 56-58]. وقد أكدت المراجعات الحديثة هذا التعارض في نتائج الدراسات على الريزيستين ودوره في التسبب بمقاومة الأنسولين والاستجابة الالتهابية وتحريض تنشيط الخلايا البطانية الوعائية الذي يفضي إلى التصلب العصيدي عند الإنسان.[21, 31, 51, 58-60] كما أظهر قياس مستويات الريزيستين عند المصابين بالبدانة غير الصحية استقلابياً والبدانة السوية استقلابياً نتائج متناقضة، فضلاً عن إظهار الريزيستين كواصم التهابي في حالة التصلب العصيدي.[31, 51, 61-63] توحي المعطيات السابقة كلها بأن فهم العلاقات المحتملة للأديبونكتين والريزستين مع إمراضية البدانة والحالة الالتهابية ومقاومة الأنسولين والنمط الثاني من الداء السكري وعوامل الاختطار القلبية الوعائية ربما يسام في توجيه خطوات الرعاية الصحية نحو التخفيف من عوامل الاختطار هذه والتقليل من انتشار الأمراض القلبية الوعائية، السبب الأول للوفيات والإعاقة عالمياً. وهدف هذا البحث هو محاولة استكشاف علاقة هذين الهرمونين مع مقاومة الأنسولين وعوامل الاختطار القلبية الوعائية الاستقلابية والالتهابية.
المواد والطرائق Materials and Methods
مكان الدراسة وإجازتها والمشاركون: كانت إجازة إجراء هذا البحث من قبل مجلس جامعة دمشق بعد موافقة مجلس كلية الطب البشري التي أجريت اختبارات الدراسة في مخابرها في حين اختير المشاركون في الدراسة عشوائياً من مشفى المواساة الجامعي بدمشق (وزارة التعليم العالي والبحث العلمي) والعيادات الشاملة التابعة لوزارة الصحة. وقد شملت الدراسة 159 شخصاً (79 أنثى و80 ذكراً) تم توزيعهم على ثلاث مجموعات: (1) مجموعة الشواهد: 40 شخصاً من الأسوياء ظاهرياً (19 أنثى و21 ذكراً) والمقاربين لمجموعة المرضى من حيث الجنس والعمر؛ (2) مجموعة مرضى النمط الثاني من الداء السكري غير المصابين بمرض الإقفار القلبي IHD: 60 مريضاً (29 أنثى و31 ذكراً)؛ (3) مجموعة مرضى النمط الثاني من الداء السكري المصابين بمرض الإقفار القلبي: 59 مريضاً (31 أنثى و28 ذكراً). وبالإضافة إلى دراسة هذه المجموعات الثلاث بوصفها مجموعات مستقلة، فقد تضمنت الدراسات الإحصائية في هذا البحث أيضاً اعتبار المجموعتين الثانية والثالثة كمجموعة واحدة سميّت مجموعة المرضى السكريين، وشملت 119 مريضاً بالنمط الثاني من الداء السكري (60 أنثى و59 ذكراً).
معايير الاستبعاد: المرض المزمن مثل القصور الكلوي أو المرض الكبدي، والمشاكل الغدية الصماوية وخصوصاً داء كوشينغ والاضطرابات الدرقية، والسيدات الحوامل والمرضعات، والمرضى الذين يتناولون علاجات دوائية ستيروئيدية قشرية أو مضادات الاكتئاب أو مضادات الالتهاب غير الستيروئيدية، والكحوليون والمدخنون، ووجود قصة انخفاض وزن أكثر من 3 كغ خلال الشهرين الماضيين أو جراحة حديثة أو نظام حمية غذائية خاصة خلال الأشهر الستة الماضية أو تناول معالجة دوائية أو بديلة أو متممة تخفض وزن الجسم أو شحميات الدم أو الأدوية من صنف Thiazolidinediones (TZDs).
نوع الدراسة وزمن إجرائها: الدراسة من نمط الحالة – الشاهد وقد أجريت في الفترة ما بين تشرين الثاني 2018 وآب 2020.
تشخيص الداء السكري والإقفار القلبي: جرى تشخيص الداء السكري استناداً إلى معايير منظمة الصحة العالمية (2019) بحيث يكون الشخص مريضاً بالداء السكري إذا كان سكر الدم الصيامي 126 ملغ/دل فما فوق.[22] أما تشخيص مرض افقفار القلبي فقد اعتمد على معايير منظمة الصحة العالمية التي تتضمن قصة الألم النموذجي وزيادة الواصمات الكيميائية الحيوية القلبية والتبدلات المشخصة في تخطيط القلب الكهربي؛ ويكون التشخيص إيجابياً إذا تحقق اثنين فأكثر من هذه المعايير[64].
قياس ضغط الدم ومنسب كتلة الجسم BMI: جرى الحصول على جميع القياسات وتسجيلها في الصباح بعد صيام 14 ساعة وفقًا للبروتوكولات المنشورة. تم قياس ضغط الدم مرتين (بفاصل 10 دقائق) بوضعية الجلوس بعد راحة لمدة 10-15 دقيقة ومن ثم تسجيل متوسط القياسين. أما منسب كتلة الجسم (كغ/م2) فقد تم حسابه بقسمة وزن الجسم (المسجل على مقياس رقمي مُعاير، مع ارتداء ملابس خفيفة فقط ودون أحذية) على مربع طول الجسم بوضعية الوقوف.
اعتيان الدم والقياسات الكيميائية الحيوية: بعد صيام ليلة كاملة (14 ساعة)، جرى جمع عينات الدم الوريدي في أنابيب مختلفة للحصول على البلازما والمصل. تم فصل العينات إلى أجزاء وتجميدها فوراً عند درجة الحرارة 20 درجة مئوية تحت الصفر حتى موعد إجراء القياسات الكيميائية الحيوية. وقد قيس مستوى الغلوكوز في البلازما (باستخدام EDTA كمضاد تخثر) وشحميات المصل بالطرائق اللونية باستخدام طواقم الكواشف المعروفة. أما الأنسولين فتمت معايرته باستخدام طاقم كواشف بطريقة مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA)، بينما تم قياس CRP بالطريقة العكرية. استُخدم غلوكوز البلازما الصيامي (FPG) ومستويات الأنسولين الصيامي لحساب مدى مقاومة الأنسولين (HOMA-IR) من خلال المعادلة التالية[65]:
HOMA-IR = [الأنسولين (ميكرو وحدة دولية/مل) × غلوكوز البلازما (ملغ/دل) ÷ 405]
جرى حساب مستوى الكوليسترول خارج البروتينات الشحمية مرتفعة الكثافة non-HDL-C (ملغ/دل) بطرح مستوى HDL-C (ملغ/دل) من مستوى كوليسترول المصل الإجمالي TC (ملغ/دل)؛ بينما تم تقدير مستوى كوليسترول البروتينات الشحمية منخفضة الكثافة LDL-C (ملغ/دل) من قيم HDL-C وTC وTAG باستخدام معادلة فريدوالد[66]:
LDL-C = TC ‒ [HDL-C + (TAG ÷ 5)]
الاعتبارات الأخلاقية: تم شرح الدراسة والغرض منها لكل المشاركين الذين أُبلغوا أيضاً بحقهم في إنهاء مشاركتهم في الدراسة في أي وقت دون أي تأثير على رعايتهم الصحية. كما وقّع المشاركون (أو قدموا شفهياً في بعض الأحيان) على الموافقة المستنيرة.
التحليل الإحصائي: أجريت الاختبارات الإحصائية باستخدام الإصدار 22.0 من برمجيات SPSS (شركة IBM Inc.، شيكاغو، الولايات المتحدة الأمريكية). وعُرضت النتائج على شكل متوسط ± انحراف معياري SD. وتمت مقارنة قيم المتوسطات باستخدام اختبار تحليل التباين أحادي الاتجاه (one-way ANOVA) متبوعاً باختبار بونفيروني Bonferroni (لكشف صمود التباين بين المجموعتين الثانية والثالثة) أو اختبار t-test. أما الارتباطات correlations بين المتغيرات فقد قُيّمت باستخدام معامل ارتباط بيرسون متبوعاً بتحليل التحوف الإمدادي الثنائي logistic binary regression. بالإضافة لذلك، فقد استُخرجت مساحة المنطقة الواقعة أسفل منحنى AUC خاصية تشغيل المستقبل ROC. وفي كل الحالات تم اعتبار قيمة P الأقل من 0.05 ذات دلالة إحصائية.
النتائج Results
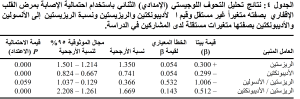
يَعرض الجدول (1) توزع المشاركين على المجموعات الثلاث ومقارنة الأعمار والجنس ومنسب كتلة الجسم فيما بينها. وهو يظهر التوافق بين مجموعات الدراسة الثلاث من حيث العمر والجنس (P > 0.01). أما منسب كتلة الجسم BMI فقد كان مختلفاً بشكل معتد به إحصائيا بين المجموعات الثلاث حيث كانت قيمته أكبر في مجموعتي مرضى السكري (أكبر القيم في مرضى الإقفار القلبي) مقارنة بمجموعة الشواهد (P < 0.001). كما يعرض الجدول (2) المتثابتات السريرية والمخبرية المدروسة في مجموعات الدراسة الثلاث؛ وهو يُظهر أنّ التباينات بين المجموعات في قيم متوسطات جميع المتثابتات، باستثناء نسبة الريزستين إلى الأنسولين، معتدٌّ بها إحصائياً (قيمة P الأقل من 0.001 في كل الحالات). وقد كانت قيم متوسطات ضغط الدم وسكر البلازما والأنسولين ومقاومة الأنسولين (HOMA-IR) والحالة الالتهابية (CRP) والبروفيل الشحمي (باستثناء HDL-C) والريزيستين ونسبته إلى الأديبونكتين هي الأعلى في مجموعة السكريين المصابين بمرض القلب الإقفاري تليها مجموعة السكريين غير المصابين بمرض القلب الإقفاري وأخيراً مجموعة الشواهد صاحبة القيم الأدنى. وقد انقلب ترتيب القيم هذا مع قيم HDL-C والأديبونكتين حيث جاءت القيم الأعلى في مجموعة الشواهد وتناقصت مع وجود النمط الثاني من الداء السكري، وكانت في أدناها في مجموعة السكريين المصابين بمرض القلب الإقفاري (قيمة P أقل من 0.001 في كل الحالات).


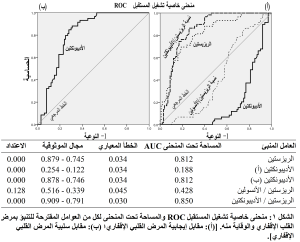
وعند مقارنة المتثابتات المدروسة بين الذكور والإناث ضمن كل مجموعة (المعطيات غير معروضة في الجداول)، انحصر الاعتداد الإحصائي للتباينات في مجموعة الشواهد على الزيادة عند الإناث مقارنة بالذكور في كل من ضغط الدم الإنقباضي (121.6 ± 5.0 مقابل 117.7 ± 5.4 مم زئبقي؛ P < 0.05) والكوليسترول الإجمالي (128.1 ± 14.7 مقابل 112.4 ± 11.8 ملغ/دل؛ P < 0.01) وLDL-C (61.8 ± 15.8 مقابل 40.4 ± 13.0 ملغ/دل؛ P < 0.001) وnon-HDL-C (81.8 ± 17.7 مقابل 59.6 ± 15.0 ملغ/دل؛ P < 0.001) ونسبة TC إلى HDL-C (2.8 ± 0.5 مقابل 2.2 ± 0.4؛ P < 0.001) ونسبة LDL-C إلى HDL-C (1.4 ± 0.5 مقابل 0.8 ± 0.3؛ P < 0.001) ونسبة non-HDL-C إلى HDL-C (1.8 ± 0.5 مقابل 1.2 ± 0.4 ملغ/دل؛ P < 0.001)؛ في حين كانت قيم HDL-C أخفض عند الإناث مقارنة بالذكور في هذه المجموعة (46.3 ± 5.2 مقابل 52.8 ± 4.0 ملغ/دل؛ P < 0.001). أما في مجموعة السكريين غير المصابين بمرض القلب الإقفاري فقد اقتصر تأثير الجنس على الارتفاع المعتد به إحصائياً عند الإناث مقابل الذكور في قيم كل من HDL-C (41.6 ± 3.0 مقابل 37.9 ± 2.9 ملغ/دل؛ P < 0.001) ونسبة الريزستين على الأنسولين (1.10 ± 0.47 مقابل 0.89 ± 0.25؛ P < 0.05)، وعلى الانخفاض المعتد به إحصائياً عند الإناث مقابل الذكور في قيم كل من LDL-C (118.5 ± 14.3 مقابل 127.1 ± 9.2 ملغ/دل؛ P < 0.01) وnon-HDL-C (148.2 ± 16.4 مقابل 157.9 ± 13.0 ملغ/دل؛ P < 0.05) ونسبة TC إلى HDL-C (4.6 ± 0.6 مقابل 5.2 ± 0.7؛ P < 0.01) ونسبة LDL-C إلى HDL-C (2.9 ± 0.5 مقابل 3.4 ± 0.5؛ P < 0.001) ونسبة non-HDL-C إلى HDL-C (3.6 ± 0.6 مقابل 4.2 ± 0.7؛ P < 0.05). وأخيراً، فقد كان الاعتداد الإحصائي للفروق بين المتثابتات في مجموعة السكريين المصابين بمرض القلب الإقفاري مقتصراً على نقص المتثابتات التالية عند الإناث مقابل الذكور: الكوليسترول الإجمالي (227.5 ± 27.9 مقابل 244.0 ± 24.3 ملغ/دل) وLDL-C (158.2 ± 27.6 مقابل 175.0 ± 22.3 ملغ/دل) وnon-HDL-C (191.6 ± 32.3 مقابل 207.7 ± 26.4 ملغ/دل)، وكانت قيمة P < 0.05 في الحالات الثلاث. وفيما يتعلق بنوع معالجة السكري، كان هناك 33 مريضاً يتلقون العلاجات الفموية الخافضة لسكر الدم مقابل 27 مريضاً على الحمية الغذائية فقط في مجموعة السكريين دون مرض القلب الإقفاري. لم يُظهر اختبار t اعتداداً إحصائياً للتباين في المتثابتات المدروسة بين هاتين المجموعتين الفرعيتين إلا في حالة نسبة الريزستين إلى الأنسولين (0.86 ± 0.26 مع العلاجات الفموية مقابل 1.14 ± 0.46 مع الحمية الغذائية؛ P < 0.01). أما في مجموعة السكريين المصابين بمرض القلب الإقفاري (59 مريضاً: 20 مريضاً على الحمية الغذائية و27 مريضاً على العلاجات الفموية الخافضة لسكر الدم و12 مريضاً على الأنسولين) وفي مجموعة السكريين جميعهم (119 مريضاً: 47 مريضاً على الحمية الغذائية و60 مريضاً على العلاجات الفموية الخافضة لسكر الدم و12 مريضاً على الأنسولين) فلم يظهر اختبار الأنوفا أي تأثير معتد به إحصائيا على التباينات في المتثابتات المدروسة وفق نمط العلاج. يعرض الجدول (3) نتائج دراسة الارتباطات [قيم معامل الارتباط وفق بيرسون (r) مع الاعتداد الإحصائي (قيم P)] بين كل من الأديبونكتين والريزيستين ونسبته إلى كل من الأنسولين والريزيستين من جهة، وبين مختلف المتثابتات المتهمة على أنها عوامل اختطار للمرض القلبي الإقفاري في مجموعات الدراسة الثلاث. وكما يظهر في الجدول، لم يكن هناك أي ارتباط معتد به إحصائياً لأي من قيم هذه الهرمونات والنسب مع العمر في المجموعات الثلاث المدروسة. كما يوضح الجدول (3) أنّ قيم الأديبونكتين ارتبطت ارتباطاً إيجابياً معتداً به إحصائياً (P أقل من 0.05 أو 0.01) في المجموعات الثلاث مع قيم HDL-C ذات التأثير الواقي من مرض القلب الإقفاري؛ في حين كان الارتباط سلبياً مع عوامل الاختطار القلبية المختلفة جميعها [ضغط الدم والبدانة (BMI) والسكر الصيامي والأنسولين الصيامي ومقاومة الأنسولين (HOMA-IR) والحالة الالتهابية (CRP) وTAG وTC وLDL-C وnon-HDL-C ونسب المتثابتات الثلاث الأخيرة إلى HDL-C] في مجموعتي الشواهد والسكريين المصابين بمرض الإقفار القلبي (P أقل من 0.01 في كل الحالات). أما في مجموعة السكريين غير المصابين بمرض الإقفار القلبي فقد اقتصر الاعتداد الإحصائي للارتباط السلبي للأديبونكتين مع عوامل الاختطار القلبية على قيم BMI (P أقل من 0.01) وTC وLDL-C وnon-HDL-C (P أقل من 0.05 في كل الحالات) ونسب المتثابتات الثلاث الأخيرة إلى HDL-C (P أقل من 0.01 في كل الحالات) (الجدول 3). أما قيم الريزيستين فقد ارتبطت، وفي المجموعات الثلاث، ارتباطاً سلبياً معتداً به إحصائياً مع قيم HDL-C (P أقل من 0.05 في مجموعة الشواهد و أقل من 0.01 في مجموعتي السكري)، وارتباطاً إيجابياً مع عوامل الاختطار القلبية المختلفة جميعها (P أقل من 0.01 في الحالات جميعها عدا الضغط الانقباضي في مجموعة السكريين مع المرض القلبي الإقفاري والأنسولين ونسب الشحميات الثلاث في مجموعة الشواهد حيث كانت P أقل من 0.05) (الجدول 3). واقتصرت الارتباطات المهمة إحصائياً لقيم نسبة الريزيستين على الأنسولين مع المتثابتات الأخرى في مجموعة الشواهد على الارتباط الإيجابي مع CRP (P أقل من 0.05)، وفي مجموعة السكريين دون المرض القلبي الإقفاري على الارتباط السلبي مع السكر الصيامي والأنسولين الصيامي وHOMA-IR وCRP (P أقل من 0.01 في الحالات جميعها) (الجدول 3). أما في مجموعة السكريين مع المرض القلبي الإقفاري فكان نمط ارتباطات نسبة الريزيستين على الأنسولين مع المتثابتات الأخرى مشابهاً تقريباً لنمط ارتباطات الأديبونكتين (الجدول 3) حيث ارتبطت هذه النسبة إيجابياً مع HDL-C وسلبياً مع ضغط الدم الانقباضي وCRP وTAG وTC وBMI والسكر الصيامي والأنسولين الصيامي وHOMA-IR وLDL-C وnon-HDL-C، ونسبة كل من TC وLDL-C وnon-HDL-C إلى HDL-C (الجدول 3). وارتبطت قيم نسبة الريزيستين إلى الأديبونكتين ارتباطاً سلبياً معتداً به إحصائياً في المجموعات الثلاث مع قيم HDL-C ذات التأثير الواقي من مرض القلب الإقفاري (P أقل من 0.01)؛ في حين كان ارتباطها إيجابياً مع عوامل الاختطار القلبية المختلفة جميعها (ضغط الدم وBMI والسكر الصيامي والأنسولين الصيامي وHOMA-IR وCRP وTAG وTC وLDL-C وnon-HDL-C ونسب المتثابتات الثلاث الأخيرة إلى HDL-C) في المجموعات الثلاث [P أقل من 0.01 في الحالات كلها عدا ضغط الدم الانقباضي وTAG في مجموعة السكريين غير المصابين بمرض الإقفار القلبي (P أقل من 0.05)] (الجدول 3). نتائج تحليل التحوف اللوجيستي (الإمدادي) الثنائي logistic binary regression معروضة في الجدول (4) وتظهر نسبة الأرجحية الأعلى لنسبة الريزستين إلى الأديبونكتين (1.67 = OR) ثم الريزيستين (1.35 = OR) ثم الأديبونكتين (0.74 = OR) (P أقل من 0.001 في الحالات الثلاث) ثم نسبة الريزستين إلى الأنسولين (0.34 = OR؛ 0.059 = P) (الجدول 4). ويعرض الشكل (1) نتائج اختبار منحنى خاصية تشغيل المستقبل ROC وإحصائيات المساحة تحته AUC، ويُظهر القدرة التنبؤية الإيجابية للريزيستين (0.812 = AUC) ونسبة الريزيستين على الأديبونكتين (0.850 = AUC) والقدرة التنبؤية الوقائية للأديبونكتين (0.812 = AUC) (0.001 > P في الحالات كلها). أما نسبة الريزيستين إلى الأنسولين فلم تعط قيمة ذات اعتداد إحصائي.
المناقشة Discussion
جاءت نتائج هذه الدراسة متوافقة مع ما تعرضه النشريات الطبية من ناحية زيادة عوامل الاختطار القلبية الوعائية [زيادة BMI وضغط الدم ومقاومة الأنسولين (HOMA-IR) وCRP وTC وTAG وLDL-C وnon-HDL-C وانخفاض HDL-C] عند مرضى النمط الثاني من الداء السكري مقارنة بالأسوياء؛ وكذلك كانت شدة عوامل الاختطار هذه أعلى عند إصابة هؤلاء المرضى بمرض القلب الإقفاري.[4, 7, 11, 16, 18, 21, 32, 43] وعلى الرغم من المعارف والدراسات حول العلاقة المتبادلة للبدانة ومقاومة الأنسولين والالتهاب والنمط الثاني من الداء السكري، وارتباط هذه الإمراضيات باختطار الأمراض القلبية الوعائية الإقفارية، لا تزال الآلية الحقيقية بعيدة عن الفهم التام مما يستدعي المزيد من البحث فيها.[7, 21, 32]

تلقي نتائج هذه الدراسة الضوء على دور اثنين من الأديبوكينات في إنقاص الاختطار القلبي الوعائي (الأديبونكتين) وزيادته (الريزيستين ونسبته إلى الأديبونكتين) عند عينة من المرضى السوريين المصابين بالنمط الثاني من الداء السكري. لقد ظهر بوضوح في هذه الدراسة أن مستويات الأديبونكتين منخفضة عند السكريين مقارنة بالأسوياء (0.001>P)، كما انخفضت مستوياته أكثر عندما اقترن الداء السكري بمرض القلب الإقفاري (0.001>P) (الجدول 2). كما كانت مستوياته مرتبطة عكسياً مع عوامل الاختطار القلبية الوعائية جميعها [زيادة BMI وضغط الدم ومقاومة الأنسولين (HOMA-IR) وCRP وTC وTAG وLDL-C وnon-HDL-C وانخفاض HDL-C] عند مرضى النمط الثاني من الداء السكري المصابين بمرض القلب الإقفاري (الجدول 3). فضلاً عن ذلك فقد أوحى تحليل التحوف بالقيمة التنبؤية الوقائية لمستويات الأديبونكتين (0.74 = OR؛ 0.001>P) على المرض القلبي الإقفاري (الجدول 4)؛ وهو ما أثبتته المساحة تحت منحنى AUC خاصية تشغيل المستقبل ROC والتي وصلت إلى 0.812 باعتداد أقل من 0.001 (الشكل 1). توحي هذه المعطيات كلها بالدور الذي يؤدّيه نقص الأديبونكتين في إمراضية النمط الثاني من الداء السكري وعلاقة مستوياته مع عوامل الاختطار القلبية الوعائية الرئيسة التي تزيد عند مرضى السكري (مقاومة الأنسولين واضطراب الشحميات والحالة الالتهابية) وقدرته التنبؤية بالمرض القلبي الإقفاري عند عينة المرضى السوريين المدروسة. تتوافق هذه النتائج مع الدراسات والمراجعات التي تثبت ارتباط نقص الأديبونكتين بالبدانة ومقاومة الأنسولين والمتلازمة الاستقلابية والحالة الالتهابية وإمراضية الداء السكري واضطراب شحميات الدم والتصلب العصيدي.[5, 6, 9, 18, 29, 31, 34, 37, 41, 46, 49, 67-69] ويمكن تفسير هذا الدور الذي يؤدّيه نقص الأديبونكتين في إمراضية الداء السكري والمرض القلبي الإقفاري من خلال نقص دوره السوي المتمثل في زيادة قبط الغلوكوز واستهلاكه، وخفض استحداث الغلوكوز، وزيادة تقويض الدهون (تنشيط الأكسدة البيتائية للحموض الدهنية) والوقاية من الاستماتة apoptosis وحماية العضلة القلبية وزيادة الحساسية للأنسولين وخفض الحالة الالتهابية.[31, 35, 36, 39, 41, 46, 50, 67, 68] كما تثبت نتائج الدراسة الحالية دور الريزيستين في إمراضية النمط الثاني من الداء السكري وعلاقة مستوياته مع عوامل الاختطار القلبية الوعائية الرئيسة التي تزيد عند مرضى السكري (مقاومة الأنسولين واضطراب الشحميات والحالة الالتهابية) وقدرته التنبؤية بالمرض القلبي الإقفاري عند عينة المرضى السوريين المدروسة. لقد كان واضحاً ارتفاع قيم الريزيستين عند مرضى السكري وتفاقم هذا الارتفاع عند إصابة هؤلاء المرضى بالمرض الإقفاري القلبي (الجدول 2)، وارتبطت مستوياته إيجابياً مع شدة عوامل اختطار المرض القلبي الإقفاري المختلفة [زيادة BMI وضغط الدم ومقاومة الأنسولين (HOMA-IR) وCRP وTC وTAG وLDL-C وnon-HDL-C وانخفاض HDL-C] عند مرضى النمط الثاني من الداء السكري المصابين بمرض القلب الإقفاري (الجدول 3). ثم جاءت نتائج اختبار التحوف (1.35 = OR؛ 0.001>P) (الجدول 4) والمساحة تحت منحنى خاصية تشغيل المستقبل [0.812=AUC؛ P أقل من 0.001 (الشكل 1)] لتثبت قدرة مستويات الريزيستين على التنبؤ بالمرض القلبي الإقفاري. وقد جاءت هذه النتائج متوافقة مع بعض الدراسات والمراجعات العلمية ومتعارضة مع غيرها، الأمر الذي يعكس التعارض الموجود حتى الآن حول دور الريزيستين في الآليات الإمراضية، وخصوصاً إثبات العلاقة بين مستوياته المرتفعة في المصل عند البشر وكل من البدانة ومقاومة الأنسولين والنمط الثاني من الداء السكري وعوامل الاختطار القلبية الوعائية الشحمية، على الرغم من إثبات أنه يؤثر في استتباب الأنسولين.[31, 51, 56, 61, 62, 70-73] وربما يعود هذا التعارض بين الدراسات إلى صغر حجم عينات الدراسات واختلاف خصائص الجمهرات المدروسة، بما في ذلك الأعراق، واستخدام مقايسات غير معيّرة لقياس مستويات الريزيستين.[70, 74] ولعل الإجماع الأكبر في الدراسات كان متوافقاً مع الدراسة الحالية، وهو ما يتعلق بالدور الذي يؤدّيه الريزيستين في الاستجابة الالتهابية وتنشيطها مما قد يكون نقطة الانطلاق نحو تفسير دوره في الحدثيات المرضية الأخرى كمقاومة الأنسولين وما يتبعها من تغيرات في بروفيل الشحميات والنمط الثاني من الداء السكري وإحداث التصلب العصيدي عبر تغيرات في وظيفة البطانة الوعائية الدموية من خلال زيادة حوادث الانتساخ المؤدية إلى زيادة التعبير عن بعض السيتوكينات ماقبل الالتهابية مثل الإنترلوكينات 1 و6 و12 وعامل نخر الورم-ألفا وغيرها.[5, 9, 11, 14, 18, 31, 32, 37, 38, 51, 55, 60, 61, 63, 70] وأخيراً، فقد أثبتت نتائج الدراسة الحالية، وللمرة الأولى على حد علم المؤلفين، أن أفضل العوامل التنبؤية بالمرض القلب الإقفاري هو نسبة الريزيستين إلى الأديبونكتين التي تزايدت بشكل معتد به إحصائيا من مجموعة الأسوياء إلى المصابين بالنمط الثاني من الداء السكري لتصل إلى القيم الأعلى عند أولئك السكريين المصابين بمرض القلب الإقفاري (الجدول 2). وتناسبت مستوياتها عند مرضى القلب هؤلاء طرداً مع شدة عوامل اختطار المرض القلبي الإقفاري المختلفة [زيادة BMI وضغط الدم ومقاومة الأنسولين (HOMA-IR) وCRP وTC وTAG وLDL-C وnon-HDL-C وانخفاض HDL-C] (الجدول 3) وأعطت أعلى قيمة لنسبة الأرجحية في اختبار التحوف (1.67 = OR؛ 0.001>P) (الجدول 4) وأعلى قيمة للمساحة تحت منحنى خاصية تشغيل المستقبل [0.850=AUC؛ P أقل من 0.001 (الشكل 1)]. وربما تعكس هذه النسبة المحصلة النهائية للأفعال المتعاكسة التي يمارسها هذان الهرمونان على الحالة الاستقلابية والالتهابية لجسم الإنسان. ولعل من المفيد البحث أكثر في هذه النقطة من خلال دراسات أكثر تخصصاً وبحجم عينة أكبر تشمل مختلف درجات البدانة ومقاومة الأنسولين.
الاستنتاج Conclusion
ألقت الدراسة الحالية الضوء على اختلاف مستويات الريزيستين والأديبونكتين والنسبة بينهما بين الأسوياء ومرضى السكري ومرضى القلب الإقفاري السكريين. لقد ارتبطت المستويات المنخفضة من الأديبونكتين والمستويات المرتفعة من الريزيستين مع شدة عوامل الختطار القلبية الوعائية المختلفة عند مرضى السكري المصابين بمرض القلب الإقفاري وأوحت بإمكان استخدامهما واصمين حيويين مفيدين وعاملاً تنبؤياً وهدفاً علاجياً في حالات البدانة وما يرافقها من مقاومة للأنسولين والنمط الثاني من الداء السكري ومرض القلب الإقفاري. كما أوحت الدراسة بالدور التنبؤي الإنذاري المهم لنسبة الريزيستين إلى الأديبونكتين في حالات المرض القلبي الإقفاري، الأمر الذي يحتاج إلى المزيد من الدراسات المتخصصة لإثبات هذه القيمة والإفادة منها في مجال التخفيف من عوامل الاختطار القلبية الوعائية المختلفة.
المراجع :- World Health Organization (WHO) (2017): Cardiovascular diseases (CVDs) key facts. Avai;able at: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds); Access Date: Feb. 2021. May 2017 [cited 2021 Feb.].
- Khan, M.A., et al., Global Epidemiology of Ischemic Heart Disease: Results from the Global Burden of Disease Study. Cureus, 2020. 12(7).
- Benjamin, E.J., et al., Heart disease and stroke Statistics-2019 update a report from the American Heart Association. Circulation, 2019.
- Ralapanawa, U. and R. Sivakanesan, Epidemiology and the Magnitude of Coronary Artery Disease and Acute Coronary Syndrome: A Narrative Review. Journal of Epidemiology and Global Health, 2021.
- Formica, V., et al., Obesity and Common Pathways of Cancer and Cardiovascular Disease. Endocrine and Metabolic Science, 2020: p. 100065.
- Rodriguez, F., et al., Risk factor control across the spectrum of cardiovascular risk: Findings from the Hispanic Community Health Study/Study of Latinos (HCHS/SOL). American Journal of Preventive Cardiology, 2021. 5: p. 100147.
- Bays, H.E., et al., Ten things to know about ten cardiovascular disease risk factors. American Journal of Preventive Cardiology, 2021. 5: p. 100149.
- International Diabetes Federation (2019): IDF diabetes atlas ninth. Dunia: IDF.
- Carrillo, J.L.M., et al. Adipose Tissue and Inflammation. 2018 February 2018 [cited 2021 January]; Available from: https://www.intechopen.com/books/adipose-tissue/adipose-tissue-and-inflammation.
- Fabbrini, E., S. Sullivan, and S. Klein, Obesity and nonalcoholic fatty liver disease: biochemical, metabolic, and clinical implications. Hepatology, 2010. 51(2): p. 679-689.
- Hudish, L.I., J.E. Reusch, and L. Sussel, β cell dysfunction during progression of metabolic syndrome to type 2 diabetes. The Journal of clinical investigation, 2019. 129(9).
- Kahn, C.R., G. Wang, and K.Y. Lee, Altered adipose tissue and adipocyte function in the pathogenesis of metabolic syndrome. Journal of Clinical Investigation, 2019. 129(10): p. 3990-4000.
- Klein, S., T. Wadden, and H.J. Sugerman, AGA technical review on obesity. Gastroenterology, 2002. 123(3): p. 882-932.
- Laaksonen, D., et al., C-reactive protein and the development of the metabolic syndrome and diabetes in middle-aged men. Diabetologia, 2004. 47(8): p. 1403-1410.
- Lorenzo, C., et al., The metabolic syndrome as predictor of type 2 diabetes: the San Antonio heart study. Diabetes care, 2003. 26(11): p. 3153-3159.
- Naveen, L., et al. A STUDY OF ASSOCIATION OF INSULIN RESISTANCE AND CARDIOMETABOLIC RISK FACTORS IN AN ADULT POPULATION WITH TYPE 2 DIABETES MELLITUS. 2014.
- Reaven, G.M., Role of insulin resistance in human disease (syndrome X): an expanded definition. Annual review of medicine, 1993. 44(1): p. 121-131.
- Saltiel, A.R. and J.M. Olefsky, Inflammatory mechanisms linking obesity and metabolic disease. The Journal of clinical investigation, 2017. 127(1): p. 1-4.
- Smith, G.I., B. Mittendorfer, and S. Klein, Metabolically healthy obesity: facts and fantasies. Journal of Clinical Investigation, 2019. 129(10): p. 3978-3989.
- Yadav, D., et al., Metabolic syndrome criteria and its association with type 2 diabetes and cardiovascular diseases. PROGRESS IN NUTRITION, 2020. 22(2): p. 361-369.
- Wondmkun, Y.T., Obesity, Insulin Resistance, and Type 2 Diabetes: Associations and Therapeutic Implications. Diabetes, metabolic syndrome and obesity : targets and therapy, 2020. 13: p. 3611-3616.
- World Health Organization (WHO) (2019): Classification of diabetes mellitus.
- Aboul Enein, B., J. Bernstein, and A. Neary, Dietary transition and obesity in selected Arabic-speaking countries: a review of the current evidence. EMHJ-Eastern Mediterranean Health Journal, 2016. 22(10): p. 763-770.
- Melo, B.F., et al., Evaluating the impact of different hypercaloric diets on weight gain, insulin resistance, glucose intolerance, and its comorbidities in rats. Nutrients, 2019. 11(6): p. 1197.
- Belhayara, M.I., et al., The Metabolic Syndrome: Emerging Novel Insights Regarding the Relationship between the Homeostasis Model Assessment of Insulin Resistance and other Key Predictive Markers in Young Adults of Western Algeria. Nutrients, 2020. 12(3): p. 727.
- Rahim, H.F.A., et al., Non-communicable diseases in the Arab world. The Lancet, 2014. 383(9914): p. 356-367.
- Belahsen, R., Nutrition transition and food sustainability. Proceedings of the Nutrition Society, 2014. 73(3): p. 385-388.
- Julibert, A., et al., Total and subtypes of dietary fat intake and its association with components of the metabolic syndrome in a Mediterranean population at high cardiovascular risk. Nutrients, 2019. 11(7): p. 1493.
- de la Cruz, Q.A.I., J.G.S. Benítez, and E.M. Avila, Adiponectin: Obesity and development of different diseases. Annual Research & Review in Biology, 2017: p. 1-11.
- Valladares, M., G. Corsini, and C. Romero, Association between obesity and ovarian cancer. Revista medica de Chile, 2014. 142(5): p. 593-598.
- Farkhondeh, T., et al., An Overview of the Role of Adipokines in Cardiometabolic Diseases. Molecules, 2020. 25(21): p. 5218.
- Katta, N., et al., Obesity and Coronary Heart Disease: Epidemiology, Pathology, and Coronary Artery Imaging. Current Problems in Cardiology, 2021: p. 100655.
- Dusserre, E., P. Moulin, and H. Vidal, Differences in mRNA expression of the proteins secreted by the adipocytes in human subcutaneous and visceral adipose tissues. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2000. 1500(1): p. 88-96.
- Pittas, A.G., N.A. Joseph, and A.S. Greenberg, Adipocytokines and insulin resistance. The Journal of Clinical Endocrinology & Metabolism, 2004. 89(2): p. 447-452.
- Kennedy, A., et al., Saturated fatty acid-mediated inflammation and insulin resistance in adipose tissue: mechanisms of action and implications. The Journal of nutrition, 2009. 139(1): p. 1-4.
- Zhang, J., et al., Adiponectin, resistin and leptin: possible markers of metabolic syndrome. Endocrinol Metab Syndr, 2015. 4(212): p. 2161-1017.1000212.
- Freitas Lima, L.C., et al., Adipokines, diabetes and atherosclerosis: an inflammatory association. Frontiers in physiology, 2015. 6: p. 304.
- Vrachnis, N., et al., Role of adipokines and other inflammatory mediators in gestational diabetes mellitus and previous gestational diabetes mellitus. International journal of endocrinology, 2012. 2012.
- Yang, J., et al., Serum levels of leptin, adiponectin and resistin in patients with ankylosing spondylitis: A systematic review and meta-analysis. International immunopharmacology, 2017. 52: p. 310-317.
- Del Prete, A., V. Salvi, and S. Sozzani, Adipokines as potential biomarkers in rheumatoid arthritis. Mediators of inflammation, 2014. 2014.
- Yadav, A., et al., Role of leptin and adiponectin in insulin resistance. Clinica chimica acta, 2013. 417: p. 80-84.
- Lago, F., et al., Adipokines as novel modulators of lipid metabolism. Trends in biochemical sciences, 2009. 34(10): p. 500-510.
- Bray, G.A., et al., Overweight and obesity: the pathogenesis of cardiometabolic risk. Clinical cornerstone, 2009. 9(4): p. 30-42.
- Coelho, M., T. Oliveira, and R. Fernandes, Biochemistry of adipose tissue: an endocrine organ. Archives of medical science: AMS, 2013. 9(2): p. 191.
- Lenz, A. and F.B. Diamond Jr, Obesity: the hormonal milieu. Current Opinion in Endocrinology, Diabetes and Obesity, 2008. 15(1): p. 9-20.
- Yamauchi, T. and T. Kadowaki, Adiponectin receptor as a key player in healthy longevity and obesity-related diseases. Cell metabolism, 2013. 17(2): p. 185-196.
- Banks, A.S., et al., SirT1 gain of function increases energy efficiency and prevents diabetes in mice. Cell metabolism, 2008. 8(4): p. 333-341.
- Blüher, M., et al., Adipose tissue selective insulin receptor knockout protects against obesity and obesity-related glucose intolerance. Developmental cell, 2002. 3(1): p. 25-38.
- Coppola, A., et al., Effect of weight loss on coronary circulation and adiponectin levels in obese women. International journal of cardiology, 2009. 134(3): p. 414-416.
- Choi, H.M., H.M. Doss, and K.S. Kim, Multifaceted physiological roles of adiponectin in inflammation and diseases. International journal of molecular sciences, 2020. 21(4): p. 1219.
- Tripathi, D., et al., Resistin in metabolism, inflammation, and disease. The FEBS journal, 2020. 287(15): p. 3141-3149.
- Steppan, C.M., et al., The hormone resistin links obesity to diabetes. Nature, 2001. 409(6818): p. 307-312.
- Kim, K.-H., et al., A cysteine-rich adipose tissue-specific secretory factor inhibits adipocyte differentiation. Journal of Biological Chemistry, 2001. 276(14): p. 11252-11256.
- Rashid, S., Mechanisms by which elevated resistin levels accelerate atherosclerotic cardiovascular disease. Rheumatol Curr Res, 2013. 3(1): p. 1-6.
- Qatanani, M., et al., Macrophage-derived human resistin exacerbates adipose tissue inflammation and insulin resistance in mice. The Journal of clinical investigation, 2009. 119(3): p. 531-539.
- Singh, A.K., et al., Association of resistin with metabolic syndrome in Indian subjects. Metabolic syndrome and related disorders, 2012. 10(4): p. 286-291.
- Onuma, H., et al., Plasma resistin is associated with single nucleotide polymorphisms of a possible resistin receptor, the decorin gene, in the general Japanese population. Diabetes, 2013. 62(2): p. 649-652.
- Das, P., et al., Association of obesity and leptin with insulin resistance in type 2 diabetes mellitus in Indian population. Indian J Physiol Pharmacol, 2013. 57(1): p. 45-50.
- Schwartz, D.R. and M.A. Lazar, Human resistin: found in translation from mouse to man. Trends in Endocrinology & Metabolism, 2011. 22(7): p. 259-265.
- Tsiotra, P.C., et al., High insulin and leptin increase resistin and inflammatory cytokine production from human mononuclear cells. BioMed research international, 2013. 2013.
- Khera, A.V., et al., On-statin resistin, leptin, and risk of recurrent coronary events after hospitalization for an acute coronary syndrome (from the pravastatin or atorvastatin evaluation and infection therapy-thrombolysis in myocardial infarction 22 study). The American journal of cardiology, 2015. 116(5): p. 694-698.
- Bik, W., et al., Adipokines and genetic factors in overweight or obese but metabolically healthy Polish women. Neuroendocrinology Letters, 2010. 31(4): p. 497.
- Telle-Hansen, V., et al., Altered expression of genes involved in lipid metabolism in obese subjects with unfavourable phenotype. Genes & nutrition, 2013. 8(4): p. 425-434.
- Beckett, G., et al., Cardiovascular disorders, in Clinical Biochemistry: Lecture Notes. 2013, John Wiley & Sons, Ltd: West Sussex, UK. p. 160-173.
- Matthews, D., et al., Homeostasis model assessment: insulin resistance and β-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia, 1985. 28(7): p. 412-419.
- Friedewald, W.T., R.I. Levy, and D.S. Fredrickson, Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clinical chemistry, 1972. 18(6): p. 499-502.
- Dıez, J.J. and P. Iglesias, The role of the novel adipocyte-derived hormone adiponectin in human disease. European Journal of endocrinology, 2003. 148(3): p. 293-300.
- Ukkola, O. and M. Santaniemi, Adiponectin: a link between excess adiposity and associated comorbidities? Journal of molecular medicine, 2002. 80(11): p. 696-702.
- Ding, M., et al., Adiponectin in the heart and vascular system. Vitamins & Hormones, 2012. 90: p. 289-319.
- Park, H.K., et al., Linking resistin, inflammation, and cardiometabolic diseases. The Korean journal of internal medicine, 2017. 32(2): p. 239.
- Lee, J.H., et al., Circulating resistin in lean, obese, and insulin-resistant mouse models: lack of association with insulinemia and glycemia. American Journal of Physiology-Endocrinology and Metabolism, 2005. 288(3): p. E625-E632.
- de Courten, B.V., et al., High serum resistin is associated with an increase in adiposity but not a worsening of insulin resistance in Pima Indians. Diabetes, 2004. 53(5): p. 1279-1284.
- Degawa-Yamauchi, M., et al., Serum resistin (FIZZ3) protein is increased in obese humans. The Journal of Clinical Endocrinology & Metabolism, 2003. 88(11): p. 5452-5455.
- Huang, X. and Z. Yang, Resistin’s, obesity and insulin resistance: the continuing disconnect between rodents and humans. Journal of endocrinological investigation, 2016. 39(6): p. 607-615.
تضارب المصالح: يصرح المؤلفون بعدم وجود أي تضارب في المصالح فيما يتعلق بنشر هذه المقالة.