تقصي الفعالية المثبطة لأنزيم الليباز لعدة أنواع من جنسي الزعرور والعليق في سوريا وعزل وتحديد المركب الفعال
2022-04-01 | المجلد السادس العدد العاشر - المجلد السادس | مقالات بحثيةهاني ميخائل سكاف | عصام الشماع | عماد الحداد
الملخص
يعتبر تثبيط بعض الأنزيمات الهاضمة المسؤولة عن هضم الشحوم أحد الاستراتيجيات المتبعة لعلاج مرض البدانة، وذلك عن طريق تقليل امتصاص الشحوم في الأمعاء. في هذه الدراسة، جرى تحديد الفعالية المثبطة لأنزيم الليباز للخلاصات الميتانولية لأوراق نوعين من جنس الزعرور Crataegus هي monogyna، و azarolus var. aronia، وثلاثة أنواع من جنس العليق Rubus هي sanctus، و hedycarpus، و collinus المجموعة في كل من فصلي الربيع والخريف من مناطق مختلفة في الجمهورية العربية السورية. أظهرت الخلاصة الميتانولية للنوع Rubus sanctus التي جمعت في فصل الخريف أعلى فعالية مثبطة لأنزيم الليباز مقارنة بالخلاصات الأخرى. وللتحري عن المركب الفعال المثبط لأنزيم الليباز تم تجزئة الخلاصة الميتانولية إلى ثلاثة خلاصات باستخدام كل من الماء، وخلات الإيتيل، والإيتر كمحلات. ثم تم تجزئة خلاصة خلات الإيتيل والتي أعطت أعلى فعالية مثبطة لأنزيم الليباز مكغ\مل 107=50IC بواسطة جهاز الكروماتوغرافيا التحضيرية. تم تحديد بنية المركب المعزول الذي أظهر أعلى فعالية مضادة لأنزيم الليباز 91=50 IC مكغ\مل باستخدام تقنيات مطياف الكتلة MS والرنين النووي المغناطيسي NMR ليكون هو الكويرسيتين، وهو مركب يعزل لأول مرة من النوعR.sanctus.
كلمات مفتاحية : Rubus العليق , Crataegus الزعرور , lipase ليباز , Quercetinكويرسيتين.
المقدمة Introduction:
البدانة هي عبارة عن تراكم زائد أو غير طبيعي للدسم في الجسم، ينتج عن عدم التوازن بين كمية الطعام المتناولة، والطاقة المصروفة. وهي تزداد بسرعة مقلقة في دول العالم المتطورة، بسبب تناول الوجبات السريعة والمصنعة وانخفاض النشاط البدني. يؤدي تثبيط عمل أنزيم الليباز إلى تثبيط امتصاص الدهون من الجهاز الهضمي، مما يؤدي إلى تقليل كمية الطاقة المكتسبة، ومن ثمّ من اكتساب السعرات الحرارية غير المرغوب فيها (Seyedan et al.) (Spiegelman and Flier) (Roh and Jung) العليق Rubus: يعرف بالانكليزية ب Raspberries أوBlackberries هو عبارة عن شجيرة أو عشبة معمرة، منها متساقطة الأوراق ومنها تقريباً دائمة الخضرة، عادة لها أشواك، بعض الأنواع المزروعة خالية من الأشواك، الساق متشابكة تنمو بسرعة وقد يصل طولها إلى 7 متر. وهو نبات واسع الانتشار عالمي ا،ً بأنواعه البرية والمزروعة، يعتقد أن الموطن الأصلي له هو أرمينيا. وأظهرت الدراسات أن لأوراق نبات العليق الغنية بالمركبات عديدة الفينول (Schulz et al.) فعالية مضادة للأكسدة، ومضادة للسرطان، ومضادة للالتهاب، وخافضة لسكر الدم، وله القدرة على تحسين صحة القلب والشرايين والجهاز العصبي، وتعتبر الألياف الموجودة في النبات أحد العناصر التي يمكن أن يستفيد منها مريض السكري للحد من امتصاص السكريات (Tallini et al.). (Marulanda et al.) الزعرور Crataegus هو عبارة عن أشجار صغيرة أو شجيرات، متساقطة الأوراق، تملك أشواكاً بشكل عام، وهو نبات واسع الانتشار في نصف الكرة الشمالي (آسيا وأوروبا وأمريكا الشمالية)، استُعمل غذاء وفي الطب لمئات السنين في أوروبا والصين. الاسم مشتق من الكلمة اليونانية Kratos والتي تعني صلابة الخشب.(Kumar et al.) وأظهرت الدراسات أن لأوراق نبات الزعرور العديد من التأثيرات الصحية ومنها خافضة للشحوم وخافضة للسكر وخافضة للضغط ومضادة للأكسدة ومضادة لقصور القلب الاحتقاني ومضادة للسرطان (Liu) (Kumar et al.) (Long et al.).(Degenring et al.)
التركيب الكيميائي لنبات العليق Chemical composition of Rubus:
فلافونوئيدات: أهمها الكويرسيتين Quercetin والهيبروزيد Hyperoside والكامفيرول Kaempferol والميرستين Myricitin والكاتشين Catechin والإيبيكاتشين Epicatechin والبروسيانيدين Procyanidin وبعض المركبات المشتقة منها. حموض فينولية: أهمها حمض الغاليك acid Gallic وحمض الإلاجيك Ellagic acid وحمض الكافيئيك Caffeic acid وحمض باراكوماريك p-coumaric acid. تانينات: غالي تانين Gallotannin وإلاغي تانين Ellagitannin. أحماض ثلاثية التربين: مثل حمض الروبوتيك Rubutic acid وحمض الروبينيك Rubinic acid وحمض الأورسوليك Ursolic acid والبيتا أميرين β-amyrin. مكونات أخرى: مكونات طيارة Volatile components وفيتامينات Vitamins ومعادن Minerals وستيروئيدات Steroids وتربينوئيداتTerpenes .(Barnes et al.) (Zia-Ul-Haq et al.) (Rocabado et al.)
التركيب الكيميائي لنبات الزعرور Chemical composition of Crataegus:
أمينات: فينيل إيتيل أمين Phenylethylamine و O – ميتوكسيفين إيتيل أمين O-methoxyphenethylamine وتيرامين Tyramine والكولين Choline والأستيل كولين Acetylcholine ومشتقات البيورين Purine. فلافونوئيدات: مثل الكامبفيرول Kaempferol والكويرسيتين Quercetin والأيزوكويرسيتين Isoquercetin والروتين Rutin والأبيجينين Apigenin والإيبيكاتشين Epicatechin والليتولين Luteolin والروتين Rutin والهيبروزيد Hyperoside والفيتكسين Vitexin والأورينتين Orientin وسيكسانغولارتين Sexangularetin وبعض المركبات المشتقة منها. تانينات: بروأنتوسيانين Proanthocyanins. أحماض فينولية: أهمها حمض الكلوروجينيك Chlorogenic acid وحمض النيوكلوروجينيك Neochlorogenic acid وحمض الغاليك Gallic acid وحمض الهيدروكسي بنزوئيك Hydroxybenzoic acid. أحماض ثلاثية التربين: أهمها حمض الأوليانوليك Oleanolic acid وحمض الأورسوليك Ursolic acid. مكونات أخرى: غليكوزيدات سيانوجينية Cyanogenetic وصابونينات Saponins (Barnes et al.) (Gruenwald et al.) (Edwards et al.) (Liu) (Kumar et al.).
المواد والطرائقMaterials and methods:
المواد Materials:
ميتانول Methanol شركةFluka chemika،Dimethyl sulfoxide (DMSO)، ماء مقطرDistilled water، خلات الإيتيل Ethel acetate شركةMerck، إيتر إيتيلي Diethyl ether شركةMerck، أورليستات Orlistat شركة Sigma Aldrich، أنزيم الليباز Lipase enzyme شركةSigma Aldrich، 4 -نتروفينيل أوكتانوات 4-nitrophenyl octanoate شركةSigma Aldrich.
الأجهزةEquipments:
مطحنة لتنعيم النباتات Molineux، براد لحفظ الخلاصات النباتية Kelvinator، جهاز المطياف الضوئي uv/vis Spectrophotometer من نوع SP-3000 Plus OPTIMA TOKYO,JAPAN، جهاز المبخر الدوار Rotary evaporator من نوع BuchiRotavapor R-205، جهاز الاستشراب السائل التحضيري عالي الأداء Preparative high performance Liquid Chromatography نوع JASCO-LC-1500، جهاز مطيافية الأشعة تحت الحمراء نوع JASCO 300E، مطياف الكتلة Mass Spectroscopy نوع Shimadzu LC2020، جهاز الرنين النووي المغناطيسي Nuclear Magnetic Resonance نوع Avance 400MHz Bruker, Germany.
جمع العينات النباتية Collection of plant material:
تم جمع Collecting أوراق نباتات جنسي العليق Rubus والزعرور Crataegus في شهري نيسان وتشرين الأول، من عدة مناطق في سوريا في الصباح الباكر وهذه المناطق هي: ريف حمص (وادي النضارة)، ريف طرطوس (صافيتا)، ريف اللاذقية (مشقيتا). حيث جُمعت عينات من ثلاثة أنواع من جنس العليق ونوعين من جنس الزعرور وهي:
- Rubus sanctus
- Rubus collinus
- Rubus hedycarpus
- Crataegus monogyna
- Crataegus azarolus var. aronia
وصف الأنواع البناتيةSpecies description:
- Rubus sanctus
عشبة معمرة، دائمة الخضرة تقريبا.ً الساق قوية مقوسة أو مسطحة، حمراء اللون. الأوراق مركبة، محدبة، مسننة بأشكال مختلفة، مقسمة بشكل كفي، الوريقات 3 – 5. الأشواك قوية، واسعة القاعدة، بارزة ومعقوفة. السبلات بيضاء وبرية تنحني بعد الإزهار. البتلات 5 مجعدة، دائرية أو بيضوية، أحيانا مسننة عند القمة، زهرية أو أحيانا بيضاء. الثمار لحمية صغيرة سوداء اللون. (Paul mouterde) (Tutin et al.) (Zia-Ul-Haq et al.)
- Rubus collinus
عشبة معمرة، دائمة الخضرة تقريبا.ً الساق مقوسة، مستلقية أو نصف منتصبة. الأوراق متبادلة، مركبة، صغيرة، الوريقات 3 – 5. الأشواك منحنية بقوة. البتلات 5 صغيرة بيضاوية متطاولة، بيضاء اللون. الثمار صغيرة سوداء عند النضج. (Paul mouterde) (Tutin et al.) (Zia-Ul-Haq et al.)
- Rubus hedycarpus:
عشبة معمرة، دائمة الخضرة تقريبا.ً الساق متفرعة كثيراً، ثخينة، حمراء بنية اللون. الأوراق كفية مركبة، مقسمة إلى 3-5 وريقات مسننة. الأشواك بارزة طويلة وقوية. البتلات5 كبيرة، شبه بيضوية، زهرية أو حمراء اللون. وتدعى الثمار بالتوت وهي عبارة عن قطرات لحمية صغيرة. (Paul mouterde) (Tutin et al.) (Zia-Ul-Haq et al.)
- :Crataegus monogyna
شجرة صغيرة أو شجيرة طولها غالبا 2 – 4 م، متساقطة الأوراق. الأشواك حادة طولها 7 – 20 مم. الأوراق بسيطة بيضوية مقلوبة، متناوبة، لها 3 – 7 فصوص. السبلات 5 ملتحمة، البتلات 5 حرة بيضاء اللون، شبه مدورة. الثمرة حمراء، شبه كروية بقطر 5 – 11 مم، تتضمن نوية وحيدة .(Nabavi et al.) (Albarouki and Peterson)
- : Crataegus azarolus var. aronia
شجرة أو شجيرة طولها غالبا 4 – 8 م، متساقطة الأوراق. الأشواك طويلة حادة طولها 5 – 10 مم. الأوراق بيضوية مقلوبة، لها 3 – 5 فصوص. السبلات 5 ملتحمة، البتلات 5 حرة بيضاء اللون. الثمرة صفراء، شبه كروية بقطر 15 25-مم، تتضمن 2 – 3 نويات) (Albarouki and Peterson) أكساد, 2012.
الاستخلاص Extraction:
حُضّرت خلاصات ميتانولية من أوراق النباتات وفق الخطوات التالية:
-تم وزن مقدار 50 غراماً من مساحيق العينات الجافة، وتم الاستخلاص بالتعطين في 500 مل من الميتانول لمدة 72 ساعة مع التحريك.
-ثم ترشيح الخلاصات وتجفيفها باستخدام المبخر الدوار.
– أعيدت العملية ثلاث مرات. حيث تم الحصول على 10 خلاصات جافة هي:
-خلاصتان للنوع Rubus sanctus المجنية في الربيع وسميت RS.sp، والمجنية في الخريف وسميت RS.au
-خلاصتان للنوع Rubus collinus المجنية في الربيع وسميت RC.sp والمجنية في الخريف وسميت RC.au
-خلاصتان للنوع Rubus hedycarpus المجنية في الربيع وسميت RH.sp، والمجنية في الخريف وسميت RH.au
-خلاصتان للنوع Crataegus monogyna المجنية في الربيع وسميت CM.sp، والمجنية في الخريف وسميتCM.au
-خلاصتان للنوع Crataegus azarolus var.aronia المجنية في الربيع وسميت CA.sp، والمجنية في الخريف وسميت CA.au
-ثم حُضّرت سلسلة تراكيز لكل خلاصة (25 – 50 – 100 -200 – 400) مكغ\مل باستخدام DMSO 10% كمحل.
تحديد الفعالية التثبيطية على أنزيم الليبازDetermination of lipase inhibitory activity:
يحضن 0.5 مل من كل من الخلاصات والأورليستات ضمن التراكيز المختلفة المحضرة (25 – 50 – 100 – 200 – 400) مكغ\مل باستخدام 10% DMSO كمحل، مع 0.5 مل من أنزيم ليباز البنكرياس بتركيز 1 مغ\مل في وقاء فوسفاتي 0.1mM، pH=6.0 لمدة ساعة في حمام مائي بدرجة حرارة 30 درجة مئوية، ضمن وسط وقاء فوسفاتي (0.1mM, pH 7.2, 0.1% Tween 80) حيث تم إضافة 3مل من الوقاء. بعد مضي ساعة يضاف 200 ميكرولتر من الركازة p-nitrophenyl octanoate (pNPO) بتركيز 0.01M في DMSO إلى وسط التفاعل، وينتظر لمدة 5 دقائق، ثم تقاس فعالية الأنزيم بقياس امتصاصية مركب بارانتروفينول p-nitropheol ذو اللون الأصفر المتحرر من التفاعل بواسطة مقياس الطيف الضوئي spectrophotometer عند طول موجة 410 نانومتر. حُضّر الناصع من جميع الكواشف الداخلة في التفاعل الكلي ما عدا الأنزيم استبدل بالوقاء، واستخدم الأورليستات (مثبط معروف لأنزيم الليباز) على أنه شاهد إيجابي. تم تكرار العملية ثلاث مرات. تم حساب النسبة المئوية للتثبيط لكل من الخلاصات والأورليستات من العلاقة التالية:
النسبة المئوية للتثبيط:
(ILipase%)= 100 – ((AsampleA− AsampleB)/(Acontrol – AcontrolB) × 100)
حيث Asample شدة امتصاص العينة
AsampleB شدة امتصاص الناصع للعينة
Acontrol شدة امتصاص الشاهد السلبي
AcontrolB شدة امتصاص الناصع للشاهد السلبي
التثبيط النصفي 50IC: جرى حساب التثبيط النصفي لكل الخلاصات لمعرفة التركيز القادر على تثبيط 50% من أنزيم
ليباز البنكرياس، حيث أنشئت رسوم بيانية بين التركيز)مكغ\مل( و (ILipase%)باستخدام برنامج.Excel 2016
(Roh and Jung) (Gil-Rodríguez and Beresford) (Marmouzi et al.)
الدراسة الإحصائية Statistics study:
جرى حساب المتوسط الحسابي والانحراف المعياري للنتائج باستخدام برنامج.Excel 2016
عزل وتحديد صيغة المركب الفعال:Isolation and structure elucidation of active compound
-الاستشراب السائل التحضيري عالي الأداءHPLC preparative:
أُجري العزل للمركبات الفعالة على جهاز الاستشراب السائل التحضيري عالي الأداء الموجود في مخابر هيئة الطاقة الذرية السورية، باستخدام عمود C18 150 × 21.2 مم، 5 ميكرومتر وباستخدام طور متحرك يتألف من: محل A: ماء، محل B: أسيتونتريل. وبتطبيق سرعة تدفق 2 مل\دقيقة وباستخدام برنامج للفصل متدرج كما يلي: محلB 10% 5 دقائق، 30% 5 – 8 دقائق، 100% 8 – 30 دقيقة، 10% 30 – 37 دقيقة. واستُخدم كاشف UV عند طول موجة 254 نانومتر.
-طيف الأشعة تحت الحمراء:FTIR spectrum
سُجّل طيف الأشعة تحت الحمراء على جهاز Fourier-transform infrared spectroscopy (FTIR) الموجود في مخابر هيئة الطاقة الذرية السورية.
-تحري مطياف الكتلة:Mass spectroscopy Analyzing
تضمنت شروط التحليل الطيفي الكتلي وفق النمط الإيجابي للأيونات +] [M+Hبالارذاذ الكهربائي Electrospray ionization (ESI) جهد كهربائي شعري capillary voltage يبلغ 3500 فولت، درجة حرارة غاز التبخير 230 درجة مئوية، سرعة تدفق الغاز 10 لتر\دقيقة، والإرذاذ nebulizer 50 PSI، وقد تم العمل في مخابر هيئة الطاقة الذرية السورية.
-الرنين النووي المغناطيسي:NMR spectroscopy
جرى تحديد صيغ المركبات الفعالة وتسجيل أطياف الرنين النووي المغناطيسي البروتوني NMR-H1 باستخدام محل DMSO بواسطة جهاز Avance 400MHz الموجود في مخابر هيئة الطاقة الذرية السورية، سُجّلت الانزياحات الكيميائية (δ) في أجزاء المليون (ppm) نسبة إلى إشارة تتراميتيل سيلان (TMS) المستخدم كعياري داخلي. تم توضيح الإشارات من حيث الانزياح الكيميائي مع الاختصارات المناسبة للتعددية، وتم التعبير عنها بالشكل التالي s مفردة، d مزدوجة، و t ثلاثية، وهكذا. تم تسجيل أطياف الرنين النووي المغناطيسي الكربوني 13NMR-C مع أطياف(HMBC)، (HSQC) ،(DEPT)، (COSY) أيضاً بواسطة جهاز Avance 400MHz.
النتائج Results:
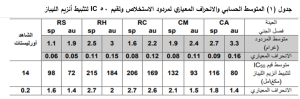
– تراوح مردود الاستخلاص للعينات من 1.1 غرام إلى 3.3 غرام، كما يظهر جدول (1).
– تراوحت قيم 50IC المعبرة عن الفعالية التثبيطية على أنزيم الليباز للخلاصات من 72 إلى 215 مكغ\مل، بينما أعطى الشاهد أورليستات قيمة IC50=14 كغ\مل. كما يظهر جدول (1).
-فصل المركب الفعال وعزله:
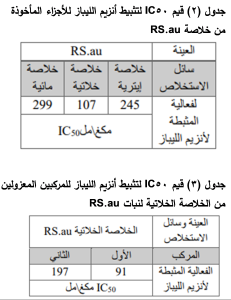
جرى تحضير معلق في كمية كافية من الماء المقطر من الخلاصة المجففة RS.au التي أظهرت أعلى فعالية تثبيطية اتجاه أنزيم الليباز، ليتم الحصول بعدها على خلاصة إيترية وذلك بإضافة الإيتر إلى المعلق المائي، وثم فصل بعضهما عن بعض بواسطة قمع الفصل واستخلاص سائل سائل، حيث تم إعادة العملية ثلاث مرات. وبنفس الطريقة تم الحصول على خلاصة خلاتية باستخدام خلات الإيتيل. وسميت الخلاصة المائية المتبقية بعد الاستخلاص بالإيتر وبالخلات بالخلاصة المائية. رُشّحت الخلاصات وجفّفت باستخدام المبخر الدوار. ثم تم إجراء دراسة لفعالية أجزاء الخلاصة RS.au على تثبيط أنزيم الليباز، ثم تم حساب قيم 50IC لها، جدول (2). ثم تم إجراء مسح للخلاصة الخلاتية من RS.au والتي أظهرت أعلى فعالية تثبيطية اتجاه أنزيم الليباز بواسطة جهاز الاستشراب السائل التحضيري عالي الأداء HPLC-Preparative . أظهر المخطط الكروماتوغرافي وجود قمتين أساسيتين عند 13.5 و 15 دقيقة. تم عزل المركبين تحت القمتين الأساسيتين. ثم أُجريت دراسة لفعالية المركبين المعزولين من الخلاصة الخلاتية من RS.au على تثبيط أنزيم الليباز وحساب قيم 50IC لها، جدول (3).
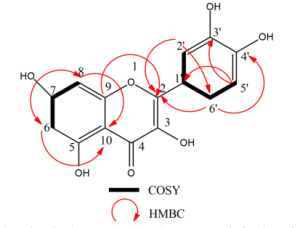
حُدّدت صيغة المركب الأول المعزول من الخلاصة الخلاتية RS.au الذي أظهر أعلى فعالية تثبيطية اتجاه أنزيم الليباز وكانت قيمة التثبيط النصفي له 91=50IC مكغ\مل. وذلك باستخدام جهاز مطياف الكتلة MS وجهاز الأشعة تحت الحمراء FTIR وجهاز طيف الرنين النووي المغناطيسيNMR.
– تحليل بنية المركب المعزول:
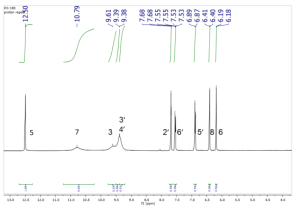
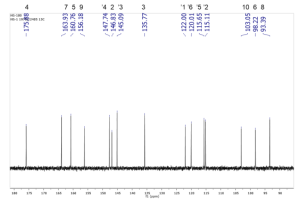
ESI-MS m/z 303 [M+H]+, IR ν [cm-1]: 3407 (-OH), 1663 (-C=O), 1614 (C=C). 1H NMR (400 MHz, DMSO-d6, δ [ppm], J [Hz]): δ 12.50 (s, 1H-OH-5), 10.79 (s, 1H-OH-7), 9.60 (s, 1H-OH-3), 9.38 (s, 2H-OH-3’,4’), 7.68 (d, J = 2.2 Hz, 1H-2’), 7.54 (dd, J = 8.5, 2.2 Hz, 1H-6’), 6.88 (d, J = 8.5 Hz, 1H-5’), 6.40 (d, J = 2.0 Hz, 1H-8), 6.18 (d, J = 2.0 Hz, 1H-6). 13C NMR (101 MHz, DMSO-d6, δ [ppm]): δ 175.88 (C, C-4), 163.93 (C, C-7), 160.76 (C, C-9), 156.18 (C, C-5), 147.74 (C, C-2), 146.83 (C, C-4’), 145.09 (C, C-3’), 135.77 (C, C-3), 122.00 (C, C-1’), 120.01 (CH, C-6’), 115.65 (CH, C-2’), 115.11 (CH, C-5’), 103.05 (C, C-10), 98.22 (CH, C-6), 93.39 (CH, C-8).
المناقشة Discussion :
جرى تعيين الفعالية الحيوية المثبطة لأنزيم الليباز لكل الخلاصات ومقارنتها مع الشاهد أورليستات، كانت أعلى فعالية تثبيطية للخلاصة au مع قيمة تثبيط نصفي 72=50IC مكغ\مل، أما أقل فعالية تثبيطية فقد كانت للخلاصة RH.sp مع قيمة تثبيط نصفي 215=50IC مكغ\مل، بينما أعطى الشاهد Orlistat قيمة تثبيط نصفي 14=50IC مكغ\مل. وقد أظهر النوع C.monogyna الذي لم يدرس تأثيره سابقا على أنزيم الليباز، فعالية تثبيطية في دراستنا على الأنزيم حيث تراوحت قيم التثبيط النصفي 50IC بين 93 و 132 مكغ\مل باختلاف وقت جمع النبات. وقد تبين أن الخلاصات التي جمعت في فصل الخريف في سوريا كان لها فعالية تثبيطية أعلى على أنزيم الليباز بالمقارنة مع الخلاصات التي جمعت في فصل الربيع، وذلك قد يعود إلى اختلاف التركيب الكيميائي ونوع وتركيز المركبات المسؤولة عن الفعالية باختلاف وقت جمع النباتات، حيث أظهرت دراسات سابقة أن المحتوى الفينولي يكون أعلى بشكل عام في فصل الصيف وفصل الخريف مقارنة مع فصل الربيع (Pavlovic et al.) (Liu et al.). ولم يوجد أي دراسات سابقة على تأثير وقت جمع النبات على الفعالية التثبيطية على أنزيم الليباز. وبالمقارنة مع الدراسات المرجعية تقاربت نتائج دراستنا مع دراسة أجريت على خلاصتين مائية-إيتانولية 50 % وهيكسانية للنوع C.azarolus في فلسطين حيث وجد أن قيم 50IC كانت 83.2 و 40.7 مكغ\مل بالترتيب. (Jaradat et al) وبالمقارنة مع دراسة أجريت في إيطاليا على خلاصة إيتانولية 70 % للنوع Rubus caesius وجد أن قيمة 50IC كانت 9.38 مكغ\مل، وقد يعود هذا الاختلاف عن دراستنا إلى اختلاف النوع النباتي المدروس واختلاف المنطقة الجغرافية مما يؤثر على التركيب الكيميائي للنبات. (Conforti et al)، تم الحصول على المركب المعزول على شكل بودرة صفراء اللون. أظهرت المعطيات التحليلية وبالمقارنة مع الدراسات أن له بنية فلافونوئيدية (Sambandam et al.) (Hu et al.) (Huang et al.). أظهر مطياف الكتلة أن الكتلة الجزيئية للمركب هي 302 غرام\مول وهذا يطابق الصيغة العامة C15H10O7. أظهر طيف الأشعة تحت الحمراء حزمة امتصاص عريضة عند 3407 cm-1 تعود إلى زمر OH العطرية في المركب، وحزمة امتصاص عند 1663 cm-1 تعود إلى زمرة الكيتون، وحزمة امتصاص عند 1614 cm-1 تعود إلى زمر C=C العطرية. أظهر طيف الرنين النووي المغناطيسي الكربوني 13C-NMR ذرة كربون في المركب كما يُظهر الشكل (3). وأظهر طيف 5DEPT زمر ميتين. و 10 ذرات كربون رابعية. وأظهر طيف الرنين النووي المغناطيسي البروتوني 1H-NMR 5 بروتونات عطرية كما يُظهر الشكل (2). تم تأكيد توضع البروتونات العطرية عند δ 7.68 ppm و δ 7.54 ppm على ذرات الكربون C2’ و C6’ بواسطة قيمة ثابت التزاوج ميتا 2.2Hz و الترابط في طيف HMBC . تم تأكيد توضع البروتونات العطرية عند δ 6.88 ppm و δ 7.54 ppm على ذرات الكربون C5’ و C6’ بواسطة 7 قيمة ثابت التزاوج 8.5Hz والترابط في طيف COSY . أظهر كل من طيف HMBC وطيف HSQC ترابطا بين البروتونات عند δ 6.18 ppm و δ 6.40 ppm و δ 6.88 ppm و δ 7.68 ppm و δ 7.54 ppm مع ذرات الكربون عند δ 98.22 ppm ((C6، و δ 93.39 ppm (C8)، وδ 115.65 ppm (C5′) و δ 115.11 ppm (’C2) وδ 120.01 ppm (’(C6 بالترتيب. احتوت الحلقة العطرية A على ذرتي هيدروجين لمجموعات هيدروكسيل لها إشارات عطرية في طيف البروتون عند δ 12.50 ppm للموقع C5 وعند δ 10.79 ppm للموقع C7، واحتوت الحلقة العطرية B على ذرتي هيدروجين لمجموعات هيدروكسيل لها إشارات عطرية في طيف البروتون عند δ 9.38 ppm للموقع `C3 وللموقع `C4. ليكون المركب هو الكويرسيتين كما هو موضح في الشكل (1)، وهو مركب له فعالية معروفة سابقاً على أنزيم الليباز (Martinez-Gonzalez et al.) ولكنه يعزل لأول مرة من النوع R.sanctus.
الاستنتاجات :Conclusions
أظهرت نتائج الدراسة أن كل من نباتي الزعرور والعليق الموجودة في سوريا كان لهما فعالية تثبيطية على أنزيم الليباز، لذلك من الممكن استخدام خلاصاتهما في معالجة البدانة والحد من زيادة الوزن كبدائل للمعالجات الموجودة في الأسواق. بينت الدراسة تأثير الوقت الذي جمع فيه النبات على الفعالية التثبيطية على أنزيم الليباز، وهذا التأثير لم يدرس سابقاً، حيث كانت الفعالية أعلى لخلاصات النباتين التي جمعت في فصل الخريف مقارنة مع تلك التي جمعت في فصل الربيع. بينت نتائج الدراسة أن النوع Rubus sanctus أعطى أعلى فعالية تثبيطية على أنزيم الليباز مقارنة بالأنواع الأخرى. كما تبين أن النوع Crataegus monogyna لم يدرس تأثيره سابقا على أنزيم الليباز، وقد ظهر في دراستنا فعالية تثبيطية على الأنزيم حيث أعطى قيم 50IC تراوحت بين 93 و 132 مكغ\مل. وقد تبين أن بينة المركب الذي عزل من النوع Rubus sanctus والذي أظهر أعلى فعالية تثبيطية على أنزيم الليباز تعود إلى الكويرسيتين الذي ينتمي إلى فئة الفلافونوئيدات، وهو مركب معروف بفعاليته المثبطة لأنزيم الليباز ولكنه يعزل لأول مرة من النوع Rubus sanctus.
المراجع :Albarouki, Emad, and Angela Peterson. “Molecular and Morphological Characterization of Crataegus L. Species (Rosaceae) in Southern Syria.” Botanical Journal of the Linnean Society, vol. 153, 2007, p. 8.
Barnes, Joanne, et al. “Herbal Medicines.” Pharmaceutical Press, 2007, doi:10.4032/9789814303422.
Conforti, Filomena, et al. “Wild Mediterranean Dietary Plants as Inhibitors of Pancreatic Lipase.” Phytotherapy Research, vol. 26, no. 4, 2012, pp. 600–04, doi:10.1002/ptr.3603.
“Crataegus Azarolus L. Var. Aronia L.” أطلس
النباتات الطبية والعطرية في الوطن العربي,
2012, pp. 495–97.
Degenring, F. H., et al. “A Randomised Double Blind Placebo Controlled Clinical Trial of a Standardised Extract of Fresh Crataegus Berries (Crataegisan®) in the Treatment of Patients with Congestive Heart Failure NYHA II.” Phytomedicine, vol. 10, no. 5, 2003, pp. 363–69, doi:10.1078/0944-7113-00312.
Edwards, Jennifer E., et al. “A Review of the
9
Chemistry of the Genus Crataegus.” Phytochemistry, vol. 79, Elsevier Ltd, 2012, pp. 5–26, doi:10.1016/j.phytochem.2012.04.006.
Gil-Rodríguez, Ana María, and Thomas P. Beresford. “Lipase Inhibitory Activity Assay for Fermented Milk.” MethodsX, vol. 7, Elsevier B.V., 2020, p. 100999, doi:10.1016/j.mex.2020.100999.
Gruenwald, Joerg, et al. “PDR for Herbal Medicines.” Medical Economics Company, Inc, 2000.
Hu, Hao-bin, et al. “Analysis of Flavonoids from Leaves of Acanthopanax Brachypus Harms Hao-Bin.” J. Chil. Chem. Soc., vol. 1, 2013, pp. 1549–52.
Huang, Weifeng, et al. “Quercetin – A Flavonoid Compound from Sarcopyramis Bodinieri Var Delicate with Potential Apoptotic Activity in HepG2 Liver Cancer Cells.” Tropical Journal of Pharmaceutical Research, vol. 12, no. 4, 2013, pp. 529–33, doi:10.4314/tjpr.v12i4.13.
Jaradat, Nidal, et al. “Anti-Lipase Potential of the Organic and Aqueous Extracts of Ten Traditional Edible and Medicinal Plants in Palestine; a Comparison Study with Orlistat Nidal.” Medicines, vol. 4, no. 89, 2017, p. 13.
Kumar, Dinesh, et al. “The Genus Crataegus: Chemical and Pharmacological Perspectives.” Revista Brasileira de Farmacognosia Brazilian Journal of Pharmacognosy, vol. 22(5), no. 0102-695X, 2012, pp. 1187–200.
Liu, Pengzhan. Composition of Hawthorn (Crataegus Spp.) Fruits and Leaves and Emblic Leafflower (Phyllanthus Emblica) Fruits. 2012.
—. “Phenolic Compounds in Hawthorn (Crataegus Grayana) Fruits and Leaves and Changes during Fruit Ripening.” Journal of Agricultural and Food Chemistry, vol. 59, no. 20, 2011, pp. 11141–49, doi:10.1021/jf202465u.
Long, S. R., et al. “Effect of Hawthorn (Crataegus Oxycantha) Crude Extract and Chromatographic Fractions on Multiple Activities in a Cultured Cardiomyocyte Assay.” Phytomedicine, vol. 13, no. 9–10, 2006, pp. 643–50, doi:10.1016/j.phymed.2006.01.005.
Marmouzi, Ilias, et al. “Isolation of Secondary Metabolites from the Mediterranean Sponge Species; Hemimycale Columella and Its Biological Properties.” SN Applied Sciences, vol. 3, no. 2, Springer International Publishing, 2021, doi:10.1007/s42452-020-04052-8.
Martinez-Gonzalez, Alejandra I., et al. “In Vitro Inhibition of Pancreatic Lipase by Polyphenols: A Kinetic, Fluorescence Spectroscopy and Molecular Docking Study.” Food Technology and Biotechnology, vol. 55, no. 4, 2017, pp. 519–30, doi:10.17113/ftb.55.04.17.5138.
Marulanda, Marta Leonor, et al. “Genetic Diversity of Wild and Cultivated Rubus Species in Colombia Using AFLP and SSR Markers.” Crop Breeding and Applied Biotechnology, vol. 7, no. 3, 2007, pp. 242–52, doi:10.12702/1984-7033.v07n03a03.
Nabavi, Seyed Fazel, et al. “Polyphenolic Composition of Crataegus Monogyna Jacq.: From Chemistry to Medical Applications.” Nutrients, vol. 7, no. 9, 2015, pp. 7708–28, doi:10.3390/nu7095361.
Paul mouterde, S. J. Nouvelle Flore Du Liban et de La Syrie. 1970.
Pavlovic, Jovana, et al. “Variation in the Phenolic Compounds Profi Le and Antioxidant Activity in Different Parts of Hawthorn (Crataegus Pentagyna Willd.) during Harvest Periods.” Polish Journal of Food and Nutrition Sciences, vol. 69, no. 4, 2019, pp. 367–78, doi:10.31883/pjfns/112019.
Rocabado, Guillermo Omar, et al. “Rubus – A Review of Its Phytochemical and Pharmacological Profile.” Natural Product Communications, vol. 3, no. 3, 2008, pp. 423–36, doi:10.1177/1934578×0800300319.
Roh, Changhyun, and Uhee Jung. “Screening of Crude Plant Extracts with Anti-Obesity Activity.” International Journal of Molecular Sciences, vol. 13, no. 2, 2012, pp. 1710–19, doi:10.3390/ijms13021710.
Sambandam, Bharathi, et al. “Extraction and Isolation of Flavonoid Quercetin from the Leaves of Trigonella Foenum-Graecum and Their Anti-Oxidant Activity.” International Journal of Pharmacy and Pharmaceutical Sciences, vol. 8, no. 6, 2016, pp. 120–24.
Schulz, Mayara, et al. “Blackberry (Rubus Ulmifolius Schott): Chemical Composition, Phenolic Compounds and Antioxidant Capacity in Two Edible Stages.” Food Research International, vol. 122, no. January, Elsevier, 2019, pp. 627–34,
10
doi:10.1016/j.foodres.2019.01.034.
Seyedan, Atefehalsadat, et al. “Medicinal Plants and Their Inhibitory Activities against Pancreatic Lipase: A Review.” Evidence-Based Complementary and Alternative Medicine, vol. 2015, no. 973143, 2015, p. 13, doi:10.1155/2015/973143.
Spiegelman, Bruce M., and Jeffrey S. Flier. “Obesity and the Regulation Review of Energy Balance Total Fast of Approximately 150 Days! This Impressive Energy Reserve Is Due Both to the High Energy Content of Triglycerides versus Polysaccharides, and the Fact.” Cell, vol. 104, 2001, pp. 531–43.
Tallini, Luciana R., et al. “Analysis of Flavonoids in Rubus Erythrocladus and Morus Nigra Leaves Extracts by Liquid Chromatography and Capillary Electrophoresis.” Brazilian Journal of Pharmacognosy, vol. 25, no. 3, Sociedade Brasileira de Farmacognosia, 2015, pp. 219–27, doi:10.1016/j.bjp.2015.04.003.
Tutin, T. G., et al. “Flora Europaea: Volume 2 Rosaceae to Umbelliferae.” CAMBRIDGE UNIVERSITY PRESS, vol. 2, 1968, doi:10.1038/183721c0.
Zia-Ul-Haq, Muhammad, et al. “Rubus Fruticosus L.: Constituents, Biological Activities and Health Related Uses.” Molecules, vol. 19, no. 8, 2014, pp. 10998–1029, doi:10.3390/molecules190810998.