تأثير التّعدّد الشّكلي مفرد النوكليوتيد -1639G>A VKORC1 في الأهبة للانصمام الخثاريّ الوريديّ لدى جمهرة من السّوريّين: تأثير وقائي أم عامل اختطار؟
2022-04-01 | المجلد السادس العدد العاشر - المجلد السادس | مقالات بحثيةيارا الطويل | وئام الديبان | لمى يوسف
الملخص
يُبدّل التّعدّد الشّكليّ مفرد النوكليوتيد (SNP) Single Nucleotide Polymorphism في منطقة المحضّض -1639G>A من مستويات التّعبير الجينيّ عن الإنزيم معقّد الوحيدة 1 المرجع لإيبوكسيد فيتامين K vitamin K epoxide reductase complex subunit 1 (VKORC1) مؤديّاً إلى نقصان التّفعيل المعتمد على فيتامين K لعوامل التّخثر II وVII وIX وX. هدفت دراستنا الرّصديّة من نمط حالة-شاهد إلى استقصاء العلاقة بين التّعدّد الشّكلي -1639G>A والانصمام الخثاريّ الوريديّ مجهول السّبب. شملت الدّراسة 54 مريضاً، و44 فرداً من الشّواهد الأصحّاء ظاهريّاً. أُجري التّنميط الجينيّ بالسّلسلة المعياريّة لمنتجات تفاعل البوليميراز التّسلسليّ PCR باستعمال مشرعين نوعيّين. على الرغم من التّواترات المتقاربة للأليل المستقصى عنه -1639A بين مرضى الانصمام الخثاريّ الوريديّ (%45.37) والشّواهد (%50)، إلا أنّ تواترات الأنماط الجينيّة GG و GAوAA توزّعت توزعاً غير متساوٍ بين مجموعتي الدّراسة (P=0.046). حقّقت الأنماط الجينيّة الحاوية على الأليل الطّافر A (GA وAA) تواتراً أعلى لدى الشّواهد (%93.2) مقارنة بالمرضى (%77.8)، وبفارق معتدٍّ به إحصائيّاً (P=0.048, OR=0.256, 95% CI=0.074-0.925). تبيّن نتائجنا تواتراً مرتفعاً للأليل -1639A لدى جمهرة الدّراسة وتراجعاً بنسبة 75% في اختطار حدوث الانصمام الخثاريّ لدى حاملي الأليل A، وتثبت الدّراسة أهمّية الأليل 1639G– كواصم جينيّ للانصمام الخثاري الوريدي.
كلمات مفتاحية : الانصمام الخثاريّ الوريديّ، الإنزيم معقد الوحيد 1 المرجع لإيبوكسيد فيتامين K، التّعدّد الشّكلي مفرد النوكليوتيد -1639G>A، تواتر، سوريون.
المقدمة Introduction:
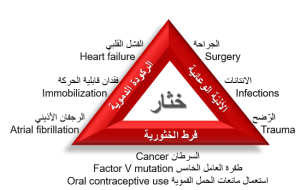
يضمّ الانصمام الخثاريّ الوريديّ Venous (VTE) Thromboembolism حالتين مرضيتين رئيسيّتين هما الخثار الوريديّ العميق Deep Vein (DVT) Thrombosis والصّمّة الرّئوية Pulmonary (PE) Embolism ، ويعدّ داءً شائع الانتشار ومميتاً في بعض الأحيان، فضلاً عن العبء الاجتماعيّ والاقتصاديّ الذي يثقل به كاهل الأفراد والمؤسّسات الصّحية. يُقدّر معدل وقوعه incidence عالمياً بما يقارب 1/1000، ويزداد إلى 7 حالات لكل 1000 فردٍ تجاوز منتصف العمر.(1)،(2) توصي الدّلائل الإرشاديّة الصّادرة عن الجمعيّة الأمريكيّة لأمراض الدّم American Society of Hematology (ASH)، بما في ذلك دليلها الإرشاديّ الأحدث والصّادر في عام 2020، بمضادّات التّخثربصفته رُكناً أساسيّاً في معالجة معظم الحالات، باستثناء الطّارئة منها والتي تتطلّب تداخلاً جراحيّاً أو استعمال حالّات الخثرة Thrombolytics . تختلف مدّة العلاج الموصى بها تبعاً لمسبّب الدّاء(3) حيث يُصنّف الانصمام الخثاريّ وفقاً لمسبّبات حدوثه إلى 1) انصمام ثانويّ أو مُحرَّضٍ provoked VTE، تسبّبه عوامل عدّة أهمّها العمليّات الجراحيّة الكبرى والخباثات والأدواء الطّبية الحادّة (مثل الإنتانات والفشل القلبيّ) والتعرّض للرّضح trauma والحمل واستعمال مانعات الحمل الفمويّة؛ و 2) انصمام غير مُحرَّضٍ مجهولُ السّبب idiopathic unprovoked VTE، حيث لا يكون سبب الانصمام جليّاً، إلا أنّ المريض قد يملك عوامل تزيد من احتمالات الإصابة دون أن تكون مُحرّضات مباشرة. يُعد التّقدم في العمر والتّدخين وفرط التّوتر الشّرياني والبدانة بعضاً من أهم هذه العوامل. وبالمقابل، فإن من الجدير بالذّكر أن الدّلائل الإرشاديّة الأوروبيّة (الصّادرة عن الجمعيّة الأوروبيّة لطب القلب) لا تشجّع استعمال مصطلحَي “محرّض وغير محرّض” في توصيف الانصمام الخثاريّ، وتعتمد بديلاً عنهما عوامل الاختطار من عدمه وتصنّفها إلى دائمة أو مؤقتّة.(4)،(5) تسهم العوامل المحرّضة للـ VTE في الفيزيولوجيا المرضيّة بواحدة أو أكثر من الآليات الثّلاث التي وصفها العالم فيرخوف Virchow في ثالوثه الشّهير، وهي الرّكودة الدّموية والأذيّة الوعائيّة وفرط الخثوريّة الوراثيّ أو المكتسب.(6) يبيّن الشكل 1 ثالوث فيرخوف وبعض الأمثلة عن العوامل المسبّبة للخثار سواء الجينيّة الموروثة أم المكتسبة (مثل الخباثات واستعمال مانعات الحمل الفموية والرجفان الأذيني والإجراءات الجراحية). بالإضافة إلى علاقة الخثار بالعوامل البيئيّة المذكورة آنفاً، فإنه يرتبط ارتباطاً وثيقاً بالعوامل الجينيّة أيضاً. تتضمّن معظم عوامل الاختطار الجينيّة المعروفة حالياً طفراتٍ في نظام التّخثر. استعرفت طفرة العامل الخامس لايدن (FVL) Factor Five Leiden كأقوى التّغايرات الجينيّة ارتباطاً بالدّاء وأحد أوسعها انتشاراً عالميّاً (3-7%)،2)،(7 مع ملاحظة وجود اختلافات في التّواتر بين المناطق الجغرافيّة المختلفة.8)،(9 تحتّل طفرة البروثرومبين المرتبة الثّانية من حيث الشيوع بين العوامل الجينيّة المؤهّبة للخثار المكتسب inherited thrombophilia.(7) تُسبّب هذه الطّفرة في العامل الثّاني فرط إنتاج الثرومبين وزيادةً بتشكّل الجلطات الدّمويّة. كما تزيد الأعواز الوراثية للبروتين C والبروتين S ومضاد الثرومبين III (وجميعهم من بروتينات النّظام المضاد للتّخثر في البلازما) من اختطار تشكّل خثرات. لا تفسّر العوامل الجينيّة آنفة الذّكر جميع حالات الخثار من النّمط غير المحرّض فهي توجد في 30% فقط من هذه الحالات. كما أنها لا تنتشر بين جميع الإثنيات بالتّواتر ذاته. يُرجّح ما سبق وجود عوامل جينيّة أُخرى منخرطةٍ في فيزيولوجيا المرض ذات انتشار أوسع بين الجمهرات المختلفة.9)،(10
تتطلّب عوامل التّخثر المعتمدة على فيتامين K وهي: الثاني II والسّابع VII والتّاسع IX والعاشر X تعديلاً تالياً للتّرجمة لتصبح فعّالةً حيويّاً عن طريق كرسلة carboxylation ثمالات الغلوتامات. يُؤدي الإنزيم المرجع لإيبوكسيد فيتامين K Vitamin K Epoxide (VKORC1) Reducatse Complex subunit 1 دوراً محوريّاً في هذه العمليّة بتأمين أحد العوامل التّميمة cofactors اللّازمة لإنجاز التّفاعل. حيث يتواسط عمليّة التّفعيل إنزيم Gamma-Glutamyl Carboxylase (GGCX) والذي يستعمل الشّكل المرجَع من فيتامين K (KH2) وثنائي أكسيد الكربون والأكسجين بصفتها عوامل تميمة. ينتج عن هذا التّفاعل أكسدة فيتامين K المُرجع (KH2) إلى إيبوكسيد فيتامينK (KO)، والذي ما يلبث أن يُرجَع إلى شكله الفعّال عبر خطوتين. ينتج عن الأولى فيتامين K (VK)، وتُنتِج الخطوة الثّانية الشّكل المرجَع لفيتامين K (KH2)، ليعاد استعماله مرّة أُخرى في تفعيل عوامل تخثّرٍ جديدةً. يُعدّ VKORC1 الإنزيم الأساسيّ في حلقة فيتامين K هذه، والمسؤول الوحيد عن إرجاع KO إلى VK.(11)،(12) حظيت الطّفرات في جين VKORC1 باهتمامٍ بالغٍ في العلاج السّريريّ، للدور المنسوب إليها في تغايرية جُرع مضادات التّخثر الكومارينيّة (الوارفارين تحديداً)، ونظراً لإمكانية إسامها في اضطرابات عوز فيتامين K.(13) يقع جين VKORC1 على الذّراع القصيرة للصبغي 16، بطول يقارب 11 ألف زوج أساس.(14) ويرمّز بروتيناً غشائياً مرتبطاً بالشّبكة الهيوليّة الباطنة مؤلفاً من 163 حمضاً أمينيّاً، يعبّر عنه في العديد من النّسج وأهمها الكبد.(13) دُرس التّعدد الشّكليُّ مفرد النوكليوتيد Single Nucleotide Polymorphism (SNP) (rs9923231)، والذي يُعرف في الأدبيات بـ -1639G>A، بشكل حثيثٍ نظراً لارتباطه بانخفاض مهمّ في اصطناع عوامل التّخثّر. يقع هذا الـ SNP في منطقة المحضّض promoter ويؤدي وجود النوكليوتيد A عوضاً عن G إلى تعديلٍ في منطقة ارتباط عوامل الانتساخ مما يؤدي بالمحصّلة إلى انخفاضٍ في التّعبير عن إنزيم VKORC1.(13) وانطلاقاً من تأثير VKORC1 المهمّ في نظام التّخثّر، يُعتقد إسهامه في اختلاف تأهب الأفراد للانصمام الخثاري تبعاً للتّعدّد الشّكلي الذي يحمله الفرد، فحملة الأليل A ربما يكونون أقل عرضة لحدوث الخثار من حملة الأليل G.(15) وبناءً على ما سبق، هدفت دراستنا إلى تحرّي العلاقة المفترضة بين التّعدّد الشّكلي مفرد النوكليوتيد
-1639G>A والانصمام الخثاريّ الوريديّ، واستعراف تواتره لدى أفراد سوريّين لتقيّيم جدوى إجراء التّنميط الجيني لهذا التّعدد الشّكلي في الأمراض أو العلاجات ذات الصّلة.
المواد والطّرائق Materials and Methods
تصميم الدّراسة وأفرادها
حظيت دراستنا الرّصدية من نمط حالة- شاهد case- control بموافقة لجنة أخلاقيات البحث العلمي في كليّة الصّيدلة بجامعة دمشق. شملت معايير التّضمين 54 مريضاً بأعمار ≥18 عاماً مراجعين لمخابر مستشفى الأسد الجامعي أو مخابر خاصّة أُخرى في محافظتي دمشق (18 مريضاً) وحمص (36 مريضاً)، ممّن يعانون من انصمام خثاريّ وريديّ تلقائي spontaneous أو غير محرّض unprovoked (بشقَّيه الخثار الوريدي العميق أو الصّمّة الرئويّة). استُبعد مرضى الخثار المحرّض بإجراء جراحيّ أو عوز بروتين C، وكذلك مرضى الخباثات أو المشخّصون بأمراض كبديّة أو كلويّة أو النّساء الحوامل. أما بالنسبة للشواهد البالغ عددهم 44 فقد كانوا أفراداً أصحّاء ظاهرياً لا يعانون من أيّة حدثيّة خثاريّة، بأعمار ≥18 عاماً، ولا تربطهم صلة قربى بعضهم ببعض أو بالمرضى. تم الحصول على الموافقة المستنيرة من جميع المشاركين بعد تقديم شروحات وافية لهم.
التّنميط الجيني
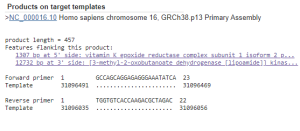
بزلت عيّنات دم وريديّ محيطيّ بحجمٍ لا يقل عن 2 مل وجمعت في أنابيب حاوية على مضادّ تخثر (EDTA) Ethylenediamine Tetraacetic Acid، وحفظت مجمدةً (-20 °C) لحين العمل عليها. استُخلص الدّنا المجيني genomic DNA من العيّنات وفقاً للتّعليمات المرفقة بعتيدة الاستخلاص Wizard ® Genomic DNA Purification Kit. أُجريَ تفاعل البوليميراز التّسلسليّ polymerase chain reaction (PCR) بهدف تضخيم المنطقة من المحضّض promoter الحاوية على الـ SNP المدروس في جين VKORC1. اعتماداً على الأدبيات،(16)،(17)،(18)،(19) استُعمل بدايةً المشرع التّقدمي forward primer 5′-GCCAGCAGGAGAGGGAAATA-3′ والمشرع العكسي reverse primer ذو التّسلسل التّالي 5′-AGTTTGGACTACAGGTGCCT-3′. أجريت تفاعلات الـ PCR بهذين المشرعين وفق بروتوكولRafiee وزملائه.(17) غير أن ظهور منتجات ثانوية لتفاعل الـ PCR حال دون إجراء السّلسلة حتى بعد التّنقية، ولم تُجدِ جميع محاولاتنا الحثيثة نفعاً لأمثلة تفاعل الـPCR. تبيّن باستعمال أدوات المعلوماتيّة الحيويّة؛ مثل أداة البلاست blast tool المتاحة من المركز القومي لمعلومات التّكنولوجيا الحيويّة National Center for Biotechnology Information (NCBI) وأيضاً برنامج MFEprimer؛ عدم نوعية هذين المشرعين على الرغم من ورودهما في الأدبيات والنّشرات ذات الصّلة، الأمر الذي اضطّرنا لاحقاً لتصميم مشرعين نوعيّين يسمحان بالحصول على منتج تضخيم نوعي يسمح بكشف التّعدد المدروس. صُمم المشرع التّقدمي بالتسلسل التالي 5′-GCCAGCAGGAGAGGGAAATATCA-3′ والمشرع العكسي 5′-TGGTGTCACCAAGACGCTAGAC-3′ باستعمال برمجية GENEIOUS® وتم التّحقّق من نوعيتهما بواسطة أداة البلاست وبرنامج MFEprimer3. أجري تفاعل الـ PCR في حجم كلّي قدره 40 ميكرولتر وتضمّن المكونات التّالية بالكميّات المبيّنة أدناه: 20 بيكومول من كلا المشرعين بالإضافة إلى 30-100 نانوغرام من مرصاف الدنا المجيني و20 مكل من محلول مركّز مسبق الخلط OnePCRTM Master mix حاوٍّ على إنزيم بوليميراز الدنا Taq DNA polymerase ودارئة PCR وريبونوكليوتيدات منقوصة الأوكسجين ثلاثيّة الفسفات (dNTPs) deoxyribonucleotide triphosphate وصباغ التّحميل على الهلامة والصّباغ المتألق وأُكمِل الحجم بماء مقطّر معقّم. اعتُمدت الشّروط المذكورة من قبل Lorenz (20) أساساً لبدء تفاعل الـ PCR ومن ثمّ أُمثلت بما يلائم مشارعنا، حيث أُجري التّمسخ البدئي لطيقان الدنا بدرجة حرارة 94 ⁰C لمدة 5 دقائق لتبدأ بعدها 35 دورة (من تمسخ بدرجة94 ⁰C لمدة 30 ثانية، تليها درجة ⁰C 60 لمدة 30 ثانية لترتبط المشرعات بالتّسلسلات المتمّمة لها، ومن ثم استطالة بدرجة 72 ⁰C لمدة دقيقة واحدة) وأجري بعدها استطالة نهائية طيقان الدنا الجديد بدرجة 72 ⁰C لمدة 10 دقائق. وجرى التّحقّق من نجاح تفاعل الـ PCR بإجراء رحلانٍ كهربائيٍّ للمنتج إلى جانب سلّم لأطوال قطع الـ DNA على هلامة أغاروز 1.5% حاوية على بروميد الإيثيديوم لإظهار العصابات ومن ثمّ تصويرها بجهاز تصوير بالأشّعة فوق البنفسجيّة. نُقّيَت منتجات تضخيم الـ PCR إنزيميّاً باستعمال EnzSAPTM ثمّ سُلسلت بطريقة الرّحلان الكهربيّ الشّعريّ Capillary Electrophoresis (CES) Sequensing بالجهاز المسلسل ABI PRISM® 3730 XL Analyzer، وعتيدة السّلسلة ABI PRISM® BigDye TM Terminator Cycle Sequencing Kit (Macrogen®، سيؤول، كوريا الجنوبية).
التحليل الإحصائي
حُلّلت البيانات إحصائيّاً باستعمال البرنامج الإحصائيّ SPSS® Statistical Package for the Social Sciences (الإصدار الخامس والعشرون) وبرمجيّة ®GraphPad Prism (الإصدار الثّامن). قُيّم التّوزع الطّبيعي للبيانات عبر اختبار Shapiro-Wilk. عُبّر عن المتغيرات الكميّة المستمرّة (أعمار المرضى) التي تتبع التّوزع الطّبيعي بالمتوسط ±الانحراف المعياري، وعن المتغيرات المستمرّة التي لا تتبع التّوزع الطّبيعي (أعمار الشّواهد) بالوسيط ±المدى الرّبيعي، أما المتغيّرات الإسمية فبالتواتر والنسب المئوية. استُعمل اختبار فيشر Fisher’s exact test لكل مجموعتي مقارنة في حال وجود متغيّرين اسميّين فقط، واختبار كاي مربّع Chi-square test في حالة المتغيّرات الفئوية. كما جرى استعمال اختبار Mann-Whitney U للمقارنة بين مجموعتي الدّراسة للبيانات المستمرّة غير المتوزّعة طبيعيّاً. حُسب تواتر الأليلين A وG بقسمتها على عدد الألائل الكّلي. استعمل اختبار كاي مربّع لمقارنة الفروقات بين تواتر الألائل والأنماط الجينيّة المشاهدة والمتوقّعة وفقاً لتوازن هاردي واينبرغ (HWE) Hardy-Weinberg Equilibrium. اعتُمدت P<0.05 كقيمةٍ دلالةٍ معتدٍّ بها لجميع الاختبارات الإحصائيّة المطبّقة.
النتائج Results
الخصائص الديموغرافية لجمهرة الدراسة
تضمّنت دراستنا 54 مريضاً مصاباً بانصمام خثاري مثبت التشخيص ومجهول سبب الحدوث، و44 فرداً لا يعانون من أيّة حدثيّة خثاريّة (أصحّاء) بصفتها شواهد. قورنت خصائص المرضى الديموغرافية (العمر والجنس) مع الشّواهد. على الرّغم من الاختلافات الظّاهرية بين المجموعتين لكون وسيط الأعمار لدى الشّواهد أعلى من نظيره لدى المرضى، ونسبة الذّكور أعلى في ذراع الحالة من الشّواهد، إلا أن هذه الفوارق لم تكن ذات دلالة إحصائية إذ بلغت قيمة P(0.07 و0.067). كان معظم أفراد الدراسة من غير المدخّنين، إذ لم تتجاوز نسبة المدّخنين 9.3% لدى المرضى، و15.9% لدى الشّواهد ودون فارق معتدٍّ به (P=0.352). لوحظت فوارق ذات دلالة بين المجموعتين من حيث الإصابة بفرط التّوتر الشّرياني والداء السّكري، ولكن كانت النّسب الأعلى لعوامل الاختطار هذه في ذراع الشّاهد وليس الحالة. يبيّن الجدول 1 الخصائص الدّيموغرافية والسّريرية لأفراد الدّراسة.
نتائج التّنميط الجيني
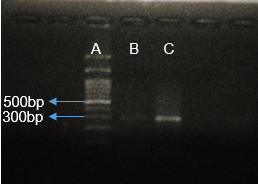
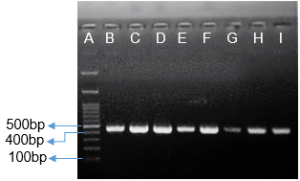
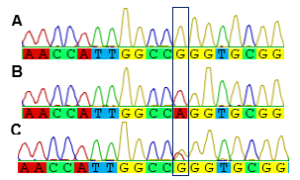
أعطى تفاعل الـPCR المُجرى باستعمال المشرّعين الواردين في الأدبيّات الطّبية وفق بروتوكول Rafiee وزملائه(17) عصابة شبه مرئيّة، ولم تسفر محاولات أمثلة التّفاعل عن نتائج مرضية، حيث أن تغيير العديد من الشّروط وتجربة تنويعة من درجات حرارة التّلدين Annealing مثل تجربة درجة حرارة60 ⁰C أفضى إلى ظهور منتجات ثانويّة عديدة ظهرت بشكل لطاخة smear مؤلفة من العديد من المنتجات الثّانويّة إضافة للمنتج المطلوب بطول 290bp (زوج أساسbase pair )، الأمر الذي دلّ على افتقارها للنّوعيّة كما يظهر في الشّكل (2)، وهو أمر أكّدته نتائج بحثنا باستعمال أدوات المعلوماتيّة الحيويّة مثل أداة BLAST وMFEprimer، حيث تبيّن احتمال تضخيم 363 منتجاً إضافيّاً عدا المنتج المرغوب. وهذا ما دفعنا إلى تصميم مشرعين نوعيّين قمنا باختبارهما، وقد أعطى تفاعل الـ PCR باستعمالهما منتجاً وحيداً مطابقاً للطّول المتوقّع 457bp (كما يبيّن الشّكلان 3 و4). قُرئت نتائج السّلسلة ببرمجيّة GENEIOUS® التي أظهرت وجود ثلاثة أنماط جينيّة (GG وGA و(AA في العيّنات المدروسة (كما هو موضح في الشكل 5).
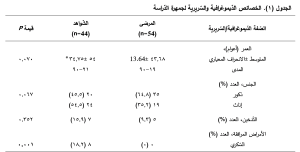
تواتر الأنماط الجينيّة والألائل في جمهرة الدّراسة
حقق النّمط الجيني متغاير الزيجوت GA الانتشار الأعلى بين الأنماط الجينيّة لدى المرضى وبنسبة قدرها 64.8%، تلاه النّمط الشّائع GG بنسبة 22.2%، ليحلَّ النّمط متماثل الزيجوت الطّافر AA أخيراً بنسبة قدرها 13%. وبذلك يكون تواتر الأليل الشّائع (G) 0.55 وتواتر الأليل الطّافر (A) 0.45. بصورة مشابهة لمجموعة المرضى، كان تواتر النّمط الجيني GA الأعلى لدى الشّواهد بنسبة قدرها 86.4%، في حين تساوى النمطان الشّائع GG والطّافر AA من حيث نسبتا انتشارهما البالغة 6.8%. وبهذا تساوى تواترا الألّيلين الشّائع (G) والطّافر (A) لدى الشّواهد إذ بلغ 0.5 لكلٍّ منهما. أظهرت الأنماط الجينيّة المشاهدة في مجموعتي الدّراسة كلتيهما انحرافاً عن الأنماط المتوقعّة وفق توازن هاردي واينبرغ HWE، إذ كانت 0.024= P وأقل من 0.001 لدى المرضى والشّواهد، على التّرتيب.
علاقة النّمط الجيني بالانصمام الخثاريّ الوريديّ
لدى مقارنتنا للأنماط الجينيّة بين ذراعي الدّراسة، كان النّمط الشّائع GG جليّاً لدى المرضى (22.2%) مقارنة بالأصحاء (6.8%). وكان هذا التّوزع غير المتكافئ بين مجموعتي الدّراسة للأنماط الجينيّة الحاوية على الأليل الطّافر A (GA وAA) مقارنة بالأفراد غير الحاملين له ذوي النّمط (GG) معتدّاً به إحصائيّاً (P=0.048)، حيث بلغت نسبة حملة الأليل A نسبة أعلى 93.2% في مجموعة الشّاهد مقارنةً بـ 77.8% لدى المرضى. ترافقت الأنماط الجينيّة الحاملة للأليل A بانخفاضٍ في اختطار حدوث الانصمام الخثاري الوريدي إلى الرّبع تقريباً، حيث كانت نسبة الأرجحية odd ratio ومجال الثّقة (OR=0.256, 95% CI=0.074-0.925). وترافق النّمط الجيني الشّائع GG باختطار أعلى لحدوث المرض يقارب الأربعة أضعاف
(OR=3.9, 95% CI=1.081-13.56). لم يكن الفارق بين مجموعتي الدّراسة من حيث تواتر الأليل A معتداً به إحصائياً (P=0.566)، وعلى الرغم من أنه أعطى احتمالاً أقل بـ 17% من حملة الألّيل G لحدوث انصمام خثاري، إلا أن هذه القيمة لم يكن معتداً بها. يوضح الجدول 2 تواتر الأنماط الجينيّة والألائل والفروقات بين مجموعتي الدّراسة.
المناقشة Discussion
يقوم الطّب المشخصن personalized medicine على مبدأ علاج كل مريض بناءً على المعطيات البيئيّة والسّريريّة والجينيّة الخاصّة به، وقد شهد مؤخراً تحديثاّ وسّع من إطاره ليشمل الوقاية المشخصنة من الأمراض. تشمل أحد أوجه هذه الوقاية المشخصنة إيتاء أدوية وقائيّة للأشخاص ذوي الاحتطار العالي وتجنيب الأفراد ذوي الاختطار المنخفض التّأثيرات الضّارة الممكنة لهذه الأدوية الوقائيّة. وكمثال تطبيقيّ على ذلك، إعطاء الأسبرين على أنه وقاية أوّليّة من سرطان القولون للأفراد الحاملين لبعض الأنماط الجينيّة التّي تزيد نسبة الاختطار للإصابة بهذا المرض.(21) يعدّ الانصمام الخثاريّ الوريديّ أحد أكثر الأمراض القلبيّة الوعائيّة انتشاراً، كما تعدّ الصّمّة الرئويّة هي ثالث سببٍ للوفاة بعد النّوبات القلبيّة والسّكتة الدّماغية،5)،(22 بالإضافة لكونه داءً متعدّد الأوجه ناجماً عن تآثرات معقّدة بين العوامل الجينيّة والبيئيّة. يساعد فهم تنوّع العوامل الجينيّة، المنخرطة بإحداث هذا الدّاء سواءً في الأفراد أم الإثنيات المختلفة، في اختيار الاختبارات الجينيّة الملائمة لكشف الأفراد ذوي الاختطار المرتفع، وتطوير برامج وقائيّة ملائمة لكلّ مريض أو مجموعة إثنية على حدة.(23)

دُرست الـ SNPs في جين VKORC1 بوصفها عاملَ اختطارٍ مُحتَملاً للأمراض القلبيّة الوعائيّة مثل السّكتة الدّماغية والأمراض التّاجيّة والخثار، وذلك لدور إنزيم VKORC1 في عملية تكلس الشّرايين calcification واصطناع عوامل التّخثر.(24). أظهرت دراستنا اختلاف تواتر الأنماط الجينيّة للتّعدّد الشّكلي -1639G>A بين المرضى والأصحّاء. حيث امتلك المرضى النّمط الجينيّ الشّائع GG بنسبة أكبر من الأصحّاء. كما بيّنت المقارنة بين المجموعتين أن الأفراد ذوي النّمط الجيني الحاوي على الأليل الطّافر A أٌقلّ عرضةً لتطوير حدث خثاري بما يقارب 75% مقارنة بغير الحاملين له (أي أصحاب النّمط الشّائع GG)، وهو ما يجعل الأفراد ذوي النّمط GG في اختطار أعلى لحدوث الانصمام الخثاري الوريدي بأربعة أضعاف تقريباً من الأفراد الحاملين للأليل A. وما يجدر ذّكره هنا امتلاك الشّواهد عوامل اختطار أخرى (مثل السّكري وارتفاع التّوتر الشّرياني) بنسبة أعلى من مرضى الخثار. يمنح الأليل A حامليه مستويات أخفض من إنزيم VKORC1 نظراً لخفضه التّعبير الجيني ويؤدي بالمحصّلة إلى تناقص اصطناع البروتين بما يقارب النّصف (44%) لدى الأفراد متماثلي الزيجوت ذوي النّمط الجيني AA؛ الأمر الذي سينقص بدوره من اصطناع عوامل التّخثر المعتمدة على فيتامين K دون المستوى الطّبيعي.(10) وبهذا يمكن تشبيه حالة هؤلاء الأفراد بمن يتناول طوال حياته جرعة منخفضة من مضادّات التّخثر ما يجعله أقلّ أهبة للإصابة بالانصمام الخثاريّ. خَلصت دراسة Kumari وزملائه (2019) إلى نتيجة مشابهة لدراستنا وهي اختلاف الأنماط الجينيّة للتعدّد الشّكلي -1639G>A بين المرضى والأصحّاء وارتفاع نسبة النّمط AA لدى الأصحّاء مقارنة بالمرضى، إلا أن ازدياداً في النّمطين الجينيّين GG) و(GA سويّةً قد لوحظ لدى المرضى(10) وهذا يناقض نتائج دراستنا. في دراسة أخرى، ربط Lacut وزملاؤه (2007) أيضاً بين تعدّد شكلي آخر في جين VKORC1 هو 1173C>T وحدوث الخثار.(25) يقع 1173C>T SNP في الإنترون الأول من جين VKORC1، ويشكّل مع SNP -1639G>A علاقة اختلال توازن ارتباطيّ Linkage disequilibrium؛ يمكن شرحها بترافق ملاحظ بين الأليل T في الـ SNP 1173C>T والأليل A في SNP -1639G>A من جين VKORC1. وحيث أن نتائج تلك الدّراسة تثبت دوراً وقائياً للأليل T بالوقاية من اختطار الإصابة بالخثار لدى الأصحّاء، فإن العامل المؤثر في حقيقة الأمر هو وجود الأليل -1639A؛ إذ أن الـ SNP في الإنترون الأول خامل وليس له تأثير يذكر في مستويات التّعبير عن VKORC1. (13) كشف تحليل بعدي meta-analysis قام به Verstuyft وزملاؤه عام 2009، لبيانات نشرات عدّة تدرس العلاقة بين جين VKORC1 والخثار عبر الكشف عن طفرة الإنترون، عدم وجود أيّ ارتباطٍ بينهما. ولكن تجدر الإشارة إلى أن عينة الدّراسة اقتصرت على نساء بعد سن الإياس فقط ولم تشمل كلا الجنسين أو تنوعاً في الأعمار.(24) أثبتت دراستنا انتشاراً مرتفعاً لـ SNP -1639G>A لدى مجموعة الدراسة إذ يطابق تواتر الأليل الطّافر A تواتر الألّيل الشّائع G بنسبة قدرها 50% لكليهما، واحتّل النّمط متغاير الزيجوت GA النّسبة الأعلى (86.4%) يليه النّمطان متماثلا الزيجوت GG وAA بنسبتين متماثلتين (6.8%). يسبب الارتفاع الكبير في تواتر النّمط متغاير الزيجوت عادة انحرافاً عن توازن هاردي واينبرغ HWE. وبإمكاننا نفي الخطأ التّقني كسبب للانحراف الذي أظهرته مجموعتي الدّراسة عن الأنماط المتوقّعة، وذلك لاعتمادنا طريقة السّلسلة sequencing الدّقيقة والمرجعيّة في الكشف. يمكن أن يعزى هذا الانحراف إلى صغر حجم العيّنة نسبياً، أو بسبب اختلال توازن المجتمع السّوري وانخفاض التّعداد السّكانيّ بشكل مفاجئ نتيجة الهجرة الخارجية الحاصلة خلال السّنوات العشر الأخيرة. يعدّ اعتيان أفراد الدّراسة من سكان العاصمة السّورية دمشق ممثلاً جيّداً للتّركيبة السّكانية نتيجة اشتمالها أفراداً من جميع محافظات القطر لأسباب تتعلق بالعمل والدّراسة وبسبب الهجرة الدّاخلية إليها في السّنوات الأخيرة، إلا أنّها قد تكون من جهة أخرى المتّهم بانزياح التّواتر تجاه النّمط متغاير الزيجوت.(26،27) يقارب تواتر الألّيل الطّافر A لدى السّوريين الأصحّاء في دراستنا (50%) مثيله لدى اللّبنانييّن (52.8%) المنشور في دراسة Djaffar-Juredeini وزملائها (2011)،(28) ويماثل نسبة التّواتر لدى الإماراتييّن (49.6%).(29) يُلاحظ انخفاض التّواتر في البلدان جنوب سورية وغربها، كما هو الحال في السّعودية ومصر ليصبح الأليل نادر التّواتر في أفريقيا.30)،31،32) بينما يزداد باتّجاه الشّرق حيث وثّق تواتر أعلى في إيران(33) وليصبح هو الأليل الشائع في اليابان وشرق آسيا.(34) يبيّن الجدول 3 تواتر الأليل A لدى بعض الجمهرات السّكانيّة في الشّرق الأوسط ولدى إثنيات أخرى مثل الفرنسيين والأمريكيين ذوي الأصول الأفريقيّة.35)،(36 لا تزال العوامل الجينية ذات التّأثير المباشر بحدوث الخثار (مثل طفرة FVL وطفرة البروثرمبين) قاصرةً ليس فقط عن تفسير الاختلاف بين أفراد الجمهرة الواحدة، وإنما يكمن قصورها الأكبر في تفسير اختلاف وقوع الـ VTE بين الأعراق والإثنيات المختلفة. فمن المعروف أن الأفارقة يتصدّرون القائمة بين الأعراق من حيث نسب وقوع الخثار، يليهم القوقازيون والأوروبيون ولتحلّ الدول الآسيوية في ذيل القائمة.2)،(37 غير أنّه من المثير للانتباه أن انتشار طفرة العامل الخامس لايدن (الأكثر انتشاراً وارتباطاً بالخثار) لا يرتبط مع انتشار الخثار حول العالم، فهذه الطّفرة هي الأقل انتشاراً في أفريقيا رغم التّواتر المرتفع لحدوث الدّاء وينسحب الأمر على طفرة البروثرومبين؛ فيما تتساوى نسب انتشار الطّفرات المسبّبة لعوز بروتيني C وS بين الأفارقة والأوروبيين. تقترح نتائجنا توافقاً تاماً بين تواتر انتشار الـ VTE مع انتشار أليل الخطورة -1639Gفي جين VKORC1. حيث يوجد الألّيل G لدى الغالبية العظمى (قرابة 90%) من الأفراد الأفريقييّن، وتشير دراسات الانتشار إلى تواتره الأقل نسبياً لدى الأوروبيّين وبالمقابل فإن انتشاره هو الأخفض لدى الأفراد الآسيوييّن.(2)، (36)،(37)
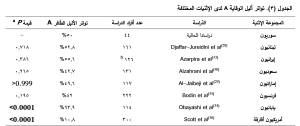
الاستنتاجات Conclusions
تقدّم دراستنا البيّنة على ارتفاع تواتر الأليلA للتّعدد الشّكلي -1639G>A في جين VKORC1 لدى جمهرة السّوريّين المدروسة، وتظهر أثره الوقائيّ من الانصمام الخثاريّ الوريديّ وإمكانيّة إضافة النّمط الجيني GG إلى عوامل الاختطار الجينيّة الأخرى المحرّضة لحدوث الدّاء للاستفادة من دوره الإنذاريّ التّنبؤيّ. يعدّ العدد المنخفض نسبياً لجمهرة الدّراسة المحدودية الأكبر لدراستنا، ما يدفعنا لاقتراح إجراء دراسات على جمهرات أكبر عددياً سواء من الأصحّاء أو المرضى ودراسة الدّور المحتمل لهذا التّعدد الشّكلي في أمراض القلب الشّريانية. ختاماً، تسلّط هذه الدّراسة الضوء على أحد العوامل الجينيّة التي تسهم في رفع الأهبة للخثار، وتقترح مقاربةً تأخذ بعين الاعتبار التآثرات بين جميع العوامل لما في ذلك من تعظيم لقدرتنا على فهم الفيزيولوجيا المرضيّة للخثار ومنح مقدمي الرّعاية الصّحيّة فرصاً أفضل للوقاية والعلاج.
المراجع :- Tritschler T, Kraaijpoel N, Le Gal G, Wells PS. Venous thromboembolism: advances in diagnosis and treatment. Jama. Oct 16;320(15):1583-94. 2018
- Crous-Bou M, Harrington LB, Kabrhel C. Environmental and Genetic Risk Factors Associated with Venous Thromboembolism. Semin Thromb Hemost. Nov 1;42(8):808–20. 2016
- Ortel TL, Neumann I, Ageno W, Beyth R, Clark NP, Cuker A, et al. American society of hematology 2020 guidelines for management of venous thromboembolism: Treatment of deep vein thrombosis and pulmonary embolism. Blood Advances. p. 4693–738. 2020
- Áinle FN, Kevane B. Which patients are at high risk of recurrent venous thromboembolism (deep vein thrombosis and pulmonary embolism)?. Blood advances. Nov 10;4(21):5595-606. 2020
- Goldhaber SZ, Bounameaux H. Pulmonary embolism and deep vein thrombosis. The Lancet. May 12;379(9828):1835-46. 2012
- Olaf M, Cooney R. Deep Venous Thrombosis. Emergency Medicine Clinics. Nov 1;35(4):743-70. 2017
- Dautaj A, Krasi G, Bushati V, Precone V, Gheza M, Fioretti F, et al. Hereditary thrombophilia. Vol. 90, Acta Biomedica. Mattioli 1885. p. 44–6. 2019
- Middeldorp S. Inherited thrombophilia: A double-edged sword. Hematology. 2016 Dec 2. (1):1-9. 2016
- Van Cott EM, Khor B, Zehnder JL. Factor V Leiden. American journal of hematology. Jan;91(1):46-9. 2016
- Kumari B, Garg I, Rai C, et al. Positive Association of Mutations in VKORC1 and CYP2C9 Genes with Venous Thrombo-Embolism (VTE) in Indian Population: A Case Control Study. J. Gene Engg. Bio. Res.;1(2) . 2019
- Garcia AA, Reitsma PH. VKORC1 and the Vitamin K Cycle. Vitamins & Hormones. Jan 1;78:23-33. 2008
- Tie JK, Stafford DW. Structural and functional insights into enzymes of the vitamin K cycle. Journal of Thrombosis and Haemostasis. Feb;14(2):236-47. 2016
- Owen RP, Gong L, Sagreiya H, Klein TE, Altman RB. VKORC1 pharmacogenomics summary. Pharmacogenetics and genomics. Oct;20(10):642. 2010
- Yang L, Ge W, Yu F, Zhu H. Impact of VKORC1 gene polymorphism on interindividual and interethnic warfarin dosage requirement- A systematic review and meta analysis. Thrombosis research. Apr 1;125(4):e159-66. 2010
- Dubovyk YI, Harbuzova VY, Ataman A V. G-1639A but Not C1173T VKORC1 Gene Polymorphism is Related to Ischemic Stroke and Its Various Risk Factors in Ukrainian Population. BioMed Research International. Jan 1;2016
- Sconce EA, Khan TI, Wynne HA, Avery P, Monkhouse L, King BP, et al. The impact of CYP2C9 and VKORC1 genetic polymorphism and patient characteristics upon warfarin dose requirements: Proposal for a new dosing regimen. Blood. Oct 1;106(7):2329-33. 2005
- Rafiee S, Rajabibazl M, Meshkani R, Daraei A, et al. Association of Warfarin Therapy with APOE and VKORC1 Genes Polymorphism in Iranian Population. Iranian Journal of Pharmaceutical Research: IJPR.16(3):1230. 2017
- Zhu J, Zhang W, Li Y, Zhang W, Wang H, Zheng W, et al. ARMS test for diagnosis of CYP2C9 and VKORC1 mutation in patients with pulmonary embolism in Han Chinese. Pharmacogenomics. Jan;11(1):113-9. 2010
- Namazi S, Azarpira N, Hendijani F, Khorshid MB, Vessal G, Mehdipour AR. The impact of genetic polymorphisms and patient characteristics on warfarin dose requirements: A cross-sectional study in Iran. Clinical therapeutics. Jun 1;32(6):1050-60. 2010
- Lorenz TC. Polymerase chain reaction: Basic protocol plus troubleshooting and optimization strategies. JoVE (Journal of Visualized Experiments). May 22(63):e3998. 2012
- Goetz LH, Schork NJ. Personalized medicine: motivation, challenges, and progress. Fertility and sterility. Jun 1;109(6):952-63. 2018
- Bartholomew JR. Update on the management of venous thromboembolism. Cleve Clin J Med. Dec 3;84(12 suppl 3):39-46. 2017
- Tang L, Hu Y. Ethnic diversity in the genetics of venous thromboembolism. Thrombosis and haemostasis. 114(11):901-9. 2015
- Verstuyft C, Canonico M, Bouaziz E, Guiochon-mantel A, Scarabin PY. VKORC1 genetic polymorphism and risk of venous thromboembolism in postmenopausal women: New findings and meta-analysis. Journal of Thrombosis and Haemostasis. Jun;7(6):1034-6. 2009
- Lacut K, Larramendy-Gozalo C, Le Gal G, Duchemin J, et al. Vitamin K epoxide reductase genetic polymorphism is associated with venous thromboembolism: Results from the EDITH Study. Journal of Thrombosis and Haemostasis. Oct;5(10):2020-4. 2007
- Zintzaras E. Impact of Hardy-Weinberg equilibrium deviation on allele-based risk effect of genetic association studies and meta-analysis. European journal of epidemiology. Aug 1;25(8):553-60. 2010
- Wigginton JE, Cutler DJ, Abecasis GR. A note on exact tests of Hardy-Weinberg equilibrium. The American Journal of Human Genetics. May 1;76(5):887-93. 2005
- Djaffar-Jureidini I, Chamseddine N, Keleshian S, et al. Pharmacogenetics of coumarin dosing: Prevalence of CYP2C9 and VKORC1 polymorphisms in the lebanese population. Genetic testing and molecular biomarkers. Nov 1;15(11):827-30. 2011
- Al-Jaibeji H, John A, Al-Gazali L, et al. Allele and genotype frequencies of the two single nucleotide polymorphisms in the VKORC1 gene that are most important for warfarin treatment among Emiratis. Hamdan Medical Journal. Jan;212(3849):1-0. 2016
- Alzahrani AM, Ragia G, Hanieh H, Manolopoulos VG. Genotyping of CYP2C9 and VKORC1 in the arabic population of Al-Ahsa, Saudi Arabia. BioMed research international. Jan 1;2013.
- Selim TE, Azzam HA, Ghoneim HR, Mohamed AA, et al. Pharmacogenetic Warfarin Dosing Algorithms: Validity in Egyptian Patients. Acta haematologica. 139:255-62. 2018
- Ndadza A, Cindi Z, Makambwa E, Chimusa E, et al. Warfarin Dose and CYP2C Gene Cluster: An African Ancestral-Specific Variant Is a Strong Predictor of Dose in Black South African Patients. Omics: a journal of integrative biology. Jan 1;23(1):36-44. 2019
- Azarpira N, Namazi S, Hendijani F, Banan M, Darai M. Investigation of allele and genotype frequencies of CYP2C9, CYP2C19 and VKORC1 in Iran. Pharmacological reports. Jul 1;62(4):740-6. 2010
- Obayashi K, Nakamura K, Kawana J, Ogata H, et al. VKORC1 gene variations are the major contributors of variation in warfarin dose in Japanese patients. Clinical Pharmacology & Therapeutics. Aug;80(2):169-78. 2006
- Bodin L, Verstuyft C, Tregouet DA, Robert A, et al. Cytochrome P450 2C9 (CYP2C9) and vitamin K epoxide reductase (VKORC1) genotypes as determinants of acenocoumarol sensitivity. Blood. Jul 1;106(1):135-40. 2005
- 36. Scott SA, Khasawneh R, Peter I, Kornreich R, Desnick RJ. Combined CYP2C9, VKORC1 and CYP4F2 frequencies among racial and ethnic groups. Pharmacogenomics. Jun;11(6):781-91. 2010
- Goldhaber SZ. Race and venous thromboembolism: Nature or nurture? Circulation. 129:1463-1465. 2014