دراسة مقارنة ما بين الاستخلاص بطريقة سوكسليه والتقطير ببخار الماء لاستخلاص المركبات الطيارة من أوراق النارنج Citrus x aurantium L. المستزرع في دمشق
2025-04-26 | المجلد السابع العدد الخامس – المجلد السابع | مقالات بحثيةلوليا شريف الحواط | لؤي محمد العلان
الملخص
خلفية البحث وهدفه: تعرف أوراق النارنج باحتوائها على الزيت الطيار، والذي يختلف تركيبه تبعاً لعدة عوامل منها بلد المنشأ، المناخ، وطريقة الاستخلاص. لم تحظ مكونات الزيت الطيار المستحصل من أوراق النارنج بالكثير من الاهتمام في الأدبيات. لذلك اتجهت هذه الدراسة إلى مقارنة طريقتين لاستخلاص المركبات الطيارة من أوراق النارنج (التقطير ببخار الماء والاستخلاص بجهاز سوكسليه).
مواد البحث وطرائقه: جمعت الأوراق من عدة مناطق في مدينة دمشق وتمت المقارنة بين طريقتي استخلاص المركبات الطيارة من خلال تحديد التركيب الكيميائي باستخدام جهاز الاستشراب الغازي الموصول بمتحري مطياف الكتلة (GC-MS).
النتائج: نتج عن التقطير ببخار الماء زيت طيار بلون أصفر باهت وبمردود يقارب 0.5% حُدّد فيه 27 مركباً، أما بالاستخلاص بجهاز سوكسليه فقد تم الحصول على خلاصة ذات لون أخضر غامق وبمردود يُقارب 40% وحدّد فيها 33 مركباً. لوحظ بأن المركب الأكثر وفرة في كلا الطريقتين هو مركب خلّات الليناليل بنسبة 49.79% في عينة الزيت الطيار، وبنسبة 56.01% في عينة الخلاصة. كما حققت المركبات أحادية التربين نسبة التوافر الأعلى في كلا الطريقتين بنسبة 97.16% في عينة الزيت الطيار، وبنسبة 59.77% في عينة الخلاصة.
الاستنتاجات: نستنتج إمكانية استخلاص مركب خلات الليناليل بكلا الطريقتين (التقطير ببخار الماء والاستخلاص بجهاز سوكسليه)، أما للحصول على المركبات الطيارة بمنعزل عن غيرها من المركبات فطريقة التقطير ببخار الماء هي الأفضل.
كلمات مفتاحية : أوراق، نارنج، Citrus x aurantium، زيت طيار، خلات الليناليل، GC-MS، سوكسليه، تقطير ببخار الماء ,Leaves, bitter orange, Citrus x aurantium, volatile oil, linalyl acetate, GC-MS, Soxhlet, hydrodistillation
المقدمة Introduction
تُعدُّ النباتات الطبية مصدراً كبيراً للعديد من المركبات المستخدمة في الصناعات الدوائية والغذائية. يُعزى استخدام النباتات الطبية إلى محتواها من المركبات الفعالة حيوياً [1]. استخدمت نباتات الفصيلة السذابية Rutaceae غالباً في العلاجات الطبية بسبب محتواها العالي من المكونات الفعالة، وخاصة الزيوت الطيارة [2]. يعدّ النارنج نباتاً واعداً إلى حد كبير في مجال البحث لخصائصه الطبية العديدة [3].
يختلف التركيب الكيميائي للزيت الطيار المستحصل من الحمضيات تبعاً لاختلاف الأنواع، بلد المنشأ، المناخ، موسم الحصاد، مرحلة النضج، طرائق الاستخلاص والتحليل [3]. وقد دُرِس التركيب الكيميائي للزيت الطيار في أجزاء مختلفة من النارنج خلال فترات مختلفة. ركزت العديد من الدراسات على الزيت الطيار المستحصل من قشور النارنج وأشارت إلى أن ليمونين limonene هو المكون الرئيسي. في المقابل، أجريت دراسات أخرى على الزيت الطيار المستحصل من أزهار النارنج وأشارت إلى أن لينالول linalool وخلات ليناليل linalyl acetate هما المكونان الرئيسيان [3]. أظهرت الدراسات القليلة التي أُجريت على أوراق النارنج أن لينالول linalool هو المكون الرئيسي في الزيت الطيار. ومع ذلك، فإن مكونات الزيت الطيار المستحصل من الأوراق لم تحظ بالكثير من الاهتمام في الأدبيات[3].
الزيوت الطيارة عبارة عن أمزجة من مركبات طيارة ذات وزن جزيئي منخفض، يتم استخلاصها من أجزاء النباتات العطرية [1]. تُعدّ التربينوئيدات ومركبات الفينيل بروبان المكونات الرئيسية المسؤولة عن الرائحة المميزة والفعاليات الحيوية للزيوت الطيارة. تتميّز الزيوت الطيارة بطبيعتها الكارهة للماء. تُستخدم العديد من الطرائق لاستخلاص الزيوت الطيارة، والتي تتضمن: الاستخلاص بالسوائل فوق الحرجة، التقطير ببخار الماء، الجرف ببخار الماء، الاستخلاص بجهاز سوكسليه، والاستخلاص بالمذيبات، بالإضافة إلى طرائق أخرى [1]. قد يختلف تركيب الزيوت الطيارة اعتماداً على طرائق الاستخلاص المطبّقة. كما أنّ شروط الاستخلاص المطبّقة يمكنها التأثير بشكل كبير على سير عملية الاستخلاص وكفاءتها. لذلك، من الضروري استخدام طريقة الاستخلاص المناسبة [1].
قارنت الدراسة المصرية [4] بين ثلاث طرائق مختلفة للاستخلاص وهي التقطير ببخار الماء، الجرف ببخار الماء، والتقطير ببخار الماء بمساعدة الأمواج المكروية لمقارنة التركيب الكيميائي بين عينات الزيت الطيار الناتجة من أوراق النارنج. تم تحليل عينات الزيوت الطيارة من خلال جهاز الاستشراب الغازي الموصول بكاشف التأين باللهب GC-FID وجهاز الاستشراب الغازي الموصول بمتحري مطياف الكتلة GC-MS. تم الكشف عن 35 مركباً طياراً وقياسها كمياً. مثّلت المركبات أحادية التربين Monoterpenes الفئة الأكثر وفرة في الزيوت الطيارة الثلاثة تليها المركبات أحادية ونصف التربين Sesquiterpenes. حيث قدمت الطرائق الثلاث المتبعة في الدراسة [4] أنماطاً مختلفة من توزع المركبات الطيارة وقد تبيّن الاختلاف في مكونات الزيت الطيار المستحصل بالجرف ببخار الماء عن مكونات العينات الأخرى. وقد أكدت الدراسة على أهمية الزيت الطيار لأوراق النارنج باعتباره مصدراً قيّماً للمركبات الطيارة لاسيما خلات اللينالول linalool acetate، خلات ألفا تربينيل α-terpinyl acetate، لينالول linalool، وأوكاليبتول eucalyptol. وأظهرت الزيوت الطيارة الثلاثة فعاليات مضادة للأكسدة، وخافضة لسكر الدم، بالإضافة لدورها في حماية الأعصاب من خلال تثبيط الإنزيمات في الزجاج in vitro. وتعزى فعاليّاتها الحيوية إلى وجود أحاديات التربين المؤكسجة بنسبة أعلى من بقية المركبات في الزيوت الطيارة الثلاثة.
حالياً، توجد قلّة في الأدبيات حول اختيار طريقة استخلاص الزيت الطيار والمركبات الطيارة من أوراق النارنج. هذه الدراسة تسلط الضوء على طريقتين لاستخلاص المركبات الطيارة من أوراق النارنج. تشمل طرائق الاستخلاص المطبقة في هذه الدراسة كلّاً من الاستخلاص باستخدام جهاز سوكسليه والتقطير ببخار الماء باستخدام جهاز نمط Clevenger.
تعتبر طريقة الاستخلاص باستخدام جهاز سوكسليه إحدى الطرائق الفعالة في استخلاص الزيوت الطيارة [5]. هذه الطريقة بسيطة ومنخفضة التكلفة ولا تحتاج إلى ترشيح بعد الاستخلاص [6]. إحدى المزايا الرئيسية لهذه الطريقة هي إمكانية استخلاص المركبات ذات الانحلالية القليلة إلى المتوسطة. لابد من الاختيار الصحيح للمذيبات المستخدمة في هذه الطريقة وذلك للحصول على عائدٍ مُرضٍ بالإضافة لتجنب فقدان المركبات الطيارة [1]. كما أن نوع المذيب المستخدم في هذه الطريقة يعتمد على قطبية المركبات المراد الحصول عليها. إن عملية الاستخلاص طويلة عادةً، مما يؤدي إلى تدمير بعض المركبات غير الثابتة بالحرارة thermolabile [1,6].
يعدّ التقطير ببخار الماء طريقة تقليدية أخرى، حيث يستخدم الماء لاستخلاص المركبات الفعالة حيوياً ويكون معظمها من الزيوت الطيارة. يتم إجراء هذه الطريقة باستخدام جهاز نمط Clevenger، حيث تُسخّن العينة المائية لتبخير المكونات الطيارة وينتج عن ذلك طبقتان (مائية وزيتية)، ومن ثمّ تُفصل الطبقة الزيتية [1]. من وجهة نظر اقتصادية، فإن هذه الطريقة لا تتطلب استخدام مذيبات عضوية، مما يجعلها خياراً مرغوباً فيه عندما تكون تكلفة الاستخلاص ذات أهمية. يتضمّن التقطير ببخار الماء ثلاث عمليات فيزيائية كيميائية رئيسية: الانتشار المائي hydrodiffusion، التحلل المائي hydrolysis، والتحلل الحراري heat decomposition [1].
على ضوء ما ذكر أعلاه، فإن اختيار طريقة الاستخلاص أمر بالغ الأهمية بالنسبة للمركبات الطيارة التي سيتم استخلاصها وللحصول على المردود المرغوب فيه. لذلك تهدف هذه الدراسة إلى المقارنة ما بين طريقتي استخلاص المركبات الطيارة (التقطير ببخار الماء والاستخلاص باستخدام جهاز سوكسليه) من خلال تحديد التركيب الكيميائي لكل من عينتي الطريقتين باستخدام GC-MS.
المواد والطرائق Materials and Methods
تمّ إنجاز هذا البحث في مختبرات قسم العقاقير في كلية الصيدلة، جامعة دمشق، وفي مختبرات هيئة الطاقة الذرية.
- المواد الكيميائية:
ماء مقطّر، أسيتون (Panreac, Spain)، نظامي الهكسان (Merck KGaA Darmstadt, Germany)، سلفات الصوديوم اللامائية (AvonChem, United Kingdom).
- الأجهزة والأدوات المستخدمة:
ميزان حسّاس، مطحنة، مبخّر دوّار، جهاز تقطير نمط Clevenger، جهاز سوكسليه Soxhlet extractor، جهاز الاستشراب الغازي Agilent 7890A الموصول بمتحري مطياف الكتلة GC-MS.
- جني وتحضير الأوراق:
تمّ جني الأوراق في شهر كانون الأول من عام 2023 ميلادي لتحقيق الفائدة المثلى من الأوراق الناتجة أثناء جني ثمار النارنج [7]، من خمس مناطق (منطقة الميدان، منطقة البرامكة، ساحة الحريقة، شارع زياد بن أبي سفيان، شارع فائز منصور) في مدينة دمشق. تمّ تصنيف النبات في كلية الزراعة، جامعة دمشق. تمّ فصل الأوراق إلى قسمين: تمّ استخدام القسم الأول طازجاً بطريقة التقطير ببخار الماء بجهاز نمط Clevenger، أمّا القسم الثاني فقد تمّ تجفيفه في الظلّ لمدّة 7 أيام للحفاظ على سلامة الأوراق من التعفن ريثما يتم استخدامها في تحضير الخلاصة باستخدام جهاز سوكسليه.
- عملية استحصال الزيت الطيار:
- التقطير ببخار الماء باستخدام جهاز نمط Clevenger:
تمّت تجزئة الأوراق الطازجة إلى عدّة أجزاء ومن ثمّ تمّ وزن 40 غ من العينة النباتية ثمّ وضعت في جهاز التقطير وأُضيف لها 500 مل ماء مقطّر. استمرّت عملية التقطير لمدّة 3 ساعات. تمّ جمع الزيت الطيار وتجفيفه باستخدام سلفات الصوديوم اللامائية، وحفظه بدرجة حرارة 4 مئوية لحين إجراء التحليل [3].
- باستخدام جهاز سوكسليه Soxhlet:
تمّ وزن 15 غ من مسحوق الأوراق المجفّفة ثمّ وضعت في جهاز سوكسليه كما تمّت إضافة 500 مل من سائل الاستخلاص (أسيتون: نظامي الهكسان) بنسبة (1:1)، واستمرّت عملية الاستخلاص لمدّة 4 ساعات، بمتوسط درجة حرارة 50 مئوية تقريباً، تمّ جمع الخلاصة ومن ثمّ تكثيفها باستخدام جهاز المبخر الدوار بدرجة حرارة تتراوح ما بين 30-40 مئوية [1].
- حساب المردود:
تمّ حساب المردود بالاعتماد على المعادلة التالية [1]:
المردود% = (حجم العينة الناتجة (مل)/ وزن الأوراق (غ)) × 100
- التحليل باستخدام GC-MS [1]:
بدايةً تمّ تمديد العيّنتين باستخدام نظامي الهكسان وذلك بنسبة (1:10) (نظامي الهكسان: عينة)، ومن ثمّ تمّ حقن 1 µL من عينة الزيت الطيار المستحصل بطريقة التقطير ببخار الماء، و2 µL من عينة الخلاصة المحضّرة باستخدام جهاز سوكسليه، بعد تعذّر تحديد الأطياف الناتجة عن حقن 1 µL من عينة الخلاصة.
استُخدم GC-MS، حيث الحقن أوتوماتيكي ونمط الحقن Split less بدرجة حرارة 250 درجة مئوية للمحقن. استغرقت عملية التحليل 51.25 دقيقة. وقد تمّ تطبيق برنامج حراري مناسب، بدأت درجة حرارة الفرن من 40 درجة مئوية لمدة 3 دقائق، ثم رفعت درجة الحرارة بمعدل 4 درجات مئوية في الدقيقة حتى 150 درجة مئوية لمدّة دقيقة، ثمّ رفعت درجة الحرارة بمعدّل 8 درجات مئوية في الدقيقة حتّى 260 درجة مئوية واستمرّت عند هذه الدرجة لمدّة 6 دقائق. وذلك باستخدام غاز الهليوم بمعدّل تدفّق 1.5 مل في الدقيقة. حيث العمود من نوع DB-5MS، طول 30 m، قطر 0.25 mm، وسماكة الفيلم 0.25 µm. استُخدم كاشف مطياف الكتلة ودرجة حرارة مصدر الأيونات 290 درجة مئوية مع قدرة تأيّن 70 eV. وتمّ اعتماد مكتبة NIST MS 2.3 لتحديد الأطياف.
النتائج Results
نتائج المردود:
نتج بالتقطير ببخار الماء بواسطة جهاز نمط Clevenger زيت طيار بلون أصفر باهت وبمردودٍ يُقارب 0.5%، أمّا بالاستخلاص بجهاز سوكسليه فقد تم الحصول على خلاصة ذات لون أخضر غامق وبمردود يُقارب 40%.
نتائج التحليل باستخدام GC-MS:
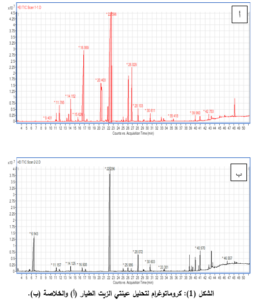
تمّ التعرف إلى 27 مركباً في عينة الزيت الطيار المستحصل بطريقة التقطير ببخار الماء والتي شكلت 99.99% من تركيبه، بينما تمّ التعرف إلى 33 مركباً في عينة الخلاصة المحضّرة باستخدام جهاز سوكسليه والتي شكلت 100% من تركيبه، (جدول 1، جدول 2) (شكل 1).
الجدول (1): مركبات الزيت الطيار الناتج عن التقطير ببخار الماء بواسطة جهاز نمط Clevenger.
| Peak | Compound | Retention Time | Area Sum% | Classification |
| 1 | trans-β-Ocimene | 9.401 | 0.04 | Monoterpenes |
| 2 | Sabinen | 11.013 | 0.08 | Monoterpenes |
| 3 | β-Pinene | 11.157 | 0.5 | Monoterpenes |
| 4 | β-Myrcene | 11.795 | 1.21 | Monoterpenes |
| 5 | D-Limonene | 13.338 | 0.25 | Monoterpenes |
| 6 | trans-β-Ocimene | 13.715 | 0.46 | Monoterpenes |
| 7 | β-Ocimene | 14.152 | 1.51 | Monoterpenes |
| 8 | Linalool oxide | 15.14 | 0.06 | Oxolanes |
| 9 | α-Terpinolene | 15.626 | 0.26 | Monoterpenes |
| 10 | Linalool | 16.869 | 18.04 | Monoterpenes |
| 11 | Neo-alloocimene | 17.507 | 0.15 | Monoterpenes |
| 12 | α-Terpineol | 20.403 | 10.02 | Monoterpenes |
| 13 | cis-Geraniol | 21.84 | 1.6 | Monoterpenes |
| 14 | Linalyl acetate | 22.596 | 49.79 | Monoterpenes |
| 15 | Geraniol | 22.634 | 2.72 | Monoterpenes |
| 16 | γ-Elemene | 25.032 | 0.27 | Sesquiterpenes |
| 17 | α-Terpinyl acetate | 25.594 | 0.13 | Monoterpenes |
| 18 | cis-Geranyl acetate | 26.1 | 4.1 | Monoterpenes |
| 19 | Geranyl acetate | 26.829 | 6.3 | Monoterpenes |
| 20 | Caryophyllene | 28.103 | 0.72 | Sesquiterpenes |
| 21 | Bicyclogermacrene | 30.611 | 0.53 | Sesquiterpenoids |
| 22 | Nerolidol | 32.918 | 0.21 | Sesquiterpenes |
| 23 | Germacrene D-4-ol | 33.389 | 0.15 | Sesquiterpenoid |
| 24 | α-Cadinol | 35.418 | 0.13 | Sesquiterpenoid |
| 25 | 7,9-Di-tert-butyl-1-oxaspiro(4,5)deca-6,9-diene-2,8-dione | 39.96 | 0.22 | Oxaspiro compound |
| 26 | n-Hexadecanoic acid | 40.902 | 0.24 | Fatty Acids |
| 27 | Phytol | 42.753 | 0.3 | Diterpene |
| Compound group (%) | ||||
| Monoterpenes | 97.16 | |||
| Sesquiterpenes | 2.01 | |||
| Other | 0.82 | |||
| Total | 99.99 |
|
الجدول (2): مركبات الخلاصة الناتجة عن الاستخلاص بطريقة سوكسليه
| Peak | Compound | Retention Time |
Area Sum% |
Classification | |
| 1 | Toluene | 4.138 | 0.05 | Aromatic Hydrocarbon | |
| 2 | Mesityl oxide | 4.879 | 0.08 | Hexanones | |
| 3 | 2-Pentanone, 4-hydroxy- | 5.666 | 0.47 | Pentanones | |
| 4 | 2-Pentanone, 4-hydroxy-4-methyl- | 6.543 | 21.48 | Pentanones | |
| 5 | 2-Hexenal | 6.699 | 0.11 | Aldehydes | |
| 6 | 3-Hexen-1-ol, (Z)- | 6.901 | 0.07 | Hexanols | |
| 7 | 2-Heptanol, acetate | 9.014 | 0.08 | 1-Methylhexyl acetate | |
| 8 | α-Pinene | 9.413 | 0.04 | Monoterpenes | |
| 9 | β-Phellandrene | 11.016 | 0.1 | Monoterpenes | |
| 10 | β-Pinene | 11.157 | 0.52 | Monoterpenes | |
| 11 | β-Myrcene | 11.784 | 0.54 | Monoterpenes | |
| 12 | trans-β-Ocimene | 13.715 | 0.12 | Monoterpenes | |
| 13 | cis-β-Ocimene | 14.125 | 0.86 | Monoterpenes | |
| 14 | Linalool | 16.508 | 0.67 | Monoterpenes | |
| 15 | Triethyl phosphate | 17.177 | 0.52 | Organophosphates | |
| 16 | Linalyl acetate | 22.296 | 56.01 | Monoterpenes | |
| 17 | γ-Elemene | 24.99 | 0.4 | Sesquiterpenes | |
| 18 | cis-Geranyl acetate | 25.986 | 0.51 | Monoterpenes | |
| 19 | Geranyl acetate | 26.67 | 0.4 | Monoterpenes | |
| 20 | Caryophyllene | 28.072 | 2.82 | Sesquiterpenes | |
| 21 | (E)-β-Famesene | 29.186 | 0.24 | Sesquiterpenes | |
| 22 | Humulene | 29.284 | 0.21 | Sesquiterpenes | |
| 23 | Bicyclogermacrene | 30.603 | 1.09 | Sesquiterpenoids | |
| 24 | Germacrene D-4-ol | 33.381 | 0.23 | Sesquiterpenoid | |
| 25 | Tetradecanoic acid | 37.748 | 0.16 | Fatty Acids | |
| 26 | Neophytadiene | 38.732 | 1.59 | Diterpene | |
| 27 | cis-Phytol | 39.427 | 0.44 | Diterpene | |
| 28 | 7,9-Di-tert-butyl-1-oxaspiro(4,5)deca-6,9-diene-2,8-dione | 39.975 | 1.54 | Oxaspiro compound | |
| 29 | n-Hexadecanoic acid | 40.97 | 3.92 | Fatty Acids | |
| 30 | Phytol | 42.76 | 0.68 | Diterpene | |
| 31 | Linoleic acid | 43.3 | 3 | Fatty Acids | |
| 32 | Oleic Acid | 43.57 | 0.58 | Fatty Acids | |
| 33 | Octadecanoic acid, 2,3-bis(acetyloxy)propyl ester | 46.557 | 0.47 | Triglycerides | |
| Compound group (%) | |||||
| Monoterpenes | 59.77 | ||||
| Sesquiterpenes | 4.99 | ||||
| Other | 35.24 | ||||
| Total | 100 | ||||
المناقشة Discussion
اتفق مردود الزيت الطيار المستحصل بطريقة التقطير ببخار الماء مع الدراسة الهندية [8] ومع مردود الزيت الطيار المستحصل من الأوراق متوسطة النضج في الدراسة التونسية [9]، كما تقارب من مردود الزيت الطيار المستحصل في الدراسة الجزائرية [3]، ومردود الزيت المستحصل بالتقطير ببخار الماء في الدراسة المصرية [4].
بينما تفوق مردود الزيت الطيار المستحصل في هذه الدراسة على مردود الزيت الطيار المستحصل في دراسات [10-12] والتي أُجريت في تونس، تايلاندا، ومصر، كما تفوق على مردود الزيت المستحصل من الأوراق الناضجة في الدراسة التونسية [9] ومردود الزيت الطيار المستحصل بطريقتي الجرف ببخار الماء والتقطير ببخار الماء بمساعدة الأمواج المكروية في الدراسة المصرية [4]، وكان أقل من المردود في دراسات أُجريت في اليونان ومصر والمغرب [13-15] ومردود الزيت المستحصل من الأوراق الفتية في الدراسة التونسية [9]. يمكن تفسير الاختلاف بالمردود باختلاف العوامل البيئية و/أو الوراثية [3].
على الرغم من توجه الدراسة العراقية [16] إلى تحضير خلاصة باستخدام جهاز سوكسليه، إلا أنه لم يُذكر مردود الخلاصة بالإضافة إلى الاكتفاء بالكشف الكيميائي الكيفي عن المستقلبات الثانوية حيث لم تتبين إيجابية وجود التربينوئيدات ولم يُكشف عن وجود التربينات.
للمقارنة بين طريقتي الاستخلاص تمّ تحديد المركبات الناتجة باستخدام جهاز الاستشراب الغازي الموصول بمتحري مطياف الكتلة، تشير نتائج هذه الدراسة إلى وجود تشابه في عدد من المركبات الكيميائية الطيارة بين الطريقتين حيث تمّ تحديد 13 مركباً مشتركاً مع وجود تباينات في نسب هذه المركبات بين العيّنتين، والتي توافرت في الزيت الطيار بنسبة 82.87%، وبنسبة 69.45% في الخلاصة.
المركبات الرئيسية في عينة الزيت الطيار Linalyl acetate، Linalool، α-Terpineol، Geranyl acetate، Geraniol. أما المركبات الرئيسية في عينة الخلاصة المحضرة بطريقة سوكسليه Linalyl acetate، 2-Pentanone, 4-hydroxy-4-methyl-، n-Hexadecanoic acid، Linoleic acid، Caryophyllene.
المركب الأكثر وفرة هو خلّات الليناليل بكلٍّ من العيّنتين، وقد توافر بنسبة 49.79% في عينة الزيت الطيار، وبنسبة 56.01% في عينة الخلاصة.
يمتلك خلّات الليناليل خصائص مُهدّئة ومزيلة للقلق ومسكنة للألم [17]، وقد أظهر فعالية مضادة لإدرار البول لدى فئران التجربة [18]. بالإضافة إلى فعاليات علاجية قلبية وعائية لدى حيوانات التجربة [19]. يُعدّ التطبيق الموضعي لمركب خلّات الليناليل أفضل من تناوله عن طريق الفم، حيث يتحول فوراً إلى لينالول في عملية الهضم [20].
يمتلك مركب لينالول فعاليّات حيويّة بما في ذلك مضاد للسرطان، مضاد للجراثيم، يحمي الأعصاب neuroprotective، مزيل للقلق، مضاد للاكتئاب، مضاد للالتهاب، مضاد للإجهاد anti-stress، واقي للكبد وللكلى وللرئتين hepatoprotective, renal protective, and lung protective [21].
معظم المركبات المحدّدة في عينة الزيت الطيار عبارة عن تربينات أحادية وأحادية ونصف (99.17%)، بينما شكلت التربينات الأحادية والأحادية والنصف (64.76%) في عينة الخلاصة المحضرة بطريقة سوكسليه.
بعض المركبات الطيارة المحددة في عينة الخلاصة المحضرة بطريقة سوكسليه لم تُحدد في عينة الزيت الطيار وتتضمن (α-Pinene, β-Phellandrene, (E)-β-Famesene, Humulene, & Neophytadiene)، حيث يتمتع مركب Neophytadiene بفعاليات مسكنة للألم، خافضة للحرارة، مضادة للالتهاب، مضادة للجراثيم، ومضادة للأكسدة [22]. كما أن مركب (E)-β-Famesene بالإضافة إلى فعاليته المضادة للأكسدة والمضادة للجراثيم والفطريات له فعالية مضادة للسرطان ودور في حماية الأعصاب [23]. بينما يمتلك مركب Humulene فعاليات مضادة للالتهاب، مضادة للجراثيم والطفيليات، مثبطة للنمو الخلوي، مضادة للحساسية، فعالية محاكية للقنب (مضادة لاستقبال الألم) ودور في حماية السبيل الهضمي [24].
يعود الاختلاف بالتركيب الكيميائي ونسب توافر المركبات المشتركة ما بين الطريقتين إلى اختلاف طريقة الاستخلاص المتبعة وشروط الاستخلاص [1,3].
اتفقت هذه الدراسة من حيث المركبات الثلاثة الأكثر وفرة في الزيت الطيار المستحصل بالتقطير ببخار الماء بواسطة جهاز نمط Clevenger مع نتائج الدراسة المصرية [4] فيما يتعلق بالزيت الطيار المستحصل بطريقتي التقطير ببخار الماء والتقطير ببخار الماء بمساعدة الأمواج المكروية ومع نتائج دراسات [3,13,15] والتي تم إجراؤها في اليونان، المغرب، والجزائر. تؤكد هذه النتائج انتماء الزيت الطيار الخاص بأوراق النارنج المستزرع في دمشق إلى النمط الكيميائي لينالول/ خلّات الليناليل، ويُذكر بأنه النمط الأكثر انتشاراً [3]. يتأثر تركيب الزيت الطيار بعدّة عوامل منها ظروف النمو، المناخ، نوع التربة، الارتفاع altitude، الأساليب الزراعية، مرحلة النمو، الجزء النباتي، ووقت الحصاد [25].
الاستنتاجات Conclusions
يمكن أن نستنتج بأن الزيت الطيار لأوراق النارنج يمثّل مصدراً هاماً للمركبات العطرية الطيارة لاسيما مركب خلات الليناليل. لوحظ اتفاق طريقتي الاستخلاص من حيث المركب الطيار الأكثر وفرة بينما تفردت كل منهما بتركيب مميز من المركبات الطيارة مع وجود بعض التشابه. كانت أحاديات التربين هي المركبات الرئيسية التي تم تحديدها بكل من الطريقتين. وبالتالي، نستنتج إمكانية استخلاص مركب خلات الليناليل بكلا الطريقتين (التقطير ببخار الماء والاستخلاص بجهاز سوكسليه)، أما للحصول على المركبات الطيارة بمنعزل عن غيرها من المركبات فطريقة التقطير ببخار الماء هي الأفضل.
قائمة الاختصارات List of abbreviations
جهاز الاستشراب الغازي الموصول بكاشف التأين باللهب: GC-FID.
جهاز الاستشراب الغازي الموصول بمتحري مطياف الكتلة: GC-MS.
الموافقة الأخلاقية والموافقة على المشاركة Ethics approval and consent to participate
غير قابل للتطبيق.
تضارب المصالح Conflict of interests
يقرّ المؤلفون بعدم وجود مصالح متضاربة.
التمويل Funding
هذا البحث ممول من قبل جامعة دمشق وفق رقم الممول 501100020595.
مساهمات المؤلفين Authors’ contributions
لوليا الحواط: الكتابة – المسودة الأصلية، المنهجية، تنسيق البيانات. لؤي العلان: الكتابة – المراجعة والتحرير، الإشراف، الموارد، المنهجية.
المراجع :- Fagbemi KO, Aina DA, Olajuyigbe OO. Soxhlet Extraction versus Hydrodistillation Using the Clevenger Apparatus: A Comparative Study on the Extraction of a Volatile Compound from Tamarindus indicaThe Scientific World Journal. 2021;5961586. https://doi.org/10.1155/2021/5961586.
- Odeh F, Rahmo A, Alnori AS, Chaty ME. THE CYTOTOXIC EFFECT OF ESSENTIAL OILS CITRUS AURANTIUM PEELS ON HUMAN COLORECTAL CARCINOMA CELL LINE (LIM1863). Journal of Microbiology, Biotechnology and Food Sciences. 2012;1:6.
- Oulebsir C, Mefti-Korteby H, Djazouli ZE, Zebib B, Merah O. Essential Oil of Citrus aurantium Leaves: Composition, Antioxidant Activity, Elastase and Collagenase Inhibition. Agronomy. 2022;12:6. https://doi.org/10.3390/agronomy12061466.
- Elhawary EA, Nilofar N, Zengin G, Eldahshan OA. Variation of the essential oil components of Citrus aurantium leaves upon using different distillation techniques and evaluation of their antioxidant, antidiabetic, and neuroprotective effect against Alzheimer’s disease. BMC Complement Med Ther. 2024;24:73. https://doi.org/10.1186/s12906-024-04380-x.
- Mohammed HH, Laftah WA, Noel Ibrahim A, Che Yunus MA. Extraction of essential oil from Zingiber officinale and statistical optimization of process parameters. RSC advances. 2022;12:8. https://doi.org/10.1039/d1ra06711g.
- Phong WN, Gibberd MR, Payne AD, Dykes GA, Coorey R. Methods used for extraction of plant volatiles have potential to preserve truffle aroma: A review. Comprehensive reviews in food science and food safety. 2022;21:2. https://doi.org/10.1111/1541-4337.12927.
- Wang GH, Huang CT, Huang HJ, Tang CH, Chung YC. Biological Activities of Citrus aurantiumLeaf Extract by Optimized Ultrasound-Assisted Extraction. Molecules. 2023;28:21. https://doi.org/10.3390/molecules28217251.
- Nidhi P, Rolta R, Kumar V, Dev K, Sourirajan A. Synergistic potential of Citrus aurantium essential oil with antibiotics against Candida albicans. Journal of ethnopharmacology. 2020;262. https://doi.org/10.1016/j.jep.2020.113135.
- Mejri H, Khetatfa T, Aidi Wannes W, Smaoui A, Saidani Tounsi M. Histochemistry, chemical composition and antioxidant activity of Citrus aurantium essential oil during leaf development. Journal of Essential Oil Research. 2022;34:4. https://doi.org/10.1080/10412905.2022.2067255.
- Ben Bnina E, Hajlaoui H, Chaieb I, Daami- Remadi M, Ben Said M, Ben Jannet H. Chemical composition, antimicrobial and insecticidal activities of the Tunisian Citrus aurantium essential oils. Czech Journal of Food Sciences. 2019;37:2. https://doi.org/10.17221/202/2017-CJFS.
- Pratama MD, Premjet S, Choopayak C, Premjet D. Chemical composition and antioxidant activities of essential oil from Somsa (Citrus aurantium) in Phitsanulok province, Thailand. Asia-Pacific Journal of Science and Technology. 2019;24:1.
- Khalid KA, Ahmed AMA, El-Gohary AE. Effect of growing seasons on the leaf essential oil composition of Citrus species that are cultivated in Egypt. Journal of Essential Oil Research. 2020;32:4. https://doi.org/10.1080/10412905.2020.1749947.
- Eirini S, Paschalina C, Loannis T, Kortessa DT. Effect of Drought and Salinity on Volatile Organic Compounds and Other Secondary Metabolites of Citrus aurantium Natural product communications. 2017;12:2.
- Okla MK, Alamri SA, Salem MZ, Ali HM, Behiry SI, Nasser RA, Alaraidh IA, Al-Ghtani SM, Soufan W. Yield, Phytochemical Constituents, and Antibacterial Activity of Essential Oils from the Leaves/Twigs, Branches, Branch Wood, and Branch Bark of Sour Orange (Citrus aurantium). Processes. 2019;7:6. https://doi.org/10.3390/pr7060363.
- El Kharraf S, Faleiro ML, Abdellah F, El-Guendouz S, El Hadrami EM, Miguel MG. Simultaneous Hydrodistillation-Steam Distillation of Rosmarinus officinalis, Lavandula angustifolia and Citrus aurantium from Morocco, Major Terpenes: Impact on Biological Activities. Molecules. 2021;26:18. https://doi.org/10.3390/molecules26185452.
- AL Ani KA, Minnat TR, Jalyl OK. Phytochemical Analysis and Inhibitory Effect of Citrus aurantium (Bitter Orange) Leaves on some Bacterial Isolates in vitro. Diyala J Pure Sci. 2017;13.
- Hashimoto M, Takahashi K, Unno T, Ohta T. Linalyl acetate exerts analgesic effects by inhibiting nociceptive TRPA1 in mice. Biomedical research. 2024;45:3. https://doi.org/10.2220/biomedres.45.125.
- Rafique F, Mushtaq MN, Ahmed H, Younis W. Evaluation and estimation of diuretic activity of the linalyl acetate in the rats. Brazilian journal of biology = Revista brasleira de biologia. 2024;83. https://doi.org/10.1590/1519-6984.277354.
- Jugreet BSh, Mahmoodally MF. Pharmacological properties of essential oil constituents and their mechanisms of action. In: Swamy MK, editor. Plant-derived Bioactives Chemistry and Mode of Action. Springer; 2020. p. 387-415.
- Sadgrove NJ, Padilla-González GF, Leuner O, Melnikovova I, Fernandez-Cusimamani E. Pharmacology of Natural Volatiles and Essential Oils in Food, Therapy, and Disease Prophylaxis. Front Pharmacol. 2021;12. https://doi.org/10.3389/fphar.2021.740302.
- An Q, Ren JN, Li X, Fan G, Qu SS, Song Y, Li Y, Pan SY. Recent updates on bioactive properties of linalool. Food & function. 2021;12:21. https://doi.org/10.1039/d1fo02120f.
- Adem Endris Y, Abdu KY, Abate SG. Investigation of bioactive phytochemical compounds of the Ethiopian medicinal plant using GC-MS and FTIR. Heliyon. 2024;10:15. https://doi.org/10.1016/j.heliyon.2024.e34687.
- Russo EB, Marcu J. Cannabis Pharmacology: The Usual Suspects and a Few Promising Leads. Advances in pharmacology. 2017;80. https://doi.org/10.1016/bs.apha.2017.03.004.
- Dalavaye N, Nicholas M, Pillai M, Erridge S, Sodergren MH. The Clinical Translation of α-humulene – A Scoping Review. Planta medica. 2024;90:9. https://doi.org/10.1055/a-2307-8183.
- Moghaddam M, Mehdizadeh L. Chemistry of essential oils and factors influencing their constituents. In: Grumezescu AM, Holban AM, editors. Soft Chemistry and Food Fermentation. Elsevier; 2017. p. 379–419. https://doi.org/10.1016/b978-0-12-811412-4.00013-8.