دراسة التَّأثيرات الوقائيَّة للأتورفاستاتين في القرحة المَعِديَّة المُحدَثة بالأليندرونات عند جرذان التَّجربة
2025-04-26 | المجلد السابع العدد الخامس – المجلد السابع | مقالات بحثيةدينا ماهر شاهين | شادي مصطفى حمصي
الملخص
يُعَدُّ الأليندرونات أحدَ أكثرِ البيسفوسفونات استخداماً للعلاج والوقاية من هشاشة العظام، تُعَدُ استخداماتُهُ السَّريريَّة محدودةً بسبب الآثار الجانبيَّة، بما في ذلك القرحة المَعِديَّة التي يُعتَقد أنَّها ناجمةٌ عن الإجهاد التّأكسدي والالتهاب، يُعَدُّ دواء الأتورفاستاتين والَّذي يثبِّط تصنيعَ الكوليسترول ويُستعمَلُ للوقاية من الأحداث القلبيَّة الوعائيَّة الضائرة.. مِنَ الأدوية التي أظهرت مُسبقاً فعاليَّةً مضادَّةً للأكسدة وكابحةً للالتهاب، لذلك هدفت دراستنا إلى اختبار التَّأثير الوقائيِّ لدواء الأتورفاستاتين على القرحة المَعِديَّة المُحدَثة بالأليندرونات عند الجرذان.
تمَّ تقسيم 28 جرذاً من نوع Albino Wistar إلى أربع مجموعاتٍ:
6 جرذانٍ في المجموعة الشَّاهدة (NC) الَّتي تمَّ إعطاءُها سيروم ملحي بحجم 10 مل/كغ/اليوم.
8 جرذانٍ في المجموعة المَرَضيَّة (ALD) التي تمَّ إعطاءها الأليندرونات بجرعة 20 ملغ/كغ/اليوم.
8 جرذانٍ في المجموعة الوقائيَّة (ALD+ATO) التي أُعطِيَت الأتورفاستاتين بجرعة 10 ملغ/كغ/اليوم بالتزامن مع المجموعتين السَّابقتين، وكذلك الألندرونات بجرعة 20 ملغ/كغ/اليوم بعد ساعةٍ من إعطاء الأتورفاستاتين.
6 جرذانٍ في مجموعة الأتورفاستاتين لوحده (ATO) التي أُعطِيَت الأتورفاستاتين فقط بجرعة 10 ملغ/كغ/اليوم.
أُعطِيَت جميع المواد السَّابقة فمويَّاً لمدَّة 7 أيامٍ، تمَّت التَّضحية بالجرذان، ومِنْ ثَمَّ دُرِسَت المعالمُ التَّاليةُ: الفروقاتُ بين أوزان الجرذان في يومٍ التّضحية وبداية التجربة، الإجهاد التأكسديُّ (مستويات أنزيم المالون ثنائيِّ الألدهيد)، الفحص العَيانيُّ والنسيجيُّ.
أظهرت النَّتائج أنَّ إعطاء الأتورفاستاتين قبل إحداث القرحة بالأليندرونات أدَّى إلى الوقاية مِنَ الأذيَّة المَعِديَّة عيانيَّاً ونسيجيَّاً، في حين لم يظهر تأثيرٌ واضحٌ على الشدَّة التأكسديَّة النَّاجمة عن إعطاء الأليندرونات، والَّتي قد تكون واحدةً من العوامل الوقائيَّة، ولكن قد لا تكون الأهمَّ.
كلمات مفتاحية : القرحة المَعِديَّة، الأليندرونات، الأتورفاستاتين، الشّدَّة التَّأكسديَّة ,Gastric ulcer, Alendronate, Atorvastatin, Oxidative Stress
المقدمة Introduction
يشمل مرض القرحة الهضميَّة كُلَّاً مِنَ القرحةِ المَعِديَّة Gastric Ulcer، وقرحةِ الاثني عشر Duodenal Ulcer، وهي عبارةٌ عن أذيَّةٍ تخترق طبقة الغِلالة العضليَّة muscularis mucosae في كلٍّ مِنْ مخاطيَّة المعدة أو الاثني عشر على التَّرتيب (1)، يُقدَّر معدَّلُ انتشار مرض القرحة الهضميَّة بين السكَّان عامَّةً بحوالي 5-10%، ومعدَّلُ الإصابة به 0.1-0.3% سنويَّاً (2).
تتضمَّنُ الآليَّة الإمراضيَّة للقرحة الهضميَّة فقدانَ التَّوازن بين إفراز الحمض وآليَّات الدِّفاع المخاطيَّة، تشيرُ دراساتٌ سابقةٌ إلى أنَّ 90% من قرحة الاثني عشر، و70% من قرحة المعدة.. مرتبطةٌ بعدوى المَلْوِيَّة البوابيَّة Helicobacter pylori (3)، كما يمكن أن تؤدِّي العديدُ من الأدوية، بما في ذلك الأدويةُ المضادَّة للالتهابات غير الستيروئيديَّة Non-Steroidal Anti-inflammatory Drugs (NSAIDs)، ومكمِّلاتُ البوتاسيوم، والبيسفوسفونات، والدوكسيسيكلين.. إلى زيادة تطوُّر القرحات الهضميَّةِ (4)، إضافةً إلى ذلك يلعب إنتاجُ جذور الأوكسجين التفاعليَّة Reactive oxygen species (ROS) والشِّدَّةُ التأكسديَّة دوراً رئيسيَّاً في ظهور وتطوُّر القرحات الهضميَّة (5)، يُستخدَمُ المالون ثنائي الألدهيد MDA على نطاقٍ واسعٍ كعلامة حيويَّةٍ لتقييم الإجهاد التأكسديِّ في المجالات الطبيَّةِ الحيويَّة (6).
يعتمد العلاج الدَّوائيُّ على تصحيح هذا الخلل: إمَّا عن طريق تحسين الدِّفاعات المخاطيَّة باستخدام أدويةٍ، مثل: السكرالفات
Sucralfate، والبزموت Bismuth، ومُضاهيات البروستاغلاندين Prostaglandins Analogues، أو المواد المعدِّلة للحمض، مثل: مضادّات الحموضة Antacids، أو تقليل إفراز الحمض باستخدام مُناهضات مستقبل الهيستامين H2 H2-receptor Antagonists، أو مثبِّطاتٍ مضخّة البروتون Proton Pump Inhibitors (7).
يُصنَّف الأتورفاستاتين Atorvastatin (ATO) من عائلة الستاتينات، ويستخدم كدواءٍ خافضٍ للشُّحوم يُؤخذ فمويَّاً، يعمل ATO كمثبِّطٍ تنافسيٍّ صنعي عكوس لأنزيم 3-hydroxy-3-methylglutaryl-coenzyme A (HMG- CoA) reductase، ممَّا يؤدِّي إلى انخفاضٍ في تصنيع الكوليسترول (8)، يمكن للستاتينات إضافةً إلى فعاليَّتها الخافضة للشُّحوم أن تُغيِّرَ مساراتٍ استقلابيَّةً متعدِّدةً في أنسجةٍ وأعضاءٍ مختلفةٍ، ممَّا يؤدِّي إلى تحقيق تأثيراتٍ علاجيَّةٍ مفيدةٍ في أمراضٍ مختلفةٍ، فهي تملك العديد من التَّأثيرات المفيدة الأخرى، مثل: التَّأثيراتِ المضادَّةِ للالتهاب، والمضادَّةِ للأكسدة، والمضادَّةِ للموت الخلويِّ المبرمج (9)، وقد تمَّت دراسة تأثيراته المضادَّةِ للأكسدة والمضادَّةِ للالتهاب بشكلٍ خاصٍّ في القرحة المَعِديَّة المحرضة بالإندوميتاسين (10).
لكنَّ تأثيراتِ دواء الأتورفاستاتين في الوقاية مِنَ القرحة المَعِديَّة المحدثة بالأليندرونات لم تُدرسْ بعدُ، على الرغم من أنَّ الشِّدَّة التَّأكسديَّة هي مِنَ الآليَّات الرئيسيَّةِ في القرحة المَعِديَّة المحدَثة بالأليندرونات الَّتي تَحُدُّ من استعماله، لذلك هدفت دراستنا إلى تقصِّي التَّأثيرات الوقائيَّة لدواء الأتورفاستاتين على القرحة المَعِديَّة المحدثة بالأليندرونات عند جرذان التَّجربة.
المواد والطرائق Materials and Methods
مكان إجراء الدراسة:
أُجريت الدراسة في كليَّة الصيدلة بجامعة دمشقَ.
المواد والكواشف والأدوات:
دواءُ الأليندرونات بشكل مسحوقٍ جاهزٍ للانحلال، دواءُ الأتورفاستاتين بشكل مسحوقٍ، سيروم ملحي 0.9%، ثنائي إيتيل الإيثر، فورمول 10%، وقاء الفوسفات، حمض التيوباربيتوري (TBA)، حمض الخلِّ مثلث الكلور (TCA)، حمض كلور الماء (HCl)، أنابيب تنبيب فمويِّ، سيرنغات الانسولين، ممص ميكروني، ميزان الكتروني، المثفلة الدوارة، مجمدة (-80 °C)، جهاز المجانسة بالأمواج فوق الصوتيَّة، جهاز سبيكتروفوتومتر.
إجراءات التجربة:
تمَّ العمل على 28 جُرْذَاً بعد الانتظار لمدَّة سبعة أيَّامٍ حتَّى تتأقلم الجرذانُ في حواضن حيوانات التجربة مع الظروف المحيطة، حيث وُضِعَتْ في أقفاصٍ ضمن غرفةٍ جيِّدةِ التهوية والإضاءة معرَّضةٍ لـ 12/12 ساعةٍ من حلقة ضوء/ظلام ودرجة حرارة (23 ± 2ºC)، مع سهولة الوصول إلى الطعام وماء الشرب، وبعد ذلك قُسِّمَتْ إلى أربع مجموعاتٍ تمَّ اختيار أفرادها بشكلٍ عشوائيٍّ، حيث تحوي المجموعتين الأُولى والرَّابعة 6 جرذانٍ، والمجموعتين الثَّانية والثَّالثة 8 جرذانٍ، بحيثُ لا يكون هناك أكثرَ مِنْ 4 جرذانٍ في القفص الواحد على النَّحو الآتي:
المجموعة الشَّاهدة الطبيعيَّة Natural Control group (NC): نُبِّبَت هذه المجموعة فمويَّاً بالسيروم الملحيِّ يوميَّاً لمدَّة 7 أيَّامٍ (11)، بحجم 10 ml/kg/day (12).
المجموعة المَرَضيَّة Alendronate group (ALD): نُبِّبَت المجموعة فمويَّاً بالسيروم الملحيِّ يوميَّاً لمدَّةِ 4 أيَّامٍ، ثمَّ نُبِّبَت في اليوم الرَّابع بالأليندرونات بجرعة 20 mg/kg/day لمدَّة 4 أيَّام، وقد تَمَّ اختيار هذه الجرعة بالاعتماد على دراساتٍ سابقةٍ أكَّدت أنَّ إعطاء الأليندرونات للجرذان بالجرعة السَّابقة يسبِّبُ أذيَّةً مَعِديَّةً واضحةً (13)، تعادل الجرعة المستخدمة لإحداث الأذيَّة 20 ضعفَ الجرعة المقاربة لها عند البشر والمستخدمةِ لعلاج هشاشة العظام (10 ملغ/اليوم).
المجموعة الوقائيَّة Alendronate+Atorvastatin group (ALD+ATO): تلقَّت كلَّاً من الأتورفاستاتين والأليندرونات يوميَّاً، حيث نُبِّبَت هذه المجموعة أوَّلاً بالأتورفاستاتين بجرعة 10 mg/kg/day لمدَّة 7 أيَّامٍ فمويَّاً (10)، وفي اليوم الرَّابع بعد الانتظار لمدَّةِ ساعةٍ نُبِّبَت بالأليندرونات بجرعة 20 mg/kg/day لمدَّة 4 أيَّام.
مجموعة الأتورفاستاتين Atorvastatin group (ATO):
وهي المجموعة التي تلقَّت الأتورفاستاتين لوحده، حيث نُبِّبَت هذه المجموعة بالأتورفاستاتين بجرعة 10 mg/kg/day لمدَّة 7 أيام فمويَّاً، استند اختيار جرعة الأتورفاستاتين إلى البيانات المذكورة في الدراسات السَّابقة، عند الإنسان تكون جرعة الأتورفاستاتين اللَّازمة لخفض كوليسترول البروتين الشَّحميِّ منخفضةَ الكثافة LDL-C بنسبة 30% هي 10 ملغ/اليوم (0.15 ملغ/كغ/اليوم)، والجرعةُ القصوى المستخدمةُ في العلاج هي 1 ملغ/كغ/اليوم. كما تشير دراسات الحركيَّة الدوائيَّة في القوارض إلى أنَّ هناك حاجةٌ إلى استخدام جرعاتٍ أكبرَ من الستاتين لتحقيق تراكيز فعالةٍ مماثلةٍ، اختبرنا في هذه الدراسة جرعةً أعلى بمقدار 10 أضعافٍ مِنَ الجرعة العلاجيَّة القصوى (14).
تمَّت مراقبة الجرذان يوميَّاً لمراقبة أيِّ تبدُّلٍ في تناولها للطعام وشربها للماء، وتمَّ تسجيل الأوزان يوميَّاً مِنْ أجل مراقبةِ تغيُّر الوزن ودراسةِ الفروقات بين أوزان الجرذان في يوم التَّضحية وبداية التَّجربة، ومن أجل احتساب الجرعات بالاعتماد على الوزن.
التَّضحية بالحيوانات:
تمَّ تخدير الجرذان في نهاية التَّجربة باستخدام حجرة التَّخدير المشبَعة بثنائي إيتيل الإيتر لمدة 5-10 دقائق، ثمَّ تمَّت التَّضحية بالجرذان من خلال تشريحهم عبر فتح البطن مِنْ أجل استئصال المعدة، ثمَّ تمَّ عزلُ المعدة وفتحُها على طول الانحناء الأكبر، وغُسِّلت جيِّداً بوساطة السِّيروم الملحيِّ Nacl 0.9%))، ثمَّ ثُبِّتَت على لوحٍ فلِّينيٍّ، وفُحِصَت عَيانيَّاً macroscopic وذلك لحساب مَنْسَب القرحة، ثمَّ قُسِّمت المعدة إلى قسمين: قسمٌ تمَّ تثبيته بالفورمول 10% مِنْ أجل الدِّراسة النَّسيجيَّة والفحص المجهريِّ microscopic وقسمٌ تمَّ وضعه في أنابيب إبيندورف المتحمِّلة للبرودة، وتمَّ حفظه في المجمّدة بدرجة حرارةٍ (-80°C) مِنْ أجل إجراء المعايرة الكيميائيَّة الحيويَّة لاحقاً، وقبل إجراء المعايرة تمَّت مجانسة العيِّنات النسيجيَّة مع وقاء الفوسفات باستخدام جهاز المجانسة الموجود في هيئة الطاقة الذريَّة، وتمَّ الحصول على جُناسةٍ بتركيز 10%.
المعالم المدروسة لتقييم درجة الأذيَّة المَعِديَّة:
الفروقات بين أوزان الجرذان في يوم التَّضحية واليوم الأوَّل من التَّجربة Weight difference between the final and the first day:
تمَّت دراسة الفرق بين وزن الجُرْذِ في يوم التَّضحية ووزنه في بداية التَّجربة (اليوم الأوَّل في تجريع الجرذان) كَمَعلَمٍ غير مباشرٍ للأذيَّةِ المَعِديَّة.
الفحص العَياني Macroscopic examination:
تمَّ حساب مَنْسَب القرحة Ulcer Index لكلِّ مجموعةٍ باستخدام الطريقة التَّالية (15):
بعد الحصول على عدد القرحات لكلِّ جرذٍ، وحساب متوسَّط عدد القرحات للجرذان (UN)، حُسِبَت درجة الشِّدَّة لكلِّ جُرْذٍ بجمع نقاط المعالم وفقاً للمقياس التَّالي، وحُسِبَ متوسِّط شدَّة القرحات للجرذان (US):
0 = معدةٌ بلونٍ طبيعيٍّ Normal colored stomach
0.5 = معدةٌ بلونٍ أحمرَ Red coloration
1.0 = قرحاتٌ بقعيَّةٌ Spot ulcer
1.5 = شرائطُ نزفيَّةٌ Hemorrhagic streak
2.0 = قرحاتٌ عميقةٌ Deep ulcer
3.0 = انثقاب Perforation
Ulcer Index (UI) = UN + US + (UP/10)
(UP): النسبة المئويَّة للحيوانات المصابة بالقرحة.
فحص معالم التَّشريح المرضي Histopathological examination:
تمَّت الدراسة في مخبر التَّشريح المرضيِّ في مشفى الأسد الجامعيِّ، حيث جُفِّفَت العيِّناتُ النَّسيجيَّة الموضوعة في الفورمول باستخدام الإيتانول ودُمِجَت في البارافين، ثمَّ قُطِّعَت لمقاطعَ بسماكة 5 µm، ولوِّنت بالهيماتوكسيلين والإيوزين؛ لإجراء الفحص النسيجيِّ تحت المجهر الضوئيِّ (16).
تمَّ تقييم المقاطع في جميع الشَّرائح المجهريَّة تحت المجهر الضَّوئي وفقاً للمعايير الموضَّحة في الأدبيَّات مِنْ قبلُ، حيث تمَّ إعطاء المعالم التَّالية، وهي: خسارةُ الظَّهارة السَّطحيَّة، والنَّزفُ، واحتقانُ المخاطيَّة، وأذيَّةُ الخلايا الغديَّة، وارتشاحُ الخلايا الالتهابيَّة. درجةً نسيجيَّةً مَرَضِيَّةً على النّحو التّالي: 0: لا يوجد، 1: خفيفٌ، 2: متوسِّطٌ، 3: شديدٌ (17).
معايرة أنزيم المالون ثنائي الألدهيد Malondialdehyde (MDA) assay:
مبدأ المعايرة: يُعَدُّ المالون ثنائيِّ الألدهيد MDA أحدَ نواتج فوق أكسدة الليبيدات lipid peroxidation، ويمثِّلُ القياسُ الكميُّ لـ MDA مؤشِّراً جيِّداً لفعاليَّة فوق أكسدة الليبيدات، ويتمُّ القياس الكمِّيُّ عبر التَّفاعل اللونيِّ مع حمض التيوباربيتوري TBA (18).
باختصارٍ، تمَّ مزج 0.5 مل مِنَ الجُناسة النَّسيجيَّة المَعِديَّة (10%) مع 2 مل مِنَ الكاشف المكوَّنِ مِنْ حمضِ الخلِّ مثلث الكلور TCA (15% w/v)، وحمضِ التيوباربيتوري TBA (0.375% w/v)، وحمضِ كلور الماء HCl (0.25N)، ومِنْ ثَمَّ سُخِّنَ المزيجُ في حمَّامٍ مائيٍّ غالي لمدَّة 15 دقيقةٍ، بعد ذلك تمَّ تبريدُهُ وتثفيلُهُ، تمَّت قراءة امتصاص السَّائل الطَّافي للعيِّنات باستخدام جهاز السبيكتروفوتومتر عند طول موجة (532 nm) (19).
ومن ثَمَّ تَمَّ حساب تركيز MDA باستعمال معامل الامتصاص المولاري (1.56 × 105 M-1 cm-1) من خلال المعادلة التَّالية (20,21):
![]()
حيث:
A: الامتصاصيَّةُ.
108: ناتجةٌ عن 106 (تحويل M إلى µM) × 102 (ضرب البسط والمقام بـ 102 للتعبير عن الواحدة بـ 100 g من النسيج).
الدراسة الإحصائيَّة Statistical analysis:
استُخدِمَ المتوسِّطُ ± الخطأ المعياري للمتوسِّط Mean ± S.E.M للتَّعبير عن النَّتائج، وتمَّ اعتبار أنَّ الفارق الإحصائيَّ بين المتوسِّطات معتدَّاً به عندما تكون قيمة p-value أقلَّ مِنْ 0.05 (p< 0.05)، حيث أجُرِيَتْ الدِّراسة الإحصائيَّة باستخدام برنامج SPSS version 26 for windows، واختيار One-Way ANOVA متبوعاً باختبار post Hoc Dunnett T3 للمتثابتات الَّتي لها تبايناتٌ مختلفةٌ non-equal variances، واختبار Sidak للمتثابتات التي لها تبايناتٌ متساويةٌ equal variances.
النتائج Results
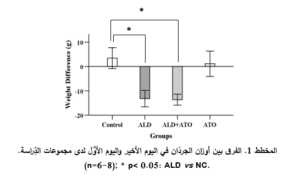
الفروقات بين أوزان الجرذان في يوم التَّضحية واليوم الأوَّل من التَّجربة:
أظهرت النَّتائج أنَّ إعطاء الأليندرونات قد أدَّى إلى حدوث نقصانٍ واضحٍ ذي دلالةٍ إحصائيَّةٍ (p˂0.05) لدى المجموعة المَرَضيَّة (ALD) (-13.12 ± 3.34 g) بالمقارنة مع المجموعة الشَّاهدة (NC) (3.42 ± 4.29 g).
لكن لم يؤدِّ إعطاء دواء الأتورفاستاتين إلى تحسُّن هذه المتثابتة لدى المجموعة الوقائيَّة (ALD+ATO) (-13.65 ± 2.26g) بالمقارنة مع المجموعة المَرَضيَّة (ALD) (-13.12 ± 3.34 g)، مع ملاحظة وجود فارقٍ ذي دلالةٍ إحصائيَّةٍ (p˂0.05) مقارنةً مع المجموعة الشَّاهدة الطبيعيَّة (NC).
لم يكن هناك فارقٌ مهمٌّ إحصائيَّاً في مجموعة الأتورفاستاتين لوحده (ATO) حيث كان الفرق في الوزن (1.12 ± 5.2 g) مقارنةً مع المجموعة الشَّاهدة (NC) (3.42 ± 4.29 g) (المخطط 1).
الفحص العَيانيِّ Macroscopic examination:
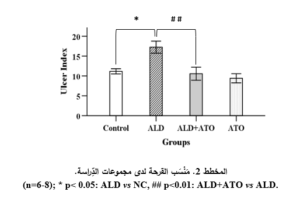
أظهرت النَّتائج للعيِّنات المَعِديَّة مخاطيَّةً سليمةً في معظم عيِّنات المجموعة الشَّاهدة الطبيعيَّة مع بعض النُّزوفات النقطيَّة الصَّغيرة (الشكل 1 الصورة A)، أدَّى إعطاء الأليندرونات إلى تقرُّحِ مخاطيَّة المعدة في كلِّ العيِّنات المفحوصة، حيث تظاهرت الأذيَّةُ بالبقع النقطيَّة والشَّرائط النزفيَّة والاحمرار في بعض العيِّنات (الشكل 1 الصورة B)، حيث وجد فارقٌ إحصائيٌّ (p˂0.05) في مَنْسَب القرحة لدى المجموعة المَرَضيَّة (ALD) (17.25 ± 1.51) بالمقارنة مع المجموعة الشَّاهدة (NC) (11.16 ± 0.65).
أدَّى إعطاء الأتورفاستاتين إلى تحسُّن مظهر المعدة حيثُ بدت المخاطيَّةُ طبيعيَّةً في أغلب العيِّنات (الشكل 1 الصورة C)، ووجِدَ فارقٌ ذو دلالةً إحصائيَّةٍ هامَّةٍ (p˂0.01) في مَنْسَب القرحة لدى المجموعة الوقائيَّة (ALD+ATO) (10.56 ± 1.64) بالمقارنة مع المجموعة المَرَضيَّة(17.25 ± 1.51) (ALD) ، ولم يكن هناك فارقٌ مهمٌّ إحصائيَّاً مقارنةً مع المجموعة الشَّاهدة الطبيعيَّة (NC).
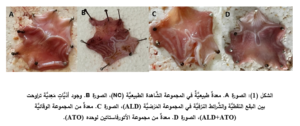
بالنِّسبة لمجموعة الأتورفاستاتين لوحده (ATO) كانت مخاطيَّةُ المعدة طبيعيَّةً في أغلب العيِّنات (الشكل 1 الصورة D) ولم يكن هناك فارقٌ مهمٌّ إحصائيَّاً في مَنْسَب القرحة (9.41 ± 1.15) مقارنةً مع المجموعة الشَّاهدة (NC) (11.16 ± 0.65) (المخطط 2) .
معالم التشريح المَرَضيِّ Histopathological examination:
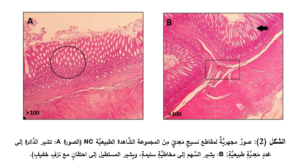
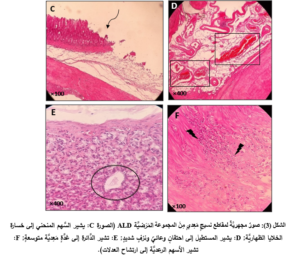
أظهرت مخاطيَّة المعدة في المجموعة الشَّاهدة الطبيعيَّة (NC) مخاطيَّةً طبيعيَّةً مع وجود احتقانٍ وعائيٍّ ونزفٍ خفيفٍ وخسارةٍ خفيفةٍ للخلايا الظهاريَّة في بعض العيِّنات (الشكل 2).
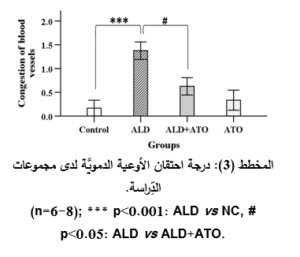
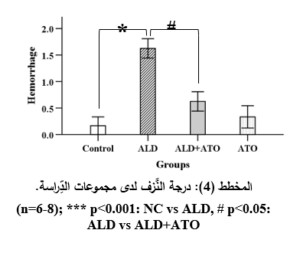
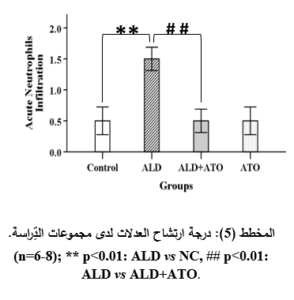
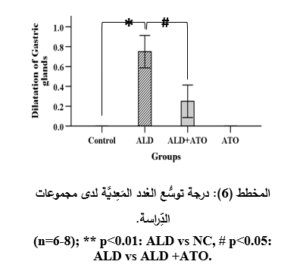
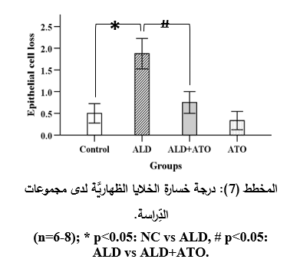
أدَّى إعطاء الأليندرونات للمجموعة المَرَضيَّة (ALD) إلى حدوث الأذيَّة في المخاطيَّة المَعِديَّة والقرحات في كلِّ العيِّنات، حيث أبدت معظمُ العيِّنات احتقاناً وعائيَّاً ونزفاً في الطبقتين المخاطيَّة وتحتَ المخاطيَّة بفارقٍ هامٍّ جدَّاً إحصائيَّاً (p˂0.001) مقارنةً بالمجموعة الشاهدة (NC) (المخطط 3، والمخطط 4)، وارتشاحاً شديداً في الخلايا الالتهابيَّة وخاصَّةً العدلات مع وجود فارقٍ إحصائيٍّ هامٍّ (p˂0.01) مقارنةً بالمجموعة الشَّاهدة (المخطط 5)، إضافةً إلى التوسُّع في الغدد المَعِديَّة مع وجود فارقٍ إحصائيٍّ هامٍّ (p˂0.01) مقارنةً بالمجموعة الشَّاهدة (المخطط 6)، والخسارة في الخلايا الظهاريَّة حيث وجد فارقٌ إحصائيٌّ (p˂0.05) مقارنةً بالمجموعة الشَّاهدة (المخطط 7) (الشكل 3).
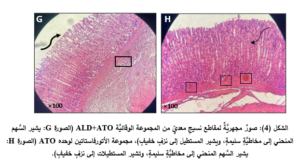
في حين أدَّى إعطاء الأتورفاستاتين إلى المجموعة الوقائيَّة (ALD+ATO) إلى تراجع الأذيَّات النَّسيجيَّة جميعها، حيث ظهرت المخاطيَّةُ سليمةً باستثناء بعض النُّزوفات الخفيفة والخسارة الخفيفة في الخلايا الظهاريَّة والارتشاح الخفيف في الخلايا الالتهابيَّة (الشكل 4، الصورة G)، حيث وجد فارقٌ إحصائيٌّ هامٌّ (p˂0.01) في درجة الأذيَّة المتمثِّلة بارتشاح العدلات (المخطط 5)، وفارقٍ إحصائيٍّ (p˂0.05) في درجات الأذيَّة المتمثِّلة باحتقان الأوعية الدمويَّة، والنزف، وتوسُّع الغدد المَعِديَّة، وخسارة الخلايا الظهاريَّة لدى المجموعة الوقائيَّة (ALD+ATO) بالمقارنة مع المجموعة المَرَضيَّة (ALD) المخططات (3، و4، و6، و7 على الترتيب)، ولم يكن هناك فارقٌ إحصائيٌّ في أيِّ درجة أذيَّةٍ نسيجيَّةٍ في المجموعة الوقائيَّة مقارنةً بالمجموعة الشاهدة (NC).
أمَّا مجموعة الأتورفاستاتين لوحدها (ATO) فقد كانت المخاطيَّة طبيعيَّةً مع وجود احتقانٍ وعائيٍّ ونزفٍ خفيفٍ وخسارةٍ خفيفةٍ للخلايا الظهاريَّة وارتشاحٍ خفيفٍ للعدلات في بعض العيِّنات (الشكل 4، الصورة H)، ولم يكن هناك فارقٌ مهمٌّ إحصائيَّاً في أيِّ درجةِ أذيَّةٍ نسيجيَّةٍ مقارنةٍ بالمجموعة الشاهدة.
معايرة أنزيم المالون ثنائيِّ الألدهيد Malondialdehyde (MDA) assay:
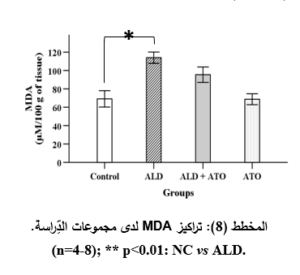
أظهرت النَّتائج أنَّ إعطاء الأليندرونات قد سبَّبَ ارتفاعاً ذا دلالةٍ إحصائيَّةٍ هامَّةٍ (p˂0.01) في مستويات MDA لدى المجموعة المَرَضيَّة (ALD) (113.92 ± 6.20 μM/100g) مقارنةً مع المجموعة الشَّاهدة الطبيعيَّة (NC) (69.12 ± 8.92 μM/100g).
كما أظهرت النَّتائج انخفاضاً في مستويات MDA لدى المجموعة الوقائيَّة ((ALD+ATO (95.42 ± 8.42 μM/100g)، ولم يكن هناك فارقٌ مهمٌّ إحصائيَّاً مقارنةً بالمجموعة المَرَضيَّة (ALD) حيث كانت مستويات MDA (113.92 ± 6.20 μM/100g)، وكذلك لم يكن هناك فارقٌ مهمٌّ إحصائيَّاً مقارنةً مع المجموعة الشَّاهدة الطبيعيَّة (NC).
بالنسبة لمجموعة الأتورفاستاتين لوحده (ATO) كانت مستويات MDA (68.68 ± 5.93 μM/100g)، ولم يكن هناك فارقٌ مهمٌّ إحصائيَّاً مقارنةً بالمجموعة الشاهدة الطبيعيَّة (NC) حيث كانت مستويات MDA (69.12 ± 8.92 μM/100g) (المخطط 8).
المناقشة Discussion
تنتميAlendronate (ALD) إلى زمرة البيسفوسفونات الحاوية على النتروجين (N-BPs) وهي فئةٌ مِنَ المركَّبات الَّتي تمَّ تطويرها كعواملَ مضادَّةٍ للارتشاف قادرةٍ على علاج الأمراض المرتبطة بإعادة تشكيل العظام، ولكن تمَّ الإبلاغ أنَّ هذه الأدوية لها تأثيراتٌ غيرُ مرغوبٍ فيها على السَّبيل الهضميِّ العلويِّ لدى البشر، بما في ذلك الالتهاب المَعِديُّ المريئيُّ والقرحات (22).
أظهرت العديد من الدِّراسات أنَّ الالتهاب والشِّدَّة التَّأكسديَّة يُعدَّان مِنْ أهمِّ الآليَّات التي تؤدِّي لإحداث الأذيَّة المَعِديَّة النَّاجمة عن ALD (13,23)، لذلك فقد ركَّزت العديد من الدِّراسات التي جرت على حيوانات التَّجربة على أهميَّة استعمال المركَّبات التي تمتلك خصائصَ مضادَّةً للأكسدة كإجراءٍ وقائيٍّ ضدَّ الأذيَّة المَعِديَّة النَّاجمة عن تناول الأليندرونات، وقد أبدى العديد منها فعاليَّةً وقائيَّةً (11,13,24).
الأتورفاستاتين (ATO) من عائلة الستاتينات، ويستخدم كدواءٍ خافضٍ للشُّحوم من خلال خفض تصنيع الكوليسترول (8)، وقد أظهر الأتورفاستاتين في دراساتٍ سابقةٍ خصائصَ مضادَّةً للالتهاب ومضادَّة للشِّدَّة التَّأكسديَّة (10).
تمَّ في الدراسة الحالية تقصِّي التَّأثيرات الوقائيَّة لدواء الأتورفاستاتين على القرحة المَعِديَّة المحدَثة بالأليندرونات عند جرذان التّجربة، حيث تمَّ تحديد الفروقات بين الأوزان في يوم التَّضحية وبداية التَّجريع، وإجراء الفحص العيانيِّ والنَّسيجيِّ، ومعايرة الشِّدَّة التَّأكسديَّة لمستويات MDA في نسيج المعدة.
أظهرت هذه الدراسة أنَّ إعطاء الأليندرونات بجرعة20 mg/kg/day لمدَّة 4 أيامٍ أدَّى إلى انخفاضٍ هامٍّ في أوزان الجرذان، وقد يعود سبب ذلك إلى القرحات التي قد تسبِّب قلَّةَ الشهيَّة للطعام، والتي تمَّت ملاحظتها بعد اليوم الثَّاني من إعطاء ALD خلال فترة التَّجربة، والَّذي مِنَ الممكن أن يسبِّبَ هذا النُّقصان في الوزن، كما لوحظ حدوثُ إسهالٍ عند بعض الجرذان.
أظهر الفحص العَيانيُّ للعيِّنات المَعِديَّة المستأصَلة مِنْ جرذان المجموعة المَرَضيَّة حدوثَ أذيَّةٍ في مخاطيَّة جسم وغار المعدة، وكانت هذه الأذيَّة في الغالب عبارةً عن إصابة ظهاريَّةٍ سطحيَّةٍ وكان السَّطح اللّمعيُّ في بعض العيِّنات مغطَّىً بحطامٍ خلويٍّ cellular debris، حيث تمثَّلت هذه الأذيَّة بقرحاتٍ إمَّا على شكل نقط (قرحات بقعيَّة) أو شرائط نزفيَّة، ولوحظ كذلك اختفاءُ الطيَّات في بعض العيِّنات، وظهورُ انتفاخٍ أو احمرارٍ في معدة بعض الجرذان، وترافق ذلك مع ارتفاع في مَنْسَب القرحة، وهذا ما نراه جليَّاً في العديد من الدِّراسات السَّابقة التي درست تأثير ALD على المعدة (24–26).
أكّد الفحصُ المجهريُّ والدِّراسةُ النَّسيجيَّةُ لمقاطع من النَّسيج المعديِّ من هذه الدراسة حدوثَ خسارةٍ في الخلايا الظّهاريَّة وتقرُّحاتٍ في أغلب المناطق في عيِّنات المجموعة المَرَضيَّة.
وقد توافقت هذه النَّتائج مع نتائج العديد من الدِّراسات السَّابقة، حيث افترض Lichtenberger وزملاؤه أنَّ الأذيَّة الظّهاريَّة التي تسبِّبُها البيسفوسفونات الحاوية على النتروجين، تحدث نتيجةً لتخرُّبِ طبقة الفوسفوليبيدات الفاعلة على السَّطح ضمن الهلامة المخاطيَّة الملتصقة باللّمعة، والَّتي ثبت أنَّها تساهم في مقاومة ظهارة الجهاز الهضمي للإصابة النَّاجمة عن العوامل اللُّمعيَّة luminal agents، حيث تتنافس البيسفوسفونات مع الفسفوليبيدات الفعَّالة على السَّطح بسبب تشابهها الجزيئيِّ على مواقع الارتباط على الطَّبقة السَّطحيَّة من الهلامة المخاطيَّة، وبالتَّالي تقلِّل مِنْ فعاليَّة الحاجز الواقي الكاره للماء (27).
كما لاحظ Taskinen وزملاؤه – والذي قام بدراسة تأثير عدَّةِ أدويةٍ مِنْ عائلة N-BPs مِنْ ضمنها الأليندرونات، على خطوط خلويَّةٍ مشتقَّةٍ مِنْ ورم القولون عند البشر، والتي تُستخدم على نطاقٍ واسعٍ كنموذج في المختبر للخلايا الظهاريَّة للسبيل المَعِديِّ المعويِّ – أنَّ البيسفوسفونات الحاوية على النتروجين تحرِّضُ الموت الخلويَّ المبرمج، وتثبِّطَ تكاثرَ الخطوط الخلويَّةِ الظهاريَّة البشريَّة في الزُّجاج in vitro، عن طريق تثبيط مسار تصنيع الكوليسترول مِنَ الميفالونات، وما ينتج عنه مِنْ تثبيطٍ لعمليَّة برنلة البروتينات وخاصَّةً عملية إضافة الجيرانيل جيرانيل geranylgeranylation للبروتينات والَّتي تعدُّ ضروريَّةً لعمل الخليَّةِ ممَّا يؤدِّي للموت المبرمج للخلايا، كما يؤدِّي تثبيط هذا المسار إلى تثبيط تصنيع الكوليسترول الضروريِّ للتَّصنيع الحيويِّ للأغشية الخلويَّة (28).
كما أظهر الفحص النسيجيُّ للمجموعة المَرَضيَّة المعالجة بالأليندرونات وجودَ التهاباتٍ تمثَّلت بارتشاح الكريَّات البيضاء (العدِلات خاصّةً)، وهذا يتوافق مع نتائج العديد من الدِّراسات السَّابقة (13,24–26)، حيث أثبتت دراسة Nicolau وزملائِه (2013) أنَّ تراكم العَدِلات النّاجم عن ALD والوذمة تحت الظّهاريَّة في الغشاء المخاطيِّ للمعدة يلعبان دوراً رئيسيَّاً في تطوُّر القرحة، حيث تُعَدُّ العَدِلات مصدراً محتملاً لجذور الأوكسجين الحرَّةِ، وتعتبر خلايا مؤثِّرة رئيسيَّة في الضَّرر النَّسيجيِّ الذي يحدث في العديد من الأمراض الالتهابيَّة، عندما يتمُّ تحفيز العَدِلات، يتمُّ إطلاق السيتوكينات المؤهِّبة للالتهاب والميلوبيروكسيداز.
كما أظهر الفحص النسيجيُّ للمجموعة المَرَضيَّة المعالجة بالأليندرونات وجودَ التهاباتٍ تمثَّلت بارتشاح الكريّات البيضاء (العدِلات خاصَّةً)، وهذا يتوافق مع نتائج العديد من الدراسات السابقة (13,24–26)، حيث أثبتت دراسة Nicolau وزملائه (2013) أنَّ تراكم العَدِلات النّاجم عن ALD والوذمة تحت الظّهاريَّة في الغشاء المخاطيِّ للمعدة يلعبان دوراً رئيسيَّاً في تطوُّر القرحة، حيث تُعَدُّ العَدِلات مصدراً محتملاً لجذور الأوكسجين الحرَّة، وتعتبر خلايا مؤثِّرةً رئيسيَّةً في الضَّرر النَّسيجي الذي يحدث في العديد من الأمراض الالتهابيَّة.
عندما يتمُّ تحفيز العَدِلات، يتمُّ إطلاق السيتوكينات المؤهِّبة للالتهاب والميلوبيروكسيداز Myeloperoxidase (MPO)، ويتمُّ تفعيل الخلايا المُحبَّبَة granulocytes، ممَّا يعزِّز موتَ الخلايا والأذيَّة المَعِديَّة، حيث عكست الزِّيادةِ في مستويات عامل التنخُّر الورميِّ ألفا Tumor Necrosis Factor α (TNF-α) والانترلوكين Interlukin-1β (IL-1β)، والزِّيادةِ في نشاط MPO في مخاطيَّة المعدة في الدِّراسة السَّابقة.. تأثيرَ السّيتوكينات المؤهِّبة للالتهاب وارتشاح العَدِلات، على التَّوالي، في الأذيَّة المَعِديَّة النَّاجمة عن الأليندرونات (29).
تسبَّبَ إعطاء الأليندرونات أيضاً بحدوث توسُّع في الغدد المَعِديَّة، وهذا ما بدا واضحاً في الدراسات السَّابقة، إضافةً إلى ملاحظة احتقانٍ ونزوفاتٍ في الطبقة المخاطيَّة وتحتَ المخاطيَّة في أغلب العيِّنات، ممَّا يتَّفق مع نتائج الدِّراسات (13,25). وجد Takeuchi وزملاؤه أنَّ N-BPs تسبُّب أذيَّةً في المعدة مِنْ خلال تأثيرها المخرّش الموضعيِّ، والذي تمثَّلت بانخفاض فرق الكمون عبر الغشاء المخاطيِّ للمعدة (PD) transmucosal potential difference، والذي يُعدَّ مؤشِّراً على سلامة المخاطيَّة (22).
كما اقترحت Silva وزملاؤها (2014) أنَّ البيسفوسفونات قد تسبِّبُ أذيَّةَ الجهاز الهضميِّ مِنْ خلال تقليل إنتاج NO من قِبَل مُصنِّعة أكسيد النيتريك، بالإضافة إلى التَّدخُّل في هجرة الخلايا إلى مواقعِ تَلَفِ الغشاء المخاطيِّ (30).
كما أنَّهُ مِنْ غير المرجَّح أن يكون تأثير الأليندرونات المُحدِث للتقرُّح ناجماً عن زيادة الإفراز الحمضيِّ، حيث وجدت في دراساتٍ سابقةٍ على الجرذان أنَّ الأليندرونات لا تؤثِّر على إفراز الحمض المعديِّ (31)، وهذا يفسِّرُ كون الأذيَّات المَعِديَّة المرافقة لتناول الأليندرونات في الغالب سطحيَّةً لا نزفيَّةً ولا تمتدُّ إلى الأذيَّات النزفيَّة في دراستنا بسبب عدم وجود التَّأثير التَّآكليِّ للحمض (32).
إضافةً إلى ذلك، فقد اقترح Takeuchi وزملاؤه أنَّ حدوث القرحة ناتجٌ عن التَّخريش المباشر للمخاطيَّة، والخلل في نظام المخاطيَّة المضادِّ للأكسدة (32).
لذا تمَّت دراسة تأثير الأليندرونات على الشِّدَّة التَّأكسديَّة باعتبارها مِنَ الآليَّات المهمَّة التي مِنَ المحتمل أن يمارسها في إحداث الأذيَّة المَعِديَّة، وذلك من خلال قياس مستويات MDA في النَّسيج المعديِّ، وقد أظهرت النتائج ارتفاعاً هامَّاً بمستويات MDA لدى المجموعة المَرَضيَّة كدليلٍ واضحٍ على أنَّ ALD تزيد من الشِّدَّة التَّأكسديَّة.
وهنا تتَّفق نتائجنا مع نتائج الدِّراسات السَّابقة، حيث أظهرت أنَّ ALD تسبِّب أذيَّةً في المعدة من خلال التَّأثير المباشَر على الغشاء المخاطيِّ، ممَّا يؤدِّي إلى أذيَّةٍ تأكسديَّةٍ مباشَرةٍ، حيث كشفت الدِّراسات أنَّ المستقلَبات السَّامَّة التي تُشارك في أذيَّة المعدة النَّاجمة عن الـALD هي في الأساس بيروكسيد الهيدروجين H2O2، وجذر الهيدروكسيل OH·، والهيبوكلوريت hypochorite، وبيروكسي نتريت peroxynitrite، والجذور البيروكسيليّة للشّحومlipid peroxyl radicals، والتي يمكن أن تعطِّلَ بشدَّة وظيفةَ الأغشية الخلويَّة، وتؤدِّي إلى تلفِ الحمض النَّووي DNA، وموتِ الخلايا في الغشاء المخاطيِّ للجهاز الهضميِّ، يُعتقد أنَّ للأكسدة الفائقة للشُّحوم التي تُسبِّبها مستقلَبات الأكسجين التَّفاعليَّة دوراً مهمَّاً في تدمير وتلف الغشاء المخاطيِّ في المعدة (13)، ومع ذلك، قد يكون هذا الارتفاع في الأكسدة الفائقة للشُّحوم راجعاً بشكلٍ جزئيٍّ إلى الجذور الحرَّة التي تولِّدها العَدِلاتُ (23).
لقد تمَّ في هذه الدراسة تقييم التَّأثيرات الوقائيَّة لدواء الأتورفاستاتين لدى المجموعة الوقائيَّة من خلال إعطائها ATO بجرعة 10 mg/kg/day لمدَّة 7 أيَّامٍ وقبل ساعةٍ من إعطاء ALD، وقد اعتُمِد على التَّأثير الإيجابيِّ المضادِّ للشِّدَّة التَّأكسديَّة الذي أظهره ATO في دراساتٍ سابقةٍ للوقاية مِنَ القرحة المَعِديَّة المحدثة بالإندوميتاسين (10)، ولتحسين السُّمِّيَّةِ الكبديَّةِ المحرَّضة بالايتانول (33)، وكذلك للوقاية من السُّمِّيَّةِ الكبديَّةِ المحرَّضة بكلور الكادميوم (34) عند جرذان التَّجربة.
أظهرت نتائج هذه الدراسة حدوثَ انخفاضٍ في مستويات MDA عند إعطاء ATO للمجموعة الوقائيَّة، ولكن ليس له أهميَّةٌ إحصائيَّةٌ مقارنةً مع المجموعة المَرَضيَّة، وهنا خالفت هذه النَّتائحُ نتائجَ دراسة El-sheikh وزملائه، والَّتي أظهرت تأثيراتٍ وقائيَّةٍ لـِATO على القرحة المحدثة بالإندوميتاسين مِنْ خلال خصائصه المضادَّةِ للأكسدة والمضادَّة للالتهاب، حيث أدَّى إعطاء ATO بجرعة 10 mg/kg/day لمدَّة 7 أيَّامٍ إلى انخفاضٍ واضحٍ في مستويات MDA النَّسيجيَّة (10)، مِنَ الممكن أن يُعزى سببُ هذا الاختلاف إلى أنَّ الجرعة المستخدمة من ATO في هذه الدِّراسة غيرُ كافيةٍ لإظهار الخصائص المضادَّة للأكسدة على القرحة المَعِديَّة المحدَثة بالأليندرونات نظراً لاختلاف النَّموذج المَرَضِيِّ.
كما خالفت هذه النَّتائجُ نتائجَ دراسة Goodarzi وزملائه، والَّتي أظهرت تأثيراتٍ وقائيَّةٍ لـِATO على السُّمِّيَّةِ الكبديَّةِ المحرَّضة بكلور الكادميوم مِنْ خلال خصائصه المضادَّةِ للأكسدة، حيث أدَّى إعطاء ATO بجرعة 20 mg/kg/day لمدَّة 15 يوماً إلى انخفاضٍ واضحٍ في مستويات MDA النَّسيجيَّة، مِنَ الممكن أن يُعزى سببُ هذا الاختلاف إلى اختلاف كلٍّ مِنَ النَّموذج المَرَضِي، والجرعة المستخدمة، والبروتوكول المُتَّبع (34).
على الرغم من عدم تأثير ATO الواضح على الشِّدَّة التأكسديَّة إلَّا أنَّ الأذيَّات العيانيَّة والنَّسيجيَّة قد تراجعت بوضوحٍ في المجموعة الوقائيَّة بالأتورفاستاتين، حيث ظهر تحسُّنٌ في كلٍّ من ظهارةِ المعدة واحتقانِ الأوعية الدَّمويَّة والنَّزف وتوسُّعِ الغدد المَعِديَّة، كما تراجع ارتشاح الخلايا الالتهابيَّة وخاصَّةً العَدِلات في النَّسيج المعديِّ بشكلٍ واضحٍ.
وتوافقت نتائجنا مع دراسة El-sheikh وزملائه (2014) والذي درس فعاليَّة ATO في القرحة المَعِديَّة المحدثة بالإندوميتاسين عند الجرذان، حيث وجد تحسُّناً ملحوظاً في مَنْسَب القرحة وفي البنية النسيجيَّة للمعدة بعد 7 أيَّامٍ مِنْ إعطاء ATO بجرعة 10 mg/kg/day (10).
في حين تخالفت دراستنا مع دراسة Özbakiş-Dengız وزملائه (2012)، والذي درس فعاليَّة ATO في القرحة المَعِديَّة المحدثة بالإندوميتاسين، والَّتي أظهرت أنَّ الأتورفاستاتين لم يمنح الحماية للمعدة، بل زاد مِنْ مَنْسَب القرحة (35)، من المحتمل أن يكون سببُ هذا التناقض راجعاً إلى استخدام جرعاتٍ أعلى مِنَATO بما يتراوح بين ضعفين إلى أربعة أضعافٍ في الدِّراسة الأخيرة مقارنةً بالجرعة المستخدمة في دراستنا الحاليَّة.
كما خالفت نتائجُ هذه الدراسة دراسةَAlp Yildirim وزملائه (2015)، والذي درس فعاليَّة الأتورفاستاتين في الأذيَّة المَعِديَّة المحدثة بالإندوميتاسين، والَّتي أظهرت أنَّ الأتورفاستاتين لم يحسِّن مِنْ مَنْسَب القرحة، بل فاقم الأذيَّة المَعِديَّة وزادَ مِنْ مَنْسَب القرحة ومِنَ الأذيات النسيجيَّة، وذلك عند كلٍّ مِنَ الإعطاء الحادِّ acute وشبه المزمن subchronic، من المحتمل أن يكون سببُ هذا التَّناقض كذلك راجعاً إلى استخدام جرعاتٍ أعلى من ATO بمقدار خمسة أضعافٍ (50 mg/kg) في الدِّراسة الأخيرة مقارنةً بالجرعة المستخدمة في دراستنا الحاليَّة.
حدَّدت هذه الدِّراسة أنَّ التَّأثيرَ المسبِّبَ للقرحة للأتورفاستاتين في الجرعات العالية كان مرتبطاً بتغيّراتٍ واضحةٍ في مستويات كلٍّ من الغلوتاتيون GSH، والبروستاغلاندين PGE2، وTNF-α، وارتشاح الكريات البيضاء وفعالية MPO في المخاطية. كانت آليَّةُ التَّفاقم مستقلَّةً عن تثبيط مسار الميفالونات، في حين مِنَ المرجَّح أن تكون مرتبطةً بمسار NO عبر تفعيل iNOS (36).
كما أنَّ إعطاء الأتورفاستاتين إلى المجموعة الوقائيَّة لم يُحدِث تحسُّناً في الفروقات بأوزان الجرذان بين يوم التَّضحيَّة واليوم الأوَّل بالمقارنة مع المجموعة المَرَضيَّة، حيث لوحظ انخفاضُ الشهيَّة في هذه المجموعة أيضاً، قد يعود السَّبب إلى أنَّ إعطاء الأليندرونات مِنْ شأنه أن يؤثِّرَ على الوزن، مع عدم وجود تأثيرٍ للأتورفاستاتين على الوزن، حيث أظهرت دراساتٌ سابقةٌ أنَّ الأتورفاستاتين لا يملك أيَّ تأثيرٍ ملحوظٍ على وزن الجسم عند حيوانات التَّجربة (37).
لقد قمنا ولأوَّل مرَّةٍ بدراسة التَّأثير الوقائيِّ لدواء الأتورفاستاتين على القرحة المَعِديَّة المحدثة بالأليندرونات لدى جرذان التَّجربة، وقد وجدنا أنَّ الأتورفاستاتين استطاع أن يُبدي تأثيراتٍ وقائيَّةٍ على القرحة المَعِديَّة المحدَثة بالأليندرونات عيانيَّاً ونسيجيَّاً، في حين لم نجد تأثيراتٍ مضادَّةً للأكسدة واضحةً للأتورفاستاتين، لذا قد تُعزى هذه التَّأثيرات الوقائيَّة للأتورفاستاتين لآليَّاتٍ أخرى غير التَّأثيرات المضادَّة للأكسدة.
الاستنتاجات Conclusions
لقد أكَّدنا مِنْ خلال دراستنا أنَّ الأليندرونات يسبِّبُ حدوثَ أذيَّةٍ مَعِديَّةٍ عندما يُعطى بجرعة 20 mg/kg/day فمويَّاً ولمدَّة 4 أيَّامٍ، وهذا ما ظهر جليَّاً مِنْ خلال ظهور الأذيَّات المَعِديَّة عيانيَّاً ونسيجيَّاً، وقد أكَّدت نتائجنا أنَّ الشِّدَّة التأكسديَّة لعبت دوراً رئيسيَّاً في حدوث هذه الأذيَّة المَعِديَّة.
كما أظهرت دراستنا أنَّ دواء الأتورفاستاتين المعطى بجرعة 10 mg/kg/day فمويَّاً ولمدَّةِ 7 أيَّامٍ وقبلَ ساعةٍ مِنَ إعطاء الأليندرونات كان قادراً على الوقاية مِنَ الأذيَّةِ المَعِديَّة عيانيَّاً ونسيجيَّاً، مع عدم قدرته على تحسين الشِّدَّة التَّأكسديَّة، والتي قد تكون واحدةً مِنَ العوامل الوقائيَّة ولكن قد لا تكون الأهمَّ.
ممَّا سبق يمكننا استنتاجُ أنَّ دواء الأتورفاستاتين يمكنه تحسينُ الأذيَّةِ المَعِديَّة في القرحة المَعِديَّة المحدثة بالأليندرونات.
قائمة الاختصارات List of abbreviations
| المقابل | الاختصار |
| Natural Control | NC |
| Alendronate | ALD |
| Atorvastatin | ATO |
| Non-Steroidal Anti-inflammatory Drugs | NSAIDs |
| Reactive Oxygen Species | ROS |
| Reactive Oxygen Species | MDA |
| 3-Hydroxy-3-methylglutaryl Coenzyme A | HMG-CoA |
| Thiobarbeturic Acid | TBA |
| Trichloroacetic Acid | TCA |
| Low-density Lipoprotein Cholesterol | LDL-C |
| Average number of ulcers per animal | UN |
| Average of severity score | US |
| Percentage of animals with ulcer | UP |
| Micromole | μM |
| Nitrogen-containing Bisphosphonates | N-BPs |
| Myeloperoxidase | MPO |
| Tumor Necrosis Factor Alpha | TNF-α |
| Interleukin 1β | IL-1β |
| Potential Difference | PD |
| Nitric Oxide | NO |
| Glutathione | GSH |
| Prostaglandin E2 | PGE2 |
| Inducible Nitric Oxide Synthase | iNOS |
الموافقة الأخلاقية والموافقة على المشاركة Ethics approval and consent to participate
حاز هذا البحث على الموافقة الأخلاقية من قبل لجنة الأخلاقيات الطبية في جامعة دمشق رقم PH-180225-410.
تضارب المصالح Conflict of interests
يقرّ المؤلفون بعدم وجود مصالح متضاربة.
التمويل Funding
أُجري هذا البحث دون دعم مالي خارجي؛ وقد تحملت الباحثة جميع التكاليف.
مساهمات المؤلفين Authors’ contributions
دينا ماهر شاهين: قامت بتصميم الدراسة، وإجراء التجارب المخبرية، وجمع البيانات وتحليلها وتفسيرها، وكتابة المسودة الأولى من المقال.
شادي مصطفى حمصي: قام بالإشراف على جميع مراحل الدراسة، وقدّم التوجيه العلمي والملاحظات النقدية خلال إعداد البحث وكتابة المقال.
المراجع :- Scally B, Emberson JR, Spata E, Reith C, Davies K, Halls H, et al. Effects of gastroprotectant drugs for the prevention and treatment of peptic ulcer disease and its complications: a meta-analysis of randomised trials. Lancet Gastroenterol Hepatol. 2018 Apr 1;3(4):231–41.
- Lanas A, Chan FKL. Peptic ulcer disease. Vol. 390, The Lancet. Lancet Publishing Group; 2017. p. 613–24.
- Sverdén E, Agréus L, Dunn JM, Lagergren J. Peptic ulcer disease. Bmj. 2019;367.
- Keller CL, Jones NT, Abadie RB, Barham W, Behara R, Patil S, et al. Non-steroidal Anti-inflammatory Drug (NSAID)-, Potassium Supplement-, Bisphosphonate-, and Doxycycline-Mediated Peptic Ulcer Effects: A Narrative Review. Cureus. 2024;16(1).
- Selmi S, Rtibi K, Grami D, Sebai H, Marzouki L. Protective effects of orange (Citrus sinensis L.) peel aqueous extract and hesperidin on oxidative stress and peptic ulcer induced by alcohol in rat. Lipids Health Dis. 2017;16(1):1–12.
- Singh Z, Karthigesu IP, Singh P, Kaur R. Use of malondialdehyde as a biomarker for assessing oxidative stress in different disease pathologies: A review. Iran J Public Health. 2014;43(3):7–16.
- Sanders SW, Sanders SW. Pathogenesis and Ykeatment of Acid Peptic Disorders: Comparison of Proton Pump Inhibitors with Other Antiulcer Agents. Vol. 18. 1996.
- Tulbah AS. The potential of Atorvastatin for chronic lung diseases therapy. Saudi Pharm J [Internet]. 2020;28(11):1353–63. Available from: https://doi.org/10.1016/j.jsps.2020.08.025
- Mansouri A, Reiner Ž, Ruscica M, Tedeschi-Reiner E, Radbakhsh S, Ekta MB, et al. Antioxidant Effects of Statins by Modulating Nrf2 and Nrf2/HO-1 Signaling in Different Diseases. J Clin Med. 2022;11(5):1–21.
- El-sheikh AAK, Moselhy M El. Gastro-protection of atorvastatin in indomethacin-induced ulcer: role of tumor necrosis factor-alpha and prostaglandins. 2014;(April 2016).
- Carvalho NS, Silva MM, Silva RO, Nicolau LAD, Araújo TSL, Costa DS, et al. Protective Effects of Simvastatin Against Alendronate-Induced Gastric Mucosal Injury in Rats. Dig Dis Sci. 2016;61(2):400–9.
- Institutional Animal Care and Use Program. Oral Gavage In Mice and Rats IACUC Standard Procedure Effective Date : May 2023. 2023;i(May).
- Íşeri SÖ, Şener G, Yüksel M, Contuk G, Çetinel Ş, Gedik N, et al. Ghrelin against alendronate-induced gastric damage in rats. J Endocrinol. 2005;187(3):399–406.
- Farag MM, Mohamed MB, Youssef EA. Assessment of hepatic function, oxidant/antioxidant status, and histopathological changes in rats treated with atorvastatin. Hum Exp Toxicol. 2015 Aug 28;34(8):828–37.
- Prasanth Reddy V, Sudheshna G, Afsar SK, Sai Saran S, Nelson Kumar S, Raja Ram C, et al. Evaluation of anti-ulcer activity of Citrullus colocynthis fruit against pylorus ligation induced ulcers in male wistar rats. Int J Pharm Pharm Sci. 2012;4(2):446–51.
- Al-Sabawy HB, Rahawi AM, Al-Mahmood SS. Standard techniques for formalin-fixed paraffin-embedded tissue: A Pathologist’s perspective. Iraqi J Vet Sci. 2021;35(1–3):935–43.
- Ercan G, Tartar RI, Solmaz A, Gulcicek OB, Karagulle OO, Meric S, et al. Potent therapeutic effects of ruscogenin on gastric ulcer established by acetic acid. Asian J Surg. 2020;43(2):405–16.
- For A, Dienes C. Measurement of Lipid Peroxidation. 1999;1–13.
- ضاحي و، اللحام ش، المنديلي أ، (2022)؛ تقييم فعالية الفيتامين في علاج قرحة المعدة المحدثة بالشدة النفسية عند الجرذان. مجلة جامعة البعث. 29-7
- Buege JA, Aust SD. Biomembranes – Part C: Biological Oxidations. Methods Enzymol [Internet]. 1978;52:302–10. Available from: http://www.sciencedirect.com/science/article/pii/S0076687978520326
- Hagar HH, El Medany A, El Eter E, Arafa M. Ameliorative effect of pyrrolidinedithiocarbamate on acetic acid-induced colitis in rats. Eur J Pharmacol. 2007;554(1):69–77.
- Takeuchi K, Kanatsu K, Aihara E, Okayama M, Kato S. Mucosal irritative and healing impairment action of risedronate in rat stomachs: Comparison with alendronate. Vol. 19, Journal of Gastroenterology and Hepatology. 2004.
- Safaa William Mdawar, Shaza Anwar Al Laham, Ahmad Izzat Al-Manadili. Evaluation of Protective Effect of Methyl Sulfonyl Methane on Colon Ulcer Induced by Alendronate. J Pharm Nutr Sci. 2017;7(3):130–5.
- Şener G, Şehirli Ö, Cetinel S, Midillioǧlu Ş, Gedik N, Ayanoǧlu-Dülger G. Protective effect of taurine against alendronate-induced gastric damage in rats. Fundam Clin Pharmacol. 2005 Feb;19(1):93–100.
- Paskaloglu K, Kapucu C, Cetinel S. Octreotide ameliorates alendronate-induced gastric injury. 2004;25:115–21.
- Şener G, Kapucu C, Cetinel S, Cikler E, Ayanoğlu-Dülger G. Gastroprotective effect of leukotriene receptor blocker montelukast in alendronat-induced lesions of the rat gastric mucosa. Prostaglandins, Leukot Essent Fat Acids. 2005;72(1):1–11.
- Lichtenberger LM, Romero JJ, Gibson GW, Blank MA. Effect of bisphosphonates on surface hydrophobicity and phosphatidylcholine concentration of rodent gastric mucosa. Dig Dis Sci. 2000;45(9):1792–801.
- Suri S, Mönkkönen J, Taskinen M, Pesonen J, Blank MA, Phipps RJ, et al. Nitrogen-containing bisphosphonates induce apoptosis of Caco-2 cells in vitro by inhibiting the mevalonate pathway: A model of bisphosphonate-induced gastrointestinal toxicity. Bone. 2001;29(4):336–43.
- Costa NRD, Silva RO, Nicolau LAD, Lucetti LT, Santana APM, Aragão KS, et al. Role of soluble guanylate cyclase activation in the gastroprotective effect of the HO-1/CO pathway against alendronate-induced gastric damage in rats. Eur J Pharmacol. 2013;700(1–3):51–9.
- Silva RO, Lucetti LT, Wong DVT, Aragão KS, Junior EMA, Soares PMG, et al. Alendronate induces gastric damage by reducing nitric oxide synthase expression and NO/cGMP/KATP signaling pathway. Nitric Oxide – Biol Chem. 2014 Aug 31;40:22–30.
- Amagase K, Hayashi S, Nishikawa K, Aihara E, Takeuchi K. Impairment of gastric ulcer healing by alendronate, a nitrogen-containing bisphosphonate, in rats. Dig Dis Sci. 2007;52(8):1879–89.
- Takeuchi K, Kato S, Amagase K. Gastric ulcerogenic and healing impairment actions of alendronate, a nitrogen-containing bisphosphonate-prophylactic effects of rebamipide. Curr Pharm Des. 2011;17(16):1602–11.
- Zamani E, Mohammadbagheri M, Fallah M, Shaki F. Atorvastatin attenuates ethanol-induced hepatotoxicity via antioxidant and anti-inflammatory mechanisms. Res Pharm Sci. 2017;12(4):315–21.
- Goodarzi Z, Karami E, Yousefi S, Dehdashti A, Bandegi AR, Ghanbari A. Hepatoprotective effect of atorvastatin on Cadmium chloride induced hepatotoxicity in rats. Life Sci [Internet]. 2020;254(March):117770. Available from: https://doi.org/10.1016/j.lfs.2020.117770
- Özbakiş-Dengız G, Hekımoğlu A, Kandemır N, Kurcer Z. Effects of statins in an indomethacin-induced gastric injury model in rats. Turkish J Gastroenterol Off J Turkish Soc Gastroenterol. 2012;23(5):456–62.
- Alp Yildirim FI, Uyanik Ö, Özyoʇurtçu H, Gürel AI, Atukeren Pi, Gümüştaş K, et al. Aggravating effect of atorvastatin on indomethacin-induced gastric injury: Focus on PGE2, TNF-α, neutrophils and iNOS. Prostaglandins Other Lipid Mediat. 2015;121:53–62.
37. Jabarpour M, Rashtchizadeh N, Haghjo AG, Argani H, Nemati M, Dastmalchi S, et al. Protection of renal damage by HMG-CoA inhibitors: A comparative study between atorvastatin and rosuvastatin. Iran J Basic Med Sci. 2020;23(2):206–13.