تحضير و توصيف جسيمات الكيتوزان النانوية المحملة بمادتي الكورسيتين و الفنتوئين لتعزيز التوصيل الدماغي لمادة الفنتوئين التابع للتجريع الأنفي عند فئران فصيلة Balb/ c
2022-01-01 | المجلد السادس العدد التاسع - المجلد السادس | مقالات بحثيةأمل يوسفان | همام كفى | عبد الحكيم نتوف
الملخص
يعد استخدام الجسيمات النانوية في الإيصال الدوائي الدماغي عن طريق الأنف استراتيجية مهمة لتعزيز الاستهداف الدماغي للمواد الدوائية المضادة للصرع، كما يعد استخدام مثبطات مضخة الغليكوبروتين P (P-GP) إحدى طرائق تعزيز التراكيز العلاجية عند مرضى الصرع المقاوم للمعالجة. في العمل المقدم، حُضرت جسيمات الكيتوزان والليسيتين المحملة بكلٍ من مادتي الفنتوئين بصفتها مادة مضادة للصرع و الكوريسيتين كفلافونيد مثبط لـ (P-GP) باستخدام طريقة الترسيب النانوي. تم التأكد من الشكل الكروي للجسيمات المحضرة باستخدام المجهر الالكتروني الماسح، بينما استخدم مقياس تشتت الضوء الديناميكي لقياس أبعاد وشحنة الجسيمات المحضرة. بلغت كفاءة الكبسلة 60% لكلٍ من المادتين الدوائيتين واللتين أظهرتا تحرراً مديداً من الجسيمات باستخدام طريقة التحال. جُرعت الجسيمات المحضرة عن طريق الأنف عند فئران فصيلة Balb/ c وتمت مقايسة كمية الفنتوئين في البرانشيم الدماغي والشعيرات الدموية الدماغية والبلازما. استُخدم الإيتاء الصفاقي لمحلول الفنتوئين كشاهد ايجابي للتجربة، كما تمت مقارنة النتائج مع التراكيز الدماغية للفنتوئين التابعة للتجريع المنفصل مع الفيراباميل كمثبط معياري للـ P-GP ومع الكويرسيتين بكونه الفلافونيد المختبر في الدراسة. أظهرت النتائج أن التراكيز العليا في البرانشيم الدماغي تم الوصول إليها بعد الإيتاء الأنفي للجسيمات المحملة بالفنتوئين و الكوريسيتين حيث بلغت 9.7 ± 1.44% من الجرعة المعطاة منسوبة إلى وزن العضو المدروس. تظهر النتائج أن الإيتاء الأنفي للجسيمات المحملة بالفنتوئين والكوريستين يعتبر نظاماً واعداً للسيطرة على النوبات الصرعية من حيث إمكانية زيادة مأمونية العلاج وتقليل التأثيرات الجانبية بسبب محدودية التراكيز الدوائية في الدوران الدموي الجهازي وارتفاعها في البرانشيم الدماغي، ومن جهة أخرى فإن التحرر المديد للمواد الدوائية تتيح طواعية أفضل عند الاستخدام السريري.
كلمات مفتاحية : الجسيمات النانوية، الأدوية المضادة للصرع، فنتوئين، كورسيتين، التجريع الأنفي.
المقدمة Introduction:
يعتبر الصرع ثالث الأمراض العصبية شيوعاً، مؤثراً على حياة ما يزيد عن 65 مليون شخص حول العالم (1). الصرع هو اختلال عصبي محدث بسبب فعالية عصبية شاذة في الدماغ والتي تؤدي بدورها إلى حدوث الاختلاجات (2). تصنف النوبات الصرعية إلى عامة (General seizure) و بؤرية (Partial seizure) بحسب مركز نشوء النوبات وانتشارها (3). يرجح أن يكون للصرع مسببات بيئية أو وراثية ترتبط بخلل في كمون مستقبلات القنوات الشاردية أو تعديلات النمط T من قنوات الكالسيوم والتي تخفض بدورها من العتبة الحدية اللازمة لاثارة الخلايا العصبية الهرمية محفزة نشوء الاختلاجات (4, 5). كما تعد الطفرات في قنوات الصوديوم مسوؤلةً عن متلازمة الصرع الجيني (6). يستخدم الفنتوئين في تدبير النوبات الصرعية، حيث يقلل من تواتر وشدة النوبات الصرعية البؤرية والمعممة في القشرة الدماغية الحركية (7). يستطب الفنتوئين بشكل اساسي لعلاج الصرع الكبير grand mal seizures بدون التسبب بحدوث وهن أو دوار على عكس أدوية الصرع الأخرى. تكمن الآلية الاساسية لعمل الفنتوئين في التقليل من التدفق العصبي عبر قنوات الصوديوم و اغلاق النمط T من قنوات الكالسيوم (8, 9). يترافق استخدام الفنتوئين بالعديد من المشاكل بسبب انحلاليته الضعيفة جداً في الماء وميله الشديد للتبلور مما يؤدي إلى ترسبه في السوائل الحيوية. يؤدي ترسب الفنتوئين في المعدة إلى امتصاص بطيئ متفاوت بين الأشخاص (10)، كما يؤدي ترسب الفنتوئين في الأوعية الدموية بشكل بلورات إبرية بعد التجريع الوريدي إلى ألم واحساس بالحرق يتطور عند بعض المرضى إلى الاصابة بالخثار الوريدي (11). من جهة أخرى فإن الفنتوئين من الأدوية عالية الألفة للارتباط ببروتينات البلازما وخصوصاً الألبومين، مما يؤدي إلى تقليل التوافر الحيوي للفنتوئين (12). يعتبر الشكل الأنفي طريق إيتاء دوائي غير باضع لتوصيل المواد الدوائية للدماغ. تعود أهمية الطريق الأنفي بالتوصيل الدوائي الدماغي إلى وجود طريق عصبي مباشر بين المخاطية الأنفية والنسج الدماغية يتضمن الطريق العصبي الشمي والعصب مثلث التوائم (13). كما يتميز الإيصال الأنفي بقدرته على تجنب المرور الكبدي الأول. على الرغم من الدور المهم للطريق الأنفي فإن مساحة السطح المحدودة المتاحة للامتصاص في المخاطية الأنفية و وصغر حجم الجرعة الدوائية التي يمكن تطبيقها وسرعة التصفية الدوائية عبر الأهداب والمخاطية الأنفية تجعل منه طريقاً يتطلب تطبيق أنظمة توصيل دوائية خاصة لتحقيق الفعالية الدوائية المرجوة (14). حققت الجسيمات النانوية أهمية كبيرة في السنوات الأخيرة وذلك لما تتميز به من خواص فيزيوكيمائية فريدة تجعلها قادرة على كبسلة و حماية وتأمين التحرر الموجه للمواد الدوائية إلى الأنسجة الهدف (15). الكيتوزان هو بوليمير طبيعي دروك حيوياً استُخدم سابقاً في العديد من الأبحاث لتوصيل الأدوية العصبية و المضادة للسرطان إلى الجملة العصبية المركزية عبر الشكل الأنفي (16). يكسب توضع الكيتوزان على سطح الجسيمات النانوية العديد من المزايا من أهمها الخواص اللصوقة حيوياً والتي تخفض من تصفية الجسيمات من المخاطية الأنفية وتزيد النفاذية عبر الأغشية الخلوية (17, 18). تم تطوير العديد من الأنظمة الحاملة للدواء في السنوات الأخيرة بهدف الإيصال الاستهدافي للفنتوئين الى الدماغ منها أنظمة الهيدروجيل المحفزة بالكهرباء والمعدلة بالبيبتيد angiopep-2. كان الهيدروجيل المصنع وبعد التعريض لحقل كهربائي خارجي قادراً على تقليل شدة النوبات الصرعية بجرعات كبيرة وصلت حتى 20 ملغ/ كلغ بعد الإعطاء الصفاقي. كما طبقت جسيمات الكيتوزان والليسيتين بنجاح نظاماً لإيصال عدد من المواد الدوائية بالطريق الأنفي. حيث حسنت الجسيمات الحاوية على بيبتد anti-caspase من إيصال و فعالية البيبتيد المكبسل (19). وفي دراسة أخرى تم استخدام جسيمات الكاربوكسي ميتيل كيتوزان النانوية بهدف الإيصال الأنفي الدماغي للكاربامازيبين وتمت المقارنة مع الإيصال الفموي والوريدي. حيث عززت الخواص اللصوقة حيوياً للكيتوزان من مدة بقاء الجسيمات على تماس مع المخاطية الأنفية عبر الروابط الكهربائية الساكنة بين مجموعات الأمين على مجموعات الغليكوزامين في سلاسل الكيتوزان وبين الشحنات السلبية لمجموعات حمض السياليك في الطبقة المخاطية الأنفية (20). يشاهد الصرع المرتد أو المقاوم refractory epilepsy عند 30% من مرضى الصرع ويتميز بأنه غير قابل للضبط بفعالية عبر استخدام الأدوية المثبطة للنوبات الصرعية. تمت دراسة الآليات الكامنة خلف توليد الصرع المقاوم في العديد من الأبحاث وتعتبر الآليات الخلوية من أهمها(21). يعد فرط التعبير في بعض البروتينات الدماغية عند بعض المرضى المسؤول الأول عن الظاهرة المرضية وخصوصاً مضخة الغلكوبروتين P (P-PG)، والتي بدورها تعمل على إعادة ضخ المواد الدوائية خارج النسيج الدماغي ومن ثمّ توليد مقاومة للمعالجة الدوائية للنوبات الصرعية (22). أظهرت العديد من الدراسات العلاقة بين تعبير الـ P-GP وتركيز المادة المضادة للصرع في الدماغ (23, 24). بناءً عليه، رُكّز على مقايسة كمية الفنتوئين في النسيج الدماغي في هذه الدراسة واعتباره معياراً لنجاعة التوصيل الدوائي الدماغي (12). تستخدم خلاصة الجنكوبيلوبا في علاج الاضطرابات الوعائية الدماغية وكمعالجة داعمة عند مرضى الصرع. يحتوي الجنكوبيلوبا على الفلافونيدات ( 2- فينيل بنزو 𝛼 بنزو بيرونات) والتي توصف بأنها مركبات عديدة الفينول موجودة طبيعيا في العديد من النباتات. تحتوي الفلافونيدات على بنية الفينيل كرومانون ذو التسلسل (C6, C3, C6) مع تبادل هيدروكسيدي واحد على الأقل (25). تمتلك هذه المركبات ميزة مصدرها الطبيعي وكونها ذات مأمونية عند حيوانات التجربة. أثبتت فعالية بعض من هذه الفلافونيدات بالتأثير على الـ P-GP ومن أهم هذه الفلافونيدات هو الكوريسيتين 2-(3,4- dihydroxyphenyl)-3,5,7-trihydroxy-4 H-1-benzopyran-4-one، (26). يستخدم الكوريسيتين على أنه مضاد اكسدة و في علاج القرحات والحساسية وقاتل للخلايا السرطانية (27). كما أثبت الكوريسيتين فعاليته مثبط لل P-GP في العديد من الصفوف الخلوية مثل human cervical carcinoma و EPP85-181RDB و EPP85-181P التي تبدي تعبيراً للغليكوبروتين P. (28, 29). جرى في هذه الدراسة تقييم دور الكويرسيتين في عكس الآلية المسببة لتوليد الصرع المقاوم عند المرضى المعالجين بالفنتوئين . كما استُخدم الفيراباميل للدراسة المقارنة، حيث يعتبر الفيراباميل دواء مثبط لـ P-GP توصي منظمة الأدوية والغذاء الامريكي لاستخدامه في اختبارات التداخلات الدوائي و يؤدي الاعطاء المشارك للفيراباميل مع المواد الدوائية الى تغيرات في التراكيز البلازمية لتلك الأدوية (30, 31). قام Wang وزملاؤه باثبات زيادة الكويرسيتين لتراكيز الديجوكسين في البلازما عند التجريع المشترك لكلتا المادتين عند الخنازير و أثبت دور الكويرسيتين على تحسين امتصاص talinolol عند متطوعين أصحاء وزيادة التوافر الحيوي عبر تثبيط الـ P-GP،(32). كما ذكر Dupuy وزملاؤه أن الاعطاء المشترك للكوريستين و moxidectin حسن من التوافرالحيوي للـ moxidectin عند الخراف (33). وجد Singh وزملاؤه أن الإعطاء المتزامن للفنتوئين فمويا بجرعة 25ملغ/ كلغ مع الفلافونيدات الموجودة بخلاصة Glycyrrhiza glabra كان له تأثيربزيادة التراكيز الدماغية للفنتوئين عند الفئران المحرضين صرعياً باستخدام الـ PTZ .(34) كما بين Zhang وزملاؤه أن خلاصة الجنكوبيلوبا كان لها التأثير الأكبر بتثبيط مضخات الـ P-GP وانقاص شدة الاختلاجات الصرعية عند فئران التجارب المعالجين بالـ PTZ بفعالية مشابهة للفيراباميل وبفارق احصائي معتد به بالمقارنة مع المجموعة التي تم تجريعها بالفنتوئين فقط. حيث ابدت الفئران المعالجة بالفنتوئين بجرعة 40 ملغ/ كلغ فموياً بشكل مرافق لخلاصة الجنكوبيلوبا 30 ملغ/ مل أو الفيراباميل 20 ملغ/ كلغ صفاقياً بفاصل زمني 30 دقيقة تراكيز دماغية بلغت 1.1 مكغ/ مل بينما بلغت التراكيز الدماغية للفنتوئين عند تجريعه بشكل متزامن مع الوقاء الملحي كشاهد سلبي 0.9 مكغ/ مل (35). حتى الآن لا يوجد دراسة عن كبسلة الفنتوئين والكوريسيتين ضمن الجسيمات النانوية بهدف الإيصال الدوائي الأنفي. بناء على دراستنا السابقة المنشورة (36) حُضّر الكيتوزان والليسيتين النانوية والمحملة بمادة الفنتوئين والكوريستين معاً باستخدام تقنية الترسيب النانوي. تم استخدام زيت الترياسيتين كنواة زيتية حاملة للفنتوئين، التوين ٨٠ كعامل مثبت للصيغة، الليسيتين كبوليمير بنيوي للجسيمات المصنعة، والكيتوزان كبوليمير مغلف لاعطاء الشحنة الايجابية لسطح الجسيمات النانوية.
- 2. المواد والطرائق
2.1. المواد
الفنتوئين، 5,5 دي فنيل هيدانتوئين من شركة JPN PHARMA، الهند. محلول الفنتوئين المعد للإعطاء الوريدي (50 ملغ/ مل) من شركة Pfizer، الولايات المتحدة الأمريكية. الكيتوزان المنخفض الوزن الجزيئي، حمض الخل، الترياسيتين، البولوكزامير 188، الكويرسيتين و أكياس التحال ذات الوزن الجزيئي (MWCO 12 000 Da) من شركة Sigma-Aldrich Co، ألمانيا. الليسيتين المكون من الفوسفاتيديل كولين 51.9 % و الفوسفاتيديل ايتانول أمين 12.5 % من شركة Cargill Co، ألمانيا. الأسيتون، الايتانول من شركة Eurolab، بريطانيا. الميتانول، الكلوروفورم من شركة Merck، ألمانيا. التوين 80 والتوين 20 من شركة AppliChem، ألمانيا. محلول الفيراباميل المعد للإعطاء الوريدي من شركة Abbot، الولايات المتحدة الامريكية.
2.2. تحضير جسيمات الكيتوزان والليسيتين المحملة بمادتي الفنتوئين و الكويرسيتين
تم تحضير جسيمات الكيتوزان والليسيتين وفقاً للطريقة المنشورة سابقاً مع بعض التعديلات (36). تم حل 10 ملغ من الليسيتين و 1.2 ملغ من الكويرسيتين في 5 مل من الاسيتون والايتانول بنسبة 60:40%) حجم لحجم). تم حل الفنتوئين في 200 مكل من الترياسيتين واضافته إلى الطور العضوي. حُلت كمية من الكيتوزان مساوية لـ 1.25 ملغ في الماء منزوع الشوارد والمحمض بحمض الخل بنسبة (1: 1.75) واضافة التوين 80 بنسبة 0.2%. أُضيف الطور العضوي إلى الطور المائي نقطة فنقطة مع التحريك بالمحرك المغناطيسي (600 دورة في الدقيقة). تم التخلص من الطور العضوي بتبخير المعلق الناتج تحت الضغط المنخفض باستخدام المبخر الدوار (vacuum of 168 mbar, 70 C, BUC ̈THI). تم تثفيل المعلق النانوي بالمثفلة المبردة (Eppendorf USA) بسرعة 3214g ولمدة 15دقيقة وبدرجة 4˚c بهدف فصل الجزء الغير منحل من البوليميرات الغير متفاعلة ثم أعيد حل الرسابة بـ 1مل من الميتانول وتحليلها باستخدام الفصل على الصفيحة الرقيقة عالية الأداء HP-TLC. فُصلت الجسيمات النانوية باستخدام أنابيب الترشيح الفائق Viva spin, Sartorius, New York ذات الابعاد 100 كيلو دالتون و تثفيل أنابيب الترشيح الفائق على سرعة 3214 g ولمدة 2 ساعة بدرجة حرارة 20˚c وجُمعت الجسيمات من الحجرة العلوية لأنابيب الترشيح.
2.3. قياس متوسط أبعاد الجسيمات وتشتت الأبعاد وشحنة السطح
قيس متوسط أبعاد الأجزاء باستخدام مقياس تشتت الضوء الديناميكي Dynamic light scattering (DLS), Malvern Zetasizer, UK. مُدّد المعلق النانوي باستخدام الماء المنزوع الشوارد لخمسين ضعف من حجمه وإجراء القياس بدرجة 25˚c وجمع الضوء المتشتت بزاوية 90 ˚ لمدة دقيقتين. تم عرض النتيجة متوسطاً حسابياً لعشرين قراءة وأخذ ثلاث مكررات لكل قياس.
تم قياس شحنة السطح (كمون زيتا) للجسيمات المحضرة باستخدام مقياس تشتت الضوء الديناميكي Malvern Zetasizer, UK. حيث تم تمديد العينة المفحوصة 50 مرة باستخدام الماء المنزوع الشوارد وضبط الجهاز على نمط قياس كمون زيتا. تم القياس بدرجة 25˚c و عرض النتيجة متوسطاً حسابياً لعشرين قراءة وأخذ ثلاث مكررات لكل قياس.
4.2. حساب كفاءة الكبسلة للـفنتوئين في الجسيمات النانوية المصنعة
قيس القسم غير المكبسل من الفنتوئين و الكويرسيتين في الرشاحة الصافية الناتجة عن فصل الجسيمات بأنابيب الترشيح الفائق باستخدام الـ HP-TLC باتباع الطريقة التي أشار إليها Pippenger وزملاؤه مع بعض التعديلات (37). تم تطبيق 20 مكل من العينة آلياً بشكل خطي بفاصل 1.2 سم بين كل عينتين وبعد 1سم عن حافة طبقة الألمينوم المغطاة بجيل السيليكا (CAMAG automatic TLC sampler 4, Germany). جرى تطوير العينات باستخدام مزيج من الكلوروفورم والأسيتون بنسبة (9:1) حجم لحجم ومقايسة امتصاص العينات المطبقة للأشعة فوق البنفسجية باستخدام قارئ الصفيحات (CAMAG TLC scanner 3, Germany) وحساب تركيز الفنتوئين و الكويرسيتين من السلسلة العيارية لكل منهما وحُسبت كفاءة الكبسلة من العلاقة التالية:
2.5. منحني التحرر
عُلقت الجسيمات النانوية في 5 مل من الماء المنزوع الشوارد ووُضعت في أكياس التحال ذات المسام 12000 دالتون (Sigma-Aldrich) و تم التحال بوسط من الماء المنزوع الشوارد بحجم 50 مل. تم أخذ العينات وتعويض الحجم خلال نقط زمنية معينة و بُخرت العينات المأخوذة باستخدام المبخر الدوار بضغط 72 ميلي بار ودرجة حرارة 80˚c . أعيد حل العينات بـ2 مل من الميتانول و تحليلها باستخدام الكروماتوغرافيا العالية الأداء HPLC.
2.6. دراسة شكل الجسيمات المحضرة باستخدام المجهر الالكتروني الماسح SEM
استخدمت صور المجهر الالكتروني الماسح لمقايسة شكل الجسيمات المحضرة ولرسم منحني توزع أبعاد الجسيمات. باختصار مُدّدت العينة عشر مرات باستخدام الماء المنزوع الشوارد بدون أي طلي. تمت دراسة الجسيمات بمجهر (VIGA II Xmu, TESCAN) باستخدام حزمة الكترونية 20 كيلو فولط. شُوهدت العينات باستخدام متحري الالكترون الثانوي مع تكبير تراوح بين 1000 لـ 3000 وسرعة مسح 8.
7.2. الإيتاء الأنفي للمعلق النانوي المحضر
استُخدمت طريقة غير باضعة لتجريع الفأر الواعي بالاستفادة من منعكس الاستنشاق الطبيعي وفق طريقة Hanson وزملاؤه (18). تكمن أهمية هذه الطريقة في التجريع أنها تجنب احتمال دخول الجرعة للطريق الهضمي و الآثار الجانبية للطرق الباضعة. من جهة أخرى فإن تجريع الفأر الواعي بدون تخدير يقلل من تشويش النتائج المحتمل الناتج عن الشدة المطبقة عند الفأر. باختصار، جرى تنقيط 15 مكل من المعلق النانوي في الفتحة الأنفية عند الفأر الواعي مما يمكن من وصول المعلق النانوي الى القسم العلوي من التجويف الأنفي. تم تكرار التجريع نقطة فنقطة ثلاث مرات حتى وصول الجرعة المعطاة إلى 60 ميكروليتر حاوية على جرعة من الفنتوئين 15 ملغ لكل كلغ من جسم الكائن الحي. بلغ الزمن اللازم للتجريع 5 دقائق. تمكن تجزئة الجرعة الأنفية بهذه الطريقة من تقليل التصفية الهدبية المخاطية للجرعة المعطاة و الحد من تسربها عبر السبيل الهضمي.
2.8. إجراءات التعامل مع حيوانات التجربة
تمت جميع الإجراءات على حيوانات التجربة وفقا للمعايير العامة لوحدة حيوانات التجربة لدائرة السميات التابعة لقسم التقانة الحيوية والبيولوجيا الجزيئية في هيئة الطاقة الذرية. في القسم الأول من التجارب تم تجريع المعلق النانوي المختار بالطريق الأنفي لـ 15 من الفئران الاناث نمط Balb/c تراوحت أعمارهم بين 12-16 أسبوعاً و أوزانها بين 20 لـ 30 غراماً. تم تقسيم الحيوانات المدروسة عشوائيا لـ 5 مجموعات وتجريعهم بما يعادل جرعة من الفنتوئين 15 ملغ لكل كلغ من الكائن الحي. جُرّع عدد مكافئ من فئران التجربة بمحلول الفنتوئين الحر التجاري كشاهد ايجابي بالطريق الصفاقي.
2.9. استخلاص الفنتوئين من الأنسجة الدماغية و التحليل بواسطة الكروماتوغرافيا العالية الأداء
خُدرت الفئران المدروسة عند كل نقطة زمنية من التجربة باستخدام مزيج حاوي على 87.5 و 12.5 ملغ لكل كلغ من الكيتامين والاكزيلاسين على الترتيب. تم الحصول على العينات الدموية بعد عزل القلب والسحب الدموي المباشر منه. جُمعت العينات الدماغية بعزل النسيج الدماغي كاملاً. استُخلص الفنتوئين بالميتانول و تثفيل العينات الدموية (1 مل ) بسرعة 2469 g لمدة 15 دقيقة باستخدام (MPW-260R, Poland) لفصل طبقة البلازما. مُددت البلازما الناتجة بـ 10مل من الميتانول. تم طحن النسيج الدماغي بالمجانس عالي السرعة بسرعة 25000 دورة في الدقيقة. أُخذت ثلاث عينات دماغية ودموية شواهد سلبية من الفئران المدروسة وتم تطعيم ثلاث عينات أخرى بمحلول مركز من الفنتوئين بتركيز 25 مكغ/ مل شواهد إيجابية للعملية التحليلة. تم تعريض العينات للأمواج فوق الصوتية باستخدام المسبار الخاص بقوة 20 دورة و سعة100% باستخدام (Sartorius AG, Germany) والتثفيل بسرعة 3214 g لمدة 15 دقيقة وحرارة 4 ˚c. جُمع الطافي الناتج عن التثفيل ورُكّزت العينات باستخدام التجفيف بالتخلية (Eppendorf concentrator 5301, Germany) واعادة تعليق الناتج بـ 200 ميكروليتر من الميتانول. تم التثفيل النهائي للعينات بسرعة 18188 g لمدة 30 دقيقة وحرارة قدرها 4˚c. رُشحت العينات الناتجة باستخدام مراشح Minisart® ذات اأبعاد 0.45ميكرو متر قبل الحقن بعمود الكروماتوغرافيا العالية الأداء. تمت مقايسة تركيز الفنتوئين في العينات الحيوية باستخدام JASCO HPLC, Japan بمتحري الأشعة فوق البنفسجية وفق طريقة Ningrum وزملاؤه (38). تم استخدام مزيج الميتانول والماء بنسبة (55 : 45) واستخدام عمود C8 بطول 250 mm وعرض 4.6 وأبعاد جسيمات 5 ميكرومتر كطور ثابت وتطبيق درجة حرارة 40˚c وسرعة تدفق 1 مل في الدقيقة و مقايسة القمم الناتجة بضوء ذو طول موجة 210 نانومتر.
2.10. أمثلة زمن إيتاء الفيراباميل في الدراسة المقارنة
استخدم الفيراباميل دواء شاهداً ذا فعالية مثبتة بتثبيط الغليكوبروتين P و قُورن دوره بالنسبة لتأثير الفلافونيد المدروس وهو الكويرسيتين. تم إيتاء حقنة داخل الصفاق من الفيراباميل بجرعة 25 ملغ/ كلغ عند فئران التجارب قبل فواصل زمنية متفاوتة عن نقطة تجريع الفنتوئين ( 15، 30، 60، 120 دقيقة). تم إيتاء القنتوئين بشكل حقن داخل الصفاق بجرعة 15ملغ/ كلغ وقُورنت النتائج لمعرفة الفاصل الزمني الأمثل للحصول على تثبيط ملائم لمضخة الـ P-GP وفقاً لمقايسة تركيز الفنتوئين في النسيج الدماغي.
2.11. أمثلة جرعة الفيراباميل لاستخدامها في الدراسة المقارنة
تم اعطاء جرعات متزايدة من الفيراباميل بشكل حقن داخل الصفاق 12.5، 25، 50 ملغ/ كلغ عند فئران التجارب بفاصل زمني 30 دقيقة قبل تجريع الفنتوئين داخل الصفاق بجرعة 15ملغ/ كلغ. تمت مقارنة النتائج لمعرفة جرعة الفيراباميل المثلى للحصول على تثبيط ملائم لمضخة الـ P-GP وفقاً لمقايسة تركيز الفنتوئين في النسيج الدماغي.
2.12. فصل البرانشيم الدماغي عن الأوعية الدموية الدماغية
بهدف تأكيد توضع المادة الدوائية المدروسة ضمن البرانشيم الدماغي واستبعاد القسم الموجود ضمن الأوعية الدموية الشعرية الدماغية، تم فصل البرانشيم الدماغي عن الأوعية الشعرية وفق الطريق الموضحة في عمل Kafa وزملاؤه (39). وُضع النسيج الدماغي في مجانس زجاجي مع 0.8 مل من وقاء الفصل المبرد (10 mM HEPES in HBSS, pH 7.4) تم الطحن 15 مرة ثم اضافة 1.6 مل من وقاء الفصل الحاوي على الديكستران 27% ذو الوزن الجزيئي 147 كيلو دالتون. تم طحن النسيج الدماغي بشكل إضافي لمدة ثلاث مرات وتثفيل النسيج المطحون بسرعة 3220g ولمدة 15 دقيقة. توضع البرانشيم الدماغي في القسم الطافي بينما توضعت الشعيرات الدموية الدماغية في الرسابة. جرى الاستخلاص اللاحق للفنتوئين ومقايسته وفق الطريقة المبينة في الطرائق.
2.13. دراسة تاثير المشاركة بين الفنتوئين و الكويرسيتين على التراكيز الدماغية للفنتوئين عند حيوانات التجربة
قُسمت المجموعات المدروسة عند فئران التجارب الى أربع مجموعات شملت كل مجموعة على ثلاث فئران. في المجموعة الأولى تم تجريع الكويرسيتين بجرعة 15 ملغ/ مل بشكل حقن داخل الصفاق ثم اُتبع بتجريع الفنتوئين داخل الصفاق بفاصل زمني بلغ 30 دقيقة. في المجموعة الثانية حُقن الكوريستين داخل الصفاق ثم اُتبع بالتجريع الأنفي للجسيمات النانوية المحملة بالفنتوئين بفاصل زمني بلغ ثلاثين دقيقة. في المجموعة الثالثة تم تجريع الفيراباميل داخل الصفاق بصفته شاهداً إيجابياً ثم تجريع الجسيمات النانوية المحملة بالفنتوئين عن طريق الأنف بفاصل زمني ثلاثين دقيقة. في المجموعة الرابعة تم تجريع جسيمات الكيتوزان النانوية المحملة بمادتي الفنتوئين والكوريسيتين عن طريق الأنف. تمت دراسة النتائج ومقارنتها مع التجارب الشاهدة.
2.14. تحليل البيانات الناتجة
عُبّر عن النتائج كنسبة مئوية من الجرعة المعطاة بالنسبة لوزن العضو وتمت إعادة التجارب ثلاث مرات وتم التحليل الاحصائي باستخدام اختبار الاختلاف وحيد الاتجاه ANOVA one way الذي تم تطبيقه باستخدام برنامج Prism v 7.0 وفق دلالة إحصائية *p < 0.05, **p < 0.01, ***p < 0.001.
- 3. النتائج
3.1. دراسة العلاقة الخطية بين تراكيز المواد الدوائية المدروسة والاستجابة
دُرست العلاقة بين ارتفاعات القمم وتراكيز الفنتوئين و الكويرسيتين التي حُلّلت باستخدام الـ HP-TLC. ظهرت قمم الفنتوئين المنتاظرة والجيدة الفصل عند Rf يساوي 0.2 للفنتوئين و0.05 للكويرسيتين. كانت العلاقة بين ارتفاعات القمم المدروسة وتراكيز المواد التي تمت معايرتها خطية في المجال بين10 و50 مكغ/ مل أو بين 0 و 140 نانو غرام بالبقعة المطبقة ومعادلة الخط المستقيم للكويرسيتين هي مع قيمة معامل الارتباط 0.993= R2 ومعادلة الخط المستقيم للفنتوئين مع قيمة معامل الارتباط 0.996 = R2. بلغت الفوارق بين القيم الحقيقة و القيم المختبرة أقل من 5٪. ظهرت النقط موزعة عشوائياً على طرفي القيمة صفر. لم يوجد أي دليل على عدم خطية الطريقة التحليلة ضمن حدود ثقة 95%. تمت دراسة مساحات قمم الامتصاص الناتجة عن مقايسة الفنتوئين والكويرسيتين باستخدام الـ HPLC كتابع لتراكيز المواد الدوائية المدروسة لاثبات الخطية في طريقة التحليل. احتوى الطور المتحرك على الميتانول والماء بنسبة 55: 45% حجم لحجم ونتج عنه قمم جيدة الفصل متناظرة عند زمن احتباس بلغ 4.6 دقيقة للفنتوئين و 3.8 دقيقة للكوريسيتين. العلاقة بين مساحات القمم والتراكيز كانت خطية في المجال بين 0 -50 ميكروغرام بالمل و معادلة الخط المستقيم للكويرسيتين مع قيمة معامل الارتباط0.997 = R2 و معادلة الخط المستقيم للفنتوئين مع قيمة معامل الارتباط 0.999 = R2. الفروقات عند كل نقطة بين القيم الحقيقة والقيم الناتجة كانت ضمن2% حيث كانت نسبة الخطأ مقبولة بالنسبة لحدود الثقة 95%. توزعت النقاط على خط الانحدار بشكل عشوائي حول القيمة صفر. ولم يكن هناك دليل
عن عدم خطية الطريقة التحليلة المتبعة كما هو موضح بالشكل
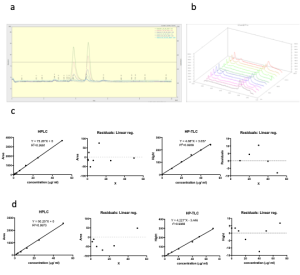
.2. الخواص الفيزيوكيمائية لجسيمات الكيتوزان والليسيتين المحملة بالفنتوئين والكويرسيتين
3.2.1. الشكل الظاهري لمعلق الجسيمات النانوية
انخفاض انحلالية الفنتوئين والكوريسيتين في الأوساط المائية يعد من أكبر التحديات التي تعيق فعاليتهما في الأنظمة الدوائية الحيوية. حُمّلت مادة الفنتوئين على النواة الزيتية ومادة الكوريستين في الطور العضوي للتحضير بغاية حماية المواد الدوائية من الترسب ولترك المواد الدوائية متاحة للامتصاص الحيوي والفعالية الدوائية. تبعثر الجسيمات في الوسط المائي تمت مقايستها عيانياً. لم تلاحظ تكدسات عيانية أو ترسيب في المعلق النانوي. توزع حجم الجسيمات المقاس باستخدام مقياس التشتت الضوئي أظهر عدة تجمعات مع تجمع رئيسي ذو ارتفاع أعظمي يعكس الحجم الأكثر تكرراً (الشكل 2. A).
3.2.2. الحجم الديناميكي الوسطي وتشتت الأبعاد و شحنة السطح للجسيمات المحضرة
حُضّرت الجسيمات المدروسة باستخدام طريقة الترسيب النانوي. تم استخدام 1.25ملغ من الكيتوزان مع 10 ملغ من الليستين كبوليمير هيكيلي. تم تحميل 1.2 ملغ من الفنتوئين ضمن 200 مكل من الترياسيتين كنواة زيتية وحل الكوريسيتين ضمن الطور العضوي. كما استُخدم التوين 80 عاملاً مثبتاً فعالاً على السطح غير متشرد بنسبة% 0.2.
تمت الاشارة في الشكل 2 إلى الحجم الوسطي للجسيمات المحضرة والحجم الأكثر تكرارية. بلغت القيمة الوسطية للحجم 345.43±25.13 نانومتر وتشتت الأبعاد 0.225 وقد أبدى مخطط توزع الحجم المقاس باستخدام المجهر الالكتروني الماسح توافقاً مع نتائج مقياس التشتت الضوئي الديناميكي. ظهرت الجسيمات في المجهر الالكتروني الماسح بشكل كروي الشكل مع سطح أملس ولا وجود لبلورات الفنتوئين في الوسط. بلغت شحنة الجسيمات السطحية 52.23±0.45+ ميلي فولط وكفاءة الكبسلة لكل من الفنتوئين والكويرستين60.12±4.4، 58.04± 6.2 على التوالي.

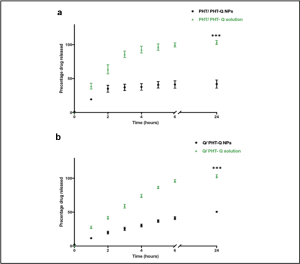
3.3. دراسة تحرر الفنتوئين والكوريسيتين من الجسيمات النانوية
يظهر الشكل 3 منحني تحرر المواد الدوائية من الجسيماتالمحضرة مع الزمن. تحرر كلاً من الفنتوئين والكويرسيتن بشكل متزايد من الجسيمات المحضرة لتصل النسبة المتحررة إلى44.3± 0.64% و 50.4±0.82% على الترتيب، من كمية الدواء الابتدائية المكبسلة ضمن الجسيمات خلال زمن قدره 24 ساعة. بينما أبدى محلول الفنتوئين والكوريستين تحرراً سريعا للمادتين الدوائيتين حيث بلغ التحرر 96.4 ±1.7% و 97.05±1.7% على الترتيب خلال 6 ساعات.
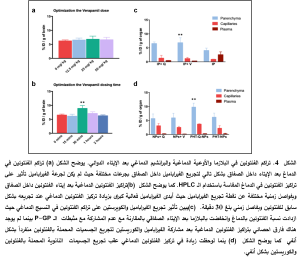
.4. أمثلة زمن الإيتاء وجرعة الفيراباميل لاستخدامها في الدراسة المقارنة
صُمّمت تجربة شاهدة لمعرفة التركيز والفاصل الزمني الأمثل لتطبيقه عند مشاركة مثبط الـ P-GP وهو الفيراباميل أو الكويرسيتين مع الفنتوئين كركيزة الـ P-GP و اُستخدم الفيراباميل كدواء شاهد لتُطبّق الشروط المثلى على التجارب اللاحقة. بينت النتائج الموضحة في الشكل 4 أن تركيز الفنتوئين في النسيج الدماغي قد ازداد من ( 6.5 ± 0.36%) عند تجريع محلول الفنتوئين ضمن الصفاق إلى (8.88 ± (%1.06 من الجرعة المعطاة منسوبة إلى وزن العضو المدروس عند تجريع الفيراباميل والفنتوئين ضمن الصفاق بفاصل ثلاثين دقيقة بين المادتين وبفارق معتد به احصائياً عن الأزمنة المختبرة الأخرى. كما بينت النتائج عدم وجود تأثير ذي دلالة إحصائية لجرعة الفيراباميل على زيادة التراكيز الدماغية للفنتوئين عند فئران التجارب وبناءً عليه تم استخدام جرعة الفيراباميل 25ملغ/ كلغ وبفاصل زمني 30 دقيقة سابق لتجريع الفنتوئين في التجارب اللاحقة.
3.5. دراسة تاثير المشاركة بين الفنتوئين والكوريستين على التراكيز الدماغية للفنتوئين عند فئران التجربة
طُبّقت عملية فصل الأوعية الدموية الدماغية عن النسيج الدماغي للعينات المدروسة لتحري مكان توضع الفنتوئين بعد عميليات التجريع المختلفة وتأثير الإيتاء المشارك مع مثبطات الـ P-GP. بينت النتائج زيادة ذات دلالة احصائية بتركيز الفنتوئين في النسيج الدماغي البرانشيمي بعد الإيتاء المشارك للفيراميل مع محلول الفنتوئين داخل الصفاق بفارق زمني ثلاثين دقيقة حيث بلغ (6.83 ± 1.78% من الجرعة المعطاة منسوبة إلى وزن العضو المدروس( وبلغ بعد تجريع الكويرسيتين (6.53 ± 0.567% من الجرعة المعطاة منسوبة إلى وزن العضو المدروس) وبالمقابل لوحظ انخفاض ذو دلالة إحصائية بتركيز الفنتوئين في البلازما الدموية عند مشاركة الفنتوئين مع الكوريسيتين أو الفيراباميل بالمقارنة مع التراكيز البلازمية المقاسة بعد تجريع الفنتوئين منفرداً داخل الصفاق حيث أصبح تركيز الفنتوئين في البلازما بعد المشاركة الدوائية مع مثبطات الـ P-GP في الإيتاء الصفاقي مماثلة لتراكيز الفنتوئين بالبلازما بعد الإيتاء الأنفي للفنتوئين منفرداً محملاً على الجسيمات النانوية التي حُضّرت في دراستنا المنشورة سابقاً كما هو موضح بالشكل 4. لم يلاحظ فارق يعتد به احصائياً عند تجريع الفيراباميل أو الكويرسيتين داخل الصفاق بشكل سابق للتجريع الأنفي لجسيمات الكيتوزان والليسيتين المحملة بمادة الفنتوئين منفرداً حيث بلغ تركيز الفنتوئين في البرانشيم الدماغي( 6.53 ± 0.56% من الجرعة المعطاة منسوبة إلى وزن العضو المدروس). من اللافت للانتباه هو الزيادة ذات الدلالة الاحصائية التي ترافقت مع التجريع الأنفي لجسيمات الكيتوزان والليسيتين النانوية المحملة بمادتي الفنتوئين والكوريسيتين حيث بلغ تركيز الفنتوئين في البرانشيم الدماغي 9.7 ± 1.44% من الجرعة المعطاة منسوبة إلى وزن العضو المدروس.
.4. المناقشة
استُخدم الفنتوئين بشكل شائع للسيطرة على النوبات الصرعية. يعاني الفنتوئين من عدم انحلاليته في الأوساط المائية مما يؤدي الى خلل في الامتصاصية وتشكيل بلورات الفنتوئين الإبرية في الأوساط الحيوية (40, 41). يعد التجريع الأنفي طريقاً مهماً للتوصيل الدوائي إلى الدماغ بسبب الاتصال الفريد بين التجويف الأنفي و والمنطقة الشمية في الدماغ. نالت الجسيمات النانوية مؤخراً الكثير من الاهتمام بسبب العديد من الخواص الفريدة خصوصاً في مجال الايتاء الدوائي الأنفي. تتميز هذه الجسيمات بتآلف و تدرك حيوي عالٍ ولبعضها خواص مهمة من حيث اللصوقة الحيوية لتأمين ايصال أنفي دوائي ناجح (42). جرى في هذا العمل تقييم فعالية جسيمات الكيتوزان والليسيتين المحملة بالكوريسيتن مع الفنتوئين في زيادة التوصيل الدوائي الدماغي للفنتوئين عن طريق الأنف. تم تحضير جسيمات الكيتوزان والليسيتين وفق الطريقة المنشورة سابقاً وبالاعتماد على طريقة Sonvico وزملاؤه باستخدام طريقة الترسيب النانوي للبوليميرات المنحلة في أوساط مختلفة. حيت تم حل الكيتوزان بالوسط المائي المحمض والليسيتين في الوسط العضوي (17). قام Gerelli وزملائه بتعريف التداخل بين الكيتوزان والليسيتين عند صياغة الجسيمات باستخدام مجهر الـ cryo-TEM والذي أثبت وجود بنية متعددة الأغشية الليبيدية محاطة بجزئيات الكيتوزان المشحونة ايجاباً (43). استُخدم الكيتوزان المنخفض الوزن الجزيئي في هذه الدراسة لامتلاكه سلاسل بوليميرية قصيرة قادرة على تشكيل جسيمات نانوية بأحجام صغيرة. بلغت درجة حموضة المعلق النهائي بين 4.5 لـ 5 والذي كان ملائماً لدرجة الحموضة الطبيعية في المخاطية الشمية مما يتفق مع الدراسات السابقة (44, 45). في الدراسة الحالية تم قياس كل من حجم الجسيمات وشحنتها. كانت شحنة الجسيمات ايجابية تماماً مما أعطى الجسيمات المحضرة ثباتية عالية بسبب التنافر الكهربائي الساكن بين الجسيمات المحضرة وخواص لصوقة حيوية عالية. حيث أبدت جسيمات الكيتوزان والليستين قدرتها على تأمين نظام توصيل دوائي آمن للمواد الدوائية القليلة الانحلال بالماء، كما تم استخدام الكيتوزان بمأمونية كمعزز نفاذية عند استخدامه مع الليسيتين في الكثير من الدراسات (46-49). في تجاربنا المعروضة استُخدم محل محب للدسم وهو الترياسيتين حيث دلت دراستنا السابقة (36)على أن تحميل الفنتوئين على الترياسيتن
يؤدي الى زيادة في كفاءة الكبسلة بسبب أن انحلالية الفنتوئين في الترياسيتين هي 200 ضعف عن انحلاليته في الماء (50) مما يتوافق مع العمل المجرى من قبل Clementino وزملاؤه على تحميل السيمفاستاتين ضمن حوامل زيتية وهيMaisine وLabrafac مما كان له دور بزيادة كفاءة الكبسلة للمادة المدروسة (47). قدم المجهر الالكتروني الماسح دليلاً موثوقاً على شكل الجسيمات المحضرة. حيث كانت الجسيمات كروية ومتجانسة بالشكل مع غلاف خارجي رقيق بسبب البنية الثنائية البوليمير المكونة من الكيتوزان والليستين. لم تُلاحظ في أًي من الصور وجود أي تكدس بين البنى النانوية المحضرة. استُخدمت طريقة التحال في هذا العمل وذلك لمراقبة تحرر المادة الدوائية من الجسيمات المحضرة. من أهم معوقات استخدام هذه الطريقة هي ممانعة كيس التحال المحتملة للحركة الحرة لجزيئات المادة الدوائية عبر مسام كيس التحال (51). ولهذا السبب، تم استخدام محلول الفنتوئين المائي كشاهد ايجابي في تجربة التحال والتي تمت في وسط مائي ذو درجة حموضة 5.5 مما ينسجم مع درجة الحموضة الطبيعية في المخاطية الأنفية (52). تم انهاء فحص التحرر بنقطة الـ 24 ساعة قبل التحرر الكامل للفنتوئين والكويرستين واللذين أظهرا تحرراً مديداً من الجسيمات المحضرة. أظهرت جسيمات التاموكسيفين في دراسة Barbieli وزملائه السلوك ذاته لتحرر المادة الدوائية من جسيمات الكيتوزان والليسيتين والذي استمر تحرر المادة الدوائية منها حتى 120 ساعة (53). دُرست قدرة الجسيمات على توصيل المادة الدوائية للدماغ باستخدام الفئران من فصيلة BALB/c حيث صُممت التجارب لمعرفة كمية الفنتوئين الواصلة للدماغ بعد إعطائه المشارك مع الكويرسيتين. على الرغم من توافر الفنتوئين بعدة أشكال صيدلانية فموية فإن الإعطاء الصفاقي يؤمن شاهداً ايجابياً لتوصيل المادة جهازياً. يعتمد التوصيل الأنفي الدماغي بشكل أساسي على طبيعة المادة المكبسلة وصياغة الجسيمات النانوية (54). بعض الأنظمة الصيدلانية تبدي القدرة على التوصول المباشر عبر االمخاطية الشمية والأعصاب الشمية والعصب المثلث التوائم بالاضافة لتوصيل المواد الى الدماغ عبر الدوران الجهازي مروراً بالحاجز الدماغي الدموي (55). على سبيل المثال، يبدي الكاربامازيبين المحمل على جسيمات الكيتوزان النانوية المعطى عن طريق الأنف القدرة على الوصول للدماغ عبر الدوران الجهازي مروراً بالحاجز الدموي الدماغي يعود ذلك الى الامتصاص السريع للكاربامازيبين عبر المخاطية الأنفية إلى المجرى الدموي (56). في عملنا الحالي، تراكم الفنتوئين في البرانشيم الدماغي بشكل أكبر احصائياً من تركيزه في البلازما وأقل من تركيز الفنتوئين البلازمي التالي للإيتاء الدوائي داخل الصفاق مما يرجح التوصيل الأنفي الدماغي المباشر للفنتوئين عند إعطائه محملاً على جسيمات الكيتوزان والليسيتين عبر المخاطية الشمية. قد يعود التوصيل المباشر للفنتوئين إلى الدماغ لوجود الشحنة السطحية الإيجابية والخواص اللصوقة حيوياً للكيتوزان مما يمكن أن تسهل الإيصال المباشر عبر المخاطية الشمية كما تم تأكيده في العديد من الدراسات (57, 58). تتفق هذه النتائج مع ما وجده Lui وزملاؤه حيث قام باستخدام جسيمات الكاربوكسي ميتيل الكيتوزان كحوامل لمادة الكاربامازيبين لإيصاله إلى الدماغ بالطريق الأنفي. أظهرت النتائج تراكيز دماغية أكبر احصائياً من الكاربامازيبين عندما تم ايصالها محملة على جسيمات الكاربوكسي ميتيل الكيتوزان بالمقارنة مع محلول الكاربامازيبين االحر. تراكم المواد الدوائية بنسبة عالية في الدماغ بالمقارنة مع البلازما يعكس دور الكيتوزان الهام في التوصيل الدماغي والذي قد يعود الى زيادة فترة تماس النظام الدوائي مع المخاطية الأنفية وتجنب المرور عبر الدوران الدموي العام أو التسرب إلى البلعوم (20). إن قوة تثبيط الـ P-GP تعتمد اعتماداً رئيسياً على عدة عوامل منها جرعة المادة المثبطة، الفاصل الزمني بين تجريع المادة المثبطة والركيزة، وطريق الإيصال الدوائي للمادة المثبطة و المنطقة الدماغية التي يتم استهدافها. نظراً للسمية المترافقة مع بعض هذه المثبطات كالفيراباميل يتم الميل لاستخدام الفلافونيدات الطبيعة القليلة السمية كالكويرستين (24). كان الهدف من الدراسة معرفة تأثير المشاركة بين مثبطات الغليكوبروتين P وبين الفنتوئين بعد تجريعه بطرق إيتاء مختلفة كالطريق الأنفي و الإيتاء الصفاقي بهدف الوصول لفعالية علاجية تفوق الأشكال التقليدية. كما كان متوقعاً، زادت تراكيز الفنتوئين في البرانشيم الدماغي بعد الإعطاء الصفاقي التالي لإيتاء الكويرسيتن أو الفيراباميل باعتبارهما مثبطات لـP-GP، بينما لم يكن هناك زيادة احصائية عند إيتاء الفنتوئين محملاً على الجسيمات النانوية بالطريق الأنفي بشكل تابع لإيتاء مثبطات الـ P-GP. تتفق النتائج مع ما وجده Candace وزملاؤه الذي رجح السبب لكون الطريق الأنفي يؤمن عبوراً مباشراً للمواد الدوائية دون المرور بالحاجز الدموي الدماغي مما يجعل تأثير تثبيط الـP-GP محصوراً على زيادة التراكيز الدماغية للمواد الدوائية ذات الطبيعة المحبة للدسم المعطاة جهازياً (59). ازدادت التراكيز الدماغية للفنتوئين تزايداّ واضحاً في البرانشيم الدماغي بعد تجريع الجسيمات الحاملة للفنتوئين والكوريسيتين معاً عن طريق الأنف. أكدت الدراسات المناعية النسيجية في دراسات سابقة وجود الغليكوبروتين P في المخاطية الانفية عند الفأر مما يخفف من التوصيل الدماغي للركائز الدوائية المعطاة بالطريق الشمي (59). ومن جهة أخرى فان عدداً من الدراسات تبين ان المواد الدوائية المعطاة بالطريق االأنفي قادرة على الوصول للنسيج الدماغي مباشرة عبر المخاطية الشمية وهناك ادلة على وجود طريق ايصال دموي موضعي عبرالشريان البصري المغذي للمخاطية الأنفية يسهم بعملية الايصال الانفي الدماغي. وبناءً على ذلك، فإنه من الممكن أن الإيتاء الأنفي المشترك لكلٍ من ركيزة الـ P-GP والمثبط يؤدي لتوصيل مثبطات الغليكوبروتين عبر الطريق الدموي الموضعي وبالتالي تأثيره المباشر على الـ P-GPالموجودة في كلٍ من المخاطية الأنفية و الحاجز الدموي الدماغي، وبالنيتجة فإن توصيل الفنتوئين الأنفي الدماغي سيزداد سواء كان التوصيل عبر الطريق الدموي الموضعي أو الطريق العصبي. وبعبارة أخرى فمن المرجح أن الإيتاء الأنفي المتزامن لكلٍ من الركيزة والمثبط حفز الامتصاص الدماغي لكلٍ من المادتين مما زاد من تثبيط الـ P-GP و تراكيز الفنتوئين في البرانشيم الدماغي (60-62). من جهة أخرى فإنه وبالمقارنة بين الاعطاء الجهازي و الإعطاء الأنفي للفنتوئين والكويرسيتين، فإن الطريق الأنفي يؤمن توصيل المواد الدوائية بشكل استهدافي للقسم الأمامي من الدماغ بينما يترافق التوصيل الجهازي أو الصفاقي مع انتشار المادة الدوائية بشكل أكثر تعميماً وأقل استهدافاً للنسج الدماغية مروراً بالحاجز الدموي الدماغي (59). ومن ثمّ فإن تطوير أنظمة دوائية حاملة لللركائز الدوائية لمضخات الـ P-GP مع مثبطات المضخة يؤمن فرصة مهمة لتأمين التوصيل الدماغي الاستهدافي لهذه المثبطات و الحد من السمية الجهازية لها بسبب محدودية دورانها في الجريان الدموي ويبرز هنا أهمية أمكانية التقليل من جرعة المواد المضادة للصرع المعطاة كقيمة مكتسبة من زيادة التراكيز العلاجية لهذه المواد في النسيج الدماغي عقب تجرعيها بشكل أنفي محملة على النظام الدوائي المقترح (63).
الخلاصة
جرى في هذه الدراسة تحضير جسيمات الكيتوزان والليسيتين المحملة بمادتي الفنتوئين والكويرسيتن بهدف تقديم نظام علاجي آمن قادر على توصيل الفنتوئين بشكل استهدافي إلى الدماغ. اختيار الطريق الأنفي كان بسبب الاتصال الفريد بين التجويف الأنفي والفص الشمي في الدماغ مما يؤمن عبوراً مباشراً مهماً للمواد المضادة للصرع والتي تسبب آثاراً جانبية عديدة عند توصليها بالطريق الجهازي. استخدام البوليميرات الدروكة حيوياً مثل الكيتوزان يقدم مزايا عديدة من أهمها الخواص اللصوقة حيوياً مما يسهم بشكل كبير بنجاح الإيصال الأنفي. تم تحقيق كفاءة كبسلة جيدة لكلٍ من المادتين غير المنحلتين في الماء بسبب استخدام الطور العضوي والنواة الزيتية كحوامل للمواد الدوائية أثناء التحضير. تم توظيف المجهر الالكتروني االماسح للتأكد من تحضير ودراسة شكل الجسيمات المدروسة والتي أبدت قدرة على تحرير المواد المحملة عليها بشكل مديد تجاوز 24ساعة. تبين عند دراسة تراكم المواد الدوائية في النسيج البرانشيمي الدماغي والأوعية الدماغية والبلازما عند فئران التجربة من نمط Balb/c توضع الفنتوئين في النسج الدماغية بتراكيز أكبر من تلك الموجودة في الدوران العام وبالمقابل كان تركيز الفنتوئين التالي للإيتاء الصفاقي في البلازما أكبر بشكل احصائي من تلك المحققة بعد الإيتاء الأنفي. حقق الكويرستين المحمل مع الفنتوئين عند إيتاؤه الأنفي الفعالية العظمى بتثبيط الـ P-GP والتي استدل عليها من تراكيز الفنتوئين المرتفعة في البرانشيم الدماغي بالمقارنة مع الإيتاء المنفصل لكلٍ من الفيراباميل والكوريستين بالشكل داخل الصفاق مع الفنتوئين بالشكلين الأنفي وداخل الصفاق. ستركز الدراسة المقبلة على دراسة الحرائك الدوائية والتوزع النسيجي للفنتوئين المحمل على جسيمات الكيتوزان والليسيتين وفعاليتها العلاجية بثبيط موجات الدماغ الكهربائية المرافقة للنوبات الصرعية عند حيوانات التجربة مما قد يقدم خطوة فعالة لتحسين معاناة مرضى الصرع والتخفيف من الجرعة الدوائية ومن ثم الآثار الجانبية للأدوية العصبية المعطاة بالطريق الجهازي.
المراجع :- Trinka E, Kwan P, Lee B, Dash A. Epilepsy in Asia: Disease burden, management barriers, and challenges. Epilepsia. 2019;60:7-21.
- McAuley JW, Elliott JO, Patankar S, Hart S, Long L, Moore JL, et al. Comparing patients’ and practitioners’ views on epilepsy concerns: A call to address memory concerns. Epilepsy & Behavior. 2010;19(4):580-3.
- Nordli DR. Focal and Multifocal Seizures. Swaiman’s Pediatric Neurology: Elsevier; 2017. p. 531-7.
- Carrizosa Moog J, Kakooza – Mwesige A, Tan CT. Epilepsy in the tropics: Emerging etiologies. Seizure. 2017;44:108-12.
- Espinosa-Jovel C, Toledano R, Aledo-Serrano Á, García-Morales I, Gil-Nagel A. Epidemiological profile of epilepsy in low income populations. Seizure. 2018;56:67-72.
- Sirven JI, Noe K, Hoerth M, Drazkowski J. Antiepileptic Drugs 2012: Recent Advances and Trends. Mayo Clinic Proceedings. 2012;87(9):879-89.
- Devinsky O, Vezzani A, O’Brien TJ, Jette N, Scheffer IE, de Curtis M, et al. Epilepsy. Nat Rev Dis Primers. 2018;4(1):18024.
- Robert-Gnansia E, Schaefer C. Antiepileptics. Drugs During Pregnancy and Lactation: Elsevier; 2007. p. 254-87.
- Flynn S, Babi MA. Anticonvulsants ∗ ∗The authors wish to acknowledge Dr. Vahn A. Lewis for his past contributions to this chapter. Pharmacology and Therapeutics for Dentistry: Elsevier; 2017. p. 176-92.
- Ingram KT, Kennewell PD. Major Drug Introductions. Reference Module in Chemistry, Molecular Sciences and Chemical Engineering: Elsevier; 2014. p. B9780124095472109771.
- Bauquier SH, Jiang JL, Yue Z, Lai A, Chen Y, Moulton SE, et al. Antiepileptic Effects of Lacosamide Loaded Polymers Implanted Subdurally in GAERS. International Journal of Polymer Science. 2016;2016:1-10.
- Wu MF, Lim WH. Phenytoin: A Guide to Therapeutic Drug Monitoring. Proceedings of Singapore Healthcare. 2013;22(3):198-202.
- Kim D, Kim YH, Kwon S. Enhanced nasal drug delivery efficiency by increasing mechanical loading using hypergravity. Sci Rep. 2018;8(1):168.
- Anselmo AC, Gokarn Y, Mitragotri S. Non-invasive delivery strategies for biologics. Nat Rev Drug Discov. 2019;18(1):19-40.
- Bernocchi B, Carpentier R, Lantier I, Ducournau C, Dimier-Poisson I, Betbeder D. Mechanisms allowing protein delivery in nasal mucosa using NPL nanoparticles. Journal of Controlled Release. 2016;232:42-50.
- Kaiser M, Pereira S, Pohl L, Ketelhut S, Kemper B, Gorzelanny C, et al. Chitosan encapsulation modulates the effect of capsaicin on the tight junctions of MDCK cells. Sci Rep. 2015;5(1):10048.
- Sonvico F, Cagnani A, Rossi A, Motta S, Di Bari MT, Cavatorta F, et al. Formation of self-organized nanoparticles by lecithin/chitosan ionic interaction. International Journal of Pharmaceutics. 2006;324(1):67-73.
- Hanson LR, Fine JM, Svitak AL, Faltesek KA. Intranasal Administration of CNS Therapeutics to Awake Mice. Journal of Visualized Experiments. 2013(74):4440.
- Ying X, Wang Y, Liang J, Yue J, Xu C, Lu L, et al. Angiopep-Conjugated Electro-Responsive Hydrogel Nanoparticles: Therapeutic Potential for Epilepsy. Angew Chem Int Ed. 2014:n/a-n/a.
- Liu S, Yang S, Ho PC. Intranasal administration of carbamazepine-loaded carboxymethyl chitosan nanoparticles for drug delivery to the brain. Asian Journal of Pharmaceutical Sciences. 2018;13(1):72-81.
- Potschka H, Löscher W. In Vivo Evidence for P‐Glycoprotein–Mediated Transport of Phenytoin at the Blood–Brain Barrier of Rats. Epilepsia. 2001;42(10):1231-40.
- Peachey LE, Pinchbeck GL, Matthews JB, Burden FA, Lespine A, von Samson-Himmelstjerna G, et al. P-glycoproteins play a role in ivermectin resistance in cyathostomins. International Journal for Parasitology: Drugs and Drug Resistance. 2017;7(3):388-98.
- Zhu T, Howieson C, Wojtkowski T, Garg JP, Han D, Fisniku O, et al. The Effect of Verapamil, a P-Glycoprotein Inhibitor, on the Pharmacokinetics of Peficitinib, an Orally Administered, Once-Daily JAK Inhibitor. Clinical Pharmacology in Drug Development. 2017;6(6):548-55.
- Nanayakkara AK, Follit CA, Chen G, Williams NS, Vogel PD, Wise JG. Targeted inhibitors of P-glycoprotein increase chemotherapeutic-induced mortality of multidrug resistant tumor cells. Sci Rep. 2018;8(1):967.
- Limtrakul P, Khantamat O, Pintha K. Inhibition of P-Glycoprotein Function and Expression by Kaempferol and Quercetin. Journal of Chemotherapy. 2005;17(1):86-95.
- Choi J-S, Piao Y-J, Kang KW. Effects of quercetin on the bioavailability of doxorubicin in rats: Role of CYP3A4 and P-gp inhibition by quercetin. Arch Pharm Res. 2011;34(4):607-13.
- Oh J-H, Lee JH, Lee Y-J. Evaluation of the Mrp2-mediated flavonoid-drug interaction potential of quercetin in rats and in vitro models. Asian Journal of Pharmaceutical Sciences. 2019;14(6):621-30.
- Holm P, Scanlon K, Dietel M. Reversion of multidrug resistance in the P-glycoprotein-positive human pancreatic cell line (EPP85-181RDB) by introduction of a hammerhead ribozyme. Br J Cancer. 1994;70(2):239-43.
- Borska S, Sopel M, Chmielewska M, Zabel M, Dziegiel P. Quercetin as a Potential Modulator of P-Glycoprotein Expression and Function in Cells of Human Pancreatic Carcinoma Line Resistant to Daunorubicin. Molecules. 2010;15(2):857-70.
- Wang SY, Duan KM, Li Y, Mei Y, Sheng H, Liu H, et al. Effect of quercetin on P-glycoprotein transport ability in Chinese healthy subjects. Eur J Clin Nutr. 2013;67(4):390-4.
- Ravikumar Reddy D, Khurana A, Bale S, Ravirala R, Samba Siva Reddy V, Mohankumar M, et al. Natural flavonoids silymarin and quercetin improve the brain distribution of co-administered P-gp substrate drugs. SpringerPlus. 2016;5(1):1618.
- Wang Y-H, Chao P-DL, Hsiu S-L, Wen K-C, Hou Y-C. Lethal quercetin-digoxin interaction in pigs. Life Sciences. 2004;74(10):1191-7.
- Dupuy J, Lespine A, Sutra JF, Alvinerie M. Fumagillin, a new P-glycoprotein-interfering agent able to modulate moxidectin efflux in rat hepatocytes. J Vet Pharmacol Ther. 2006;29(6):489-94.
- Singh P, Singh D, Goel RK. Protective effect on phenytoin-induced cognition deficit in pentylenetetrazol kindled mice: A repertoire of <i>Glycyrrhiza glabra</i> flavonoid antioxidants. Pharmaceutical Biology. 2015:1-10.
- Zhang C, Fan Q, Chen S-L, Ma H. Reversal of P-glycoprotein overexpression by Ginkgo biloba extract in the brains of pentylenetetrazole-kindled and phenytoin-treated mice. The Kaohsiung Journal of Medical Sciences. 2015;31(8):398-404.
- Yousfan A, Rubio N, Natouf AH, Daher A, Al-Kafry N, Venner K, et al. Preparation and characterisation of PHT-loaded chitosan lecithin nanoparticles for intranasal drug delivery to the brain. RSC Advances. 2020;10(48):28992-9009.
- Pippenger CE, Scott JE, Gillen HW. Thin-Layer Chromatography of Anticonvulsant Drugs. Clinical Chemistry. 1969;15(3):255-60.
- Ningrum VDA, Wibowo A, Aninditya A, Karunia BC, editors. Validation of HPLC-UV method for the phenytoin determination in spiked-saliva for TDM application. 2ND INTERNATIONAL CONFERENCE ON CHEMISTRY, CHEMICAL PROCESS AND ENGINEERING (IC3PE); 2018 2018. Yogyakarta, Indonesia.
- Kafa H, Wang JT-W, Rubio N, Venner K, Anderson G, Pach E, et al. The interaction of carbon nanotubes with an in vitro blood-brain barrier model and mouse brain in vivo. Biomaterials. 2015;53:437-52.
- Schmidt D, Beyenburg S. Antiepileptic drugs. Side Effects of Drugs Annual. 31: Elsevier; 2009. p. 105-48.
- Patsalos PN, Spencer EP, Berry DJ. Therapeutic Drug Monitoring of Antiepileptic Drugs in Epilepsy: A 2018 Update. Therapeutic Drug Monitoring. 2018;40(5):526-48.
- Hafner A, Lovrić J, Pepić I, Filipović-Grčić J. Lecithin/chitosan nanoparticles for transdermal delivery of melatonin. Journal of Microencapsulation. 2011;28(8):807-15.
- Gerelli Y, Barbieri S, Di Bari MT, Deriu A, Cantù L, Brocca P, et al. Structure of Self-Organized Multilayer Nanoparticles for Drug Delivery. Langmuir. 2008;24(20):11378-84.
- Huang M, Khor E, Lim L-Y. Uptake and Cytotoxicity of Chitosan Molecules and Nanoparticles: Effects of Molecular Weight and Degree of Deacetylation. Pharmaceutical Research. 2004;21(2):344-53.
- Song X, Chen Y, Zhao G, Sun H, Che H, Leng X. Effect of Molecular Weight of Chitosan and its oligosaccharides on Antitumor Activities of Chitosan-Selenium Nanoparticles. Carbohydrate Polymers. 2019:115689.
- Barbieri S, Sonvico F, Como C, Colombo G, Zani F, Buttini F, et al. Lecithin/chitosan controlled release nanopreparations of tamoxifen citrate: Loading, enzyme-trigger release and cell uptake. Journal of Controlled Release. 2013;167(3):276-83.
- Clementino A, Batger M, Garrastazu G, Pozzoli M, Del Favero E, Rondelli V, et al. The nasal delivery of nanoencapsulated statins – an approach for brain delivery. International Journal of Nanomedicine. 2016;Volume 11:6575-90.
- Mohammed M, Syeda J, Wasan K, Wasan E. An Overview of Chitosan Nanoparticles and Its Application in Non-Parenteral Drug Delivery. Pharmaceutics. 2017;9(4):53.
- Dammak I, José do Amaral Sobral P. Formulation optimization of lecithin-enhanced pickering emulsions stabilized by chitosan nanoparticles for hesperidin encapsulation. Journal of Food Engineering. 2018;229:2-11.
- Riley CM. The effect of triacetin on solubility of diazepam and phenytoin. The University of Arizona. 1990:72.
- Zambito Y, Pedreschi E, Di Colo G. Is dialysis a reliable method for studying drug release from nanoparticulate systems?—A case study. International Journal of Pharmaceutics. 2012;434(1-2):28-34.
- England RJA, Homer JJ, Knight LC, Ell SR. Nasal pH measurement: a reliable and repeatable parameter. Clin Otolaryngol. 1999;24(1):67-8.
- Barbieri S, Buttini F, Rossi A, Bettini R, Colombo P, Ponchel G, et al. Ex vivo permeation of tamoxifen and its 4-OH metabolite through rat intestine from lecithin/chitosan nanoparticles. International Journal of Pharmaceutics. 2015;491(1-2):99-104.
- Djupesland PG, Messina JC, Mahmoud RA. The nasal approach to delivering treatment for brain diseases: an anatomic, physiologic, and delivery technology overview. Therapeutic Delivery. 2014;5(6):709-33.
- Dhuria SV, Hanson LR, Frey WH. Intranasal delivery to the central nervous system: Mechanisms and experimental considerations. Journal of Pharmaceutical Sciences. 2010;99(4):1654-73.
- Serralheiro A, Alves G, Fortuna A, Falcão A. Intranasal administration of carbamazepine to mice: A direct delivery pathway for brain targeting. European Journal of Pharmaceutical Sciences. 2014;60:32-9.
- Illum L. Transport of drugs from the nasal cavity to the central nervous system. European Journal of Pharmaceutical Sciences. 2000;11(1):1-18.
- Alam T, Pandit J, Vohora D, Aqil M, Ali A, Sultana Y. Optimization of nanostructured lipid carriers of lamotrigine for brain delivery: <i>in vitro</i> characterization and <i>in vivo</i> efficacy in epilepsy. Expert Opinion on Drug Delivery. 2015;12(2):181-94.
- Graff CL, Pollack GM. P-Glycoprotein attenuates brain uptake of substrates after nasal instillation. Pharmaceutical Research. 2003;20(8):1225-30.
- Amin ML. P-glycoprotein Inhibition for Optimal Drug Delivery. Drug Target�Insights. 2013;7:DTI.S12519.
- Bourganis V, Kammona O, Alexopoulos A, Kiparissides C. Recent advances in carrier mediated nose-to-brain delivery of pharmaceutics. European Journal of Pharmaceutics and Biopharmaceutics. 2018;128:337-62.
- Erdő F, Bors LA, Farkas D, Bajza Á, Gizurarson S. Evaluation of intranasal delivery route of drug administration for brain targeting. Brain Research Bulletin. 2018;143:155-70.
- Löscher W, Potschka H. Blood-brain barrier active efflux transporters: ATP-binding cassette gene family. NeuroRX. 2005;2(1):86-98.