تحديد المُحتوى الكُلّي من الفينولات والفلافونوئيدات في الرؤوس الزهريّة لنبات Echinops polyceras Boiss المُنتشر في سورية، وتحرّي الفعالية الكاسحة للجذور الحُرّة
2022-01-01 | المجلد السادس العدد التاسع - المجلد السادس | مقالات بحثيةعيسى العسَّاف | ميس خازم
الملخص
تؤدي الجذور الحُرّة دوراً أساسياًّ في إحداث العديد من الأمراض مثل السرطان والتصلُّب العصيدي. وتعدُّ المُركبات المُضادة للأكسدة من نمط كاسحات الجذور الحُرّة من أهم العوامل التي تُساعد في حماية الجسم من التأثيرات الضارة التي تنتج عن هذه الجذور. تتميّز المُركبات الفينوليّة عموماً والفلافونوئيدات خصوصاً بفعاليّة جيدة في كسح الجذور الحُرّة، ولذلك دُرس في هذا البحث الرؤوس الزهرية لنوع Echinops polyceras Boiss. المُنتشر في سورية واستخلاص المُركبات الفعّالة باستخدام مُحلات مُتدرجة القطبيّة ومُعايرة كلٍّ من الفينولات الكلُيّة مع كاشف فولين سيكالتو والفلافونوئيدات مع كاشف كلوريد الألمنيوم ومن ثمّ تحرّي الفعالية الكاسحة للجذور الحُرّة RSA باستخدام DPPH• وذلك ضمن طبق 96 بئر، كما تمّ نفي وجود كلٍّ من حمض الأسكوربيك والسكاكر المُرجعة -التي يُمكن أن تتداخل مع نتائج مُعايرة الفينولات الكُليّة والفعالية الكاسحة للجذور الحُرّة- من خلال دراسة الانتقائيّة. وقد بلغ أعلى مُحتوى للفينولات الكُلية 619.5 mg GAE/g DE والفلافونوئيدات 156 mg QE/g DE في الخلاصة الميثانوليّة والتي أظهرت أعلى فعاليّة كاسحة للجذور الحُرة حيث بلغت RSA=86.75% بعد 30 دقيقة. يُمكن أن نُلخّص ما سبق بأن الفعالية الكاسحة للجذور الحُرّة التي تتمتع بها الرؤوس الزهريّة للنوع النباتي المدروس ناتجة عن المُركبات الفينولية والفلافونوئيدات الموجودة فيها، ويُمكن الاستفادة منها في الوقاية من الأمراض التي تنتج عن الشدّة التأكسديّة.
كلمات مفتاحية : Echinops polyceras، الفينولات، الفلافونوئيدات، كسح الجذور الحُرّة.
المقدمة Introduction:
الجذور الحُرّة هي ذرّات أو جزيئات تمتلك الكترونات غير مرتبطة [1]، وتكون غير مُستقرّة unstable ومُتفاعلة بشدّة highly reactive حيث تسعى لالتقاط الكتروناتٍ من الجزيئات الحيويّة في الجسم من أجل أن تعود إلى حالة الاستقرار والثبات، ومن ثمّ فهي تتسبّب في العديد من الأمراض مثل السرطان cancer والتصلُّب العصيدي atherosclerosis والقرحة المعديّة gastric ulcer [2]. تُعرّف مضادات الأكسدة antioxidants أنها جزيئاتٌ قادرة بتراكيز قليلة على منع أو تأخير عملية أكسدة الركازة القابلة للتأكسد oxidizable substrate [3]، ويُمكن أن تنتج في الجسم مثل أنزيمات الكاتالاز والغلوتاتيون بيروكسيداز أو يتمّ الحصول عليها من الأغذية مثل فيتامين C والكاروتينوئيدات وعديدات الفينول [1]. وتُعدّ كاسحات الجذور الحُرّة free-radical scavengers من أهم المركبات المُضادة للأكسدة حيث تتميّز بقدرتها على تقديم الكتروناتٍ للجذور الحُرّة من أجل إنقاص قدرتها التفاعُليّة وإعادة حالة التوازن إلى الخلية [4]. يضمّ جنسEchinops L. (من الفصيلة النجميّة Asteraceae) ما يقارب 120 نوعاً نباتياًّ، تنتشر في مناطق إفريقيا وحوض المتوسط [5]. يوجد هذا الجنس في سورية ضمن 3 أنواع هي: E. polyceras Boiss. و E. viscosus DC و E. descendent Hand.، وتختلف هذه الأنواع بعضها عن بعض بحجم الرؤويس الزهري وحجم القنابات ودرجة تفصُص الأوراق ووجود الأوبار الغدّيّة على الساق. يوجد نوع Echinops polyceras Boiss. والمُسمّى محليّاً شوك الجمل في دمشق وريفها وتدمر وصلنفة ورأس العين، وهو نبات شوكيّ مُعمّر بارتفاع 50 سم تقريباً، ساقه رفيعة ذات مقطع دائري وتحمل في جزئها السفلي أوبار غدية. الأوراق القاعدية رُمحية الشكل مُفصصة إلى عدة فصوص وتنتهي بأشواك، أمّا الأوراق العلوية فتكون لاطئة وأيضاً تنتهي بأشواك، فيما يتعلّق بالرأس الزهري فهو كرويّ الشكل ذو نصف قطر 4.5 – 5 سم وتكون فيه القنابات بلون أخضر والأزهار ذات تويج بنفسجيّ اللون. يُزهر هذا النوع بين شهريّ حزيران وتموز [6]. وقد أُشير في أحد التقارير إلى أن هذا النوع يُستعمل شعبياً في معالجة الجروح والثآليل [7]، كما ذُكر في أحد الدراسات التأثير الفعّال للخلاصة المائية للرؤوس الزهريّة على طفيلي الملاريا، وكذلك فقد أظهرت الخلاصة الميثانوليّة دوراً مُعززاً لتأثير التتراسيكلين tetracycline على السلاسل المقاومة للزائفة الزنجارية Pseudomonas aeruginosa [8]. ومن خلال قراءة الأدبيّات لم نجد أية دراسة حول محتواه من المُركبات الفينوليّة والفلافونوئيدات وكذلك حول فعاليته الكاسحة للجذور الحُرّة.
هدف الدراسة Aim of the study:
إجراء دراسة كيميائية للرؤوس الزهريّة لنوع Echinops polyceras Boiss.، واستخلاص المُركبات الفعّالة باستخدام مُحلّات مُتدرّجة القطبيّة، كذلك إجراء مُعايرة للمُركبات الفينوليّة عموماً والفلافونوئيدات خصوصاً باستخدام أطباق ميكرويّة microplate (أطباق ذات 96 بئر)، بالإضافة إلى تحرّي الفعاليّة الكاسحة للجذور الحُرّة للخلاصات المدروسة.
المواد والطرائق Materials and Methods:
المواد المستخدمة Materials:
ماء مُقطّر، إيثانول مُطلق (شركة Merck)، ميثانول مُطلق (شركة Sigma-Aldrich)، خلات الإيثيل (شركة SHAM LAB)، كلوروفورم (شركة Merck)، حمض كلور الماء (شركة Sigma-Aldrich)، عياري حمض الغاليك (شركة AVONCHEM)، عياري الكيرستين (شركة Sigma-Aldrich)، حمض الأسكوربيك (شركة Panreac Quimica SLU)، كاشف فولين سيكالتو (شركة Sigma-Aldrich)، كربونات الصوديوم (شركة Scharlau)، كلوريد الألمنيوم (شركة Scharlau)، خلات البوتاسيوم (شركة Merck)، DPPH• (شركة TCI).
تحضير الكواشف والمحاليل Reagents and Solutions:
- كاشف فولين سيكالتو بتركيز 10% (ح/ح): تمّ تمديد 1 مل من كاشف فولين سيكالتو إلى حجم 10 مل باستخدام الماء المُقطّر ضمن دورق مُعاير.
- كربونات الصوديوم بتركيز700 ميلي مول/ل (74.2 غ/ل): تمّ حل 7.42 غ من كربونات الصوديوم في 100 مل ماء مُقطّر ضمن دورق مُعاير.
- كلوريد الألمنيوم 10%: تمّ حل 1 غ من كلوريد الألمنيوم في 10 مل إيثانول 95% ضمن دورق مُعاير.
- خلات البوتاسيوم بتركيز 1 مول/ل (98.15 غ/ل): تمّ حل 9.815 غ من خلات البوتاسيوم في 100 مل ماء مُقطّر ضمن دورق مُعاير.
- محلول DPPH في الميثانول المُطلق بتركيز 0.2 ميلي مول/ل (78.9 ملغ/ل): تمّ حل 7.89 ملغ في 100 مل ميثانول مُطلق ضمن دورق مُعاير.
- حمض كلور الماء بتركيز 0.1 ن: تمّ تمديد حجم 0.83 مل من حمض كلور الماء 37% باستخدام الماء المُقطّر إلى حجم 100 مل ضمن دورق مُعاير.
الأجهزة المستخدمة Apparatuses:
المُبخّر الدوّار rotary evaporator والميزان المخبريّ الحساس high-precision laboratory scale وقارئ الأطباق الميكرويّة microplate reader (شركة BioTek) الموجودات في مركز الدراسات الوبائية والبيولوجية لطفيليات الليشمانية.
طرائق العمل Methods:
- النبات Plant material:
جُمعت االرؤوس الزهرية لنوع Echinops polyceras Boiss. من بلدة معرّة صيدنايا في ريف دمشق في شهر تموز عام 2019 م، بعد تصنيفها من قبل د. عماد القاضي “رحمه الله” ومن ثمّ تجفيفها في الظل وبدرجة حرارة الغرفة ومن ثمّ طحنها.
- الاستخلاص Extraction:
استُخلصت المُكوّنات الفعالة من مطحون العقار (20 غ) بطريقة التعطين maceration بدرجة حرارة الغرفة مُدّة 7 أيّام مع التحريك وبنسبة (1:10)، وباستخدام مُحلّات مُتدرّجة القطبية هي: الماء المُقطر DH2O وإيثانول EtOH 50% وميثانول MeOH وميثانول مع خلات الإيثيل MeOH+EtOAc (1:1) وكلوروفورم CHCl3. جُففت بعد ذلك الخُلاصات الناتجة باستخدام المُبخّر الدوّار تحت ضغط منخفض.
- حساب مردود الاستخلاص Extraction yield:
تمّ حساب مرود الاستخلاص لكل خلاصة بتطبيق العلاقة التالية:
مردود الاستخلاص% = (وزن الخلاصة الجافة / وزن مطحون العقار) × 100
- مُعايرة الفينولات الكُليّة Determination of total phenols:
تمّت مُعايرة الفينولات الكُلّيّة بحسب بروتوكول Ainsworth & Gillespie [9]، كما يلي:
حُلّ 200 ملغ من كلّ خلاصةٍ في 2 مل من الميثانول 95%، وأُخذ حجم 100 مكل من التمديد السابق وأُضيف له 200 مكل من كاشف فولين سيكالتو 10% مع المزج جيداً، ثم أُضيف 800 مكل من كربونات الصوديوم، وتم حفظ أنبوب التفاعل في درجة حرارة الغرفة بعيداً عن الضوء مُدة ساعتين. أُخذ من كل أنبوب حجم 200 مكل ووضعت في آبار الطبق المكرويّ microplate، وتمّ قياس الامتصاص عند طول موجة الامتصاص الأعظميّ 765 نم. تمّ قياس الامتصاص 3 مرات لكلّ عينة وحساب وسطي القراءات الناتجة.
1.4. تحضير سلسلة عياريّة من حمض الغاليك Gallic acid
حُضّرت سلسلة عياريّة من حمض الغاليك بالتراكيز التالية: (0، 12، 24، 36، 48، 60، 84، 96، 108، 120 ملغ/ل) وتطبيق خطوات البروتوكول السابق، وتمّ قراءة الامتصاص عند طول موجة الامتصاص الأعظميّ 765 نم.
2.4. تحديد محتوى الفينولات في الخلاصات المدروسة
طُبّقت خطوات البروتوكول السابق ومن ثمّ التعويض في مُعادلة الخط البيانيّ المُمثلة لخطيّة حمض الغاليك، وقد تمّ التعبير عن محتوى الفينولات في العينات بواحدة: ملغ مُكافئ لحمض الغاليك في 1 غ من الخلاصة الجافّة (mg GAE/g DE) ± الانحراف المعياريّ للمُكررات الثلاثة.
3.4. دراسة الانتقائيّة Selectivity:
1.3.4. تحرّي وجود حمض الأسكوربيك [10]:
اعتُمدت طريقة طيفيّة حيث حُدّد طول موجة الامتصاص الأعظميّ لحمض الأسكوربيك، ومن ثمّ إجراء مسح طيفيّ لمحلول العينة النباتيّة وتحرّي وجود امتصاص عند طول موجة الامتصاص الأعظميّ الخاصة بحمض الأسكوربيك.
1.1.3.4. المسح الطيفي لمحلول حمض الأسكوربيك:
تمّ حل 0.1 غ من حمض الأسكوربيك بالماء المُقطّر، وإكمال الحجم بالماء المُقطّر حتى خط العيار في الدورق المُعاير سعة 100 مل، ثمّ أُخِذ 1 مل من التمديد السابق وأُضيف له 10 مل من حمض كلور الماء 0.1 ن، وأُكمِل الحجم بالماء المُقطّر حتى خط العيار في الدورق المعاير سعة 100 مل. تمّ بعد ذلك إجراء مسح طيفيّ لهذا المحلول ضمن المجال 200-300 نم.
2.1.3.4. المسح الطيفي لمحلول العينة النباتيّة:
أُخِذ 1 مل من الخلاصة المائيّة للرؤوس الزهريّة، وأُضيف لها 10 مل من محلول حمض كلور الماء 0.1 ن، ومن ثمّ أُكمِل الحجم بالماء المُقطّر حتى خط العيار في الدورق المُعاير سعة 100 مل. أُجري مسح طيفيّ للعيّنة لتحرّي وجود امتصاص طيفيّ عند طول موجة الامتصاص الأعظمي الخاصّة بحمض الأسكوربيك.
2.3.4. تحرّي وجود السكاكر المُرجعة [11]:
كُشف عن السكاكر المُرجعة باستخدام كاشف فهلنغ، حيث يُضاف 1 مل من مزيج (فهلنغ A وفهلنغ B) إلى 1 مل من الخلاصة الإيثانوليّة ويُسخن أنبوب التفاعل.
- مُعايرة الفلافونوئيدات Determination of flavonoids:
تمّت مُعايرة الفلافونوئيدات بحسب طريقة Chang وزملائه المُعدّلة [12]، كما يلي:
حُلّ 200 ملغ من كلّ خلاصةٍ في 1.5 مل من الإيثانول 95%، وأُضيف لها 100 مكل من محلول كلوريد الألمنيوم و100 مكل من محلول خلات البوتاسيوم.
حُفظ أنبوب التفاعل في درجة حرارة الغرفة بعيداً عن الضوء مُدة 30 دقيقة.
أُخذ من كل أنبوب حجم 200 مكل ووضعت في آبار الطبق المكرويّ microplate، وقيس الامتصاص عند طول موجة الامتصاص الأعظميّ 420 نم باستخدام قارئ الأطباق الميكرويّة.
تمّ قياس الامتصاص 3 مرات لكلّ عينة وحساب وسطي القراءات الناتجة.
1.5. تحضير سلسلة عياريّة من الكيرستين Quercetin
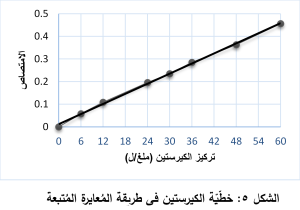
حُضّرت سلسلة عياريّة من حمض الغاليك (0، 6، 12، 24، 30، 36، 48، 60 ملغ/ل) وتطبيق خطوات البروتوكول السابق، وقرئ الامتصاص عند طول موجة الامتصاص الأعظميّ.
2.5. تحديد محتوى الفلافونوئيدات في الخلاصات المدروسة
طُبّقت خطوات البروتوكول السابق، وعُبّر عن محتوى الفلافونوئيدات في العينات بواحدة: ملغ مُكافئ للكيرستين في 1 غ من الخلاصة الجافّة (mg QE/g DE) ± الانحراف المعياريّ للمُكررات الثلاثة.
- تحرّي الفعالية الكاسحة للجذور الحُرّة Evaluation of free radicals scavenging activity:
تمّ تحرّي الفعالية الكاسحة للجذور الحُرّة بحسب الطريقة التالية [13]:
- حُضّر تركيز 1 ميلي مول/ل من كلٍّ من المواد المعياريّة التالية: حمض الأسكوربيك (12 g/mol) وحمض الغاليك (170.12 g/mol) والكيرستين (302.24 g/mol) في الميثانول 95%.
- حُضّر الخُلاصات النباتية المدروسة بتركيز 100 ملغ/مل باستخدام الميثانول 95%.
- وُضِع حجم 160 مكل من محلول DPPH في كلّ واحدٍ من آبار الطبق المكرويّ.
- أُضيف حجم 40 مكل من كلِّ خلاصةٍ وكلِّ مادة معياريّة إلى الآبار الحاوية على محلول DPPH.
- حُضِّرت ثلاث مُكرراتٍ لكلِّ بئرٍ.
تمّت قراءة الامتصاص عند طول موجة 520، وحساب القدرة الكاسحة للجذور الحرة RSA بناءً على تناقص الامتصاص وذلك بعد 10 و30 دقيقة.
النتائج Results:
- نتائج مردود الاستخلاص:
عُرضت قيم مردود استخلاص الرؤوس الزهرية لنوع E. polyceras Boiss. في (الجدول 3)، حيث كانت أعلى قيمة للخلاصة المائية 16% وأقلّها للخلاصة الكلوروفورمية 3.5 %.
- نتائج مُعايرة الفينولات الكُليّة:
1.2. خطّيّة حمض الغاليك Gallic acid linearity
يُبيّن (الجدول 1) متوسط المُكررات الثلاثة لقيم الامتصاص الموافق لكلّ تركيز مع تراكيز السلسلة العياريّة المُحضّرة من حمض الغاليك. وقد مُثّل ذلك بيانيّاً في (الشكل 1)، حيث نلاحظ أنّ الطريقة المُتبعة تتمتّع بخطّيّة ممتازة وبقيمة مُعامل ارتباط R2=0.9981.
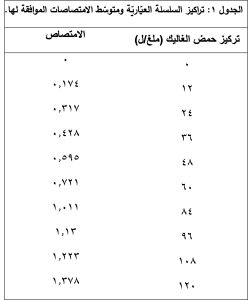

2.2. تحديد محتوى الفينولات في الخلاصات المدروسة
يُبيّن المُخطط البياني التالي (الشكل 2) محتوى العينات المدروسة من الفينولات الكُلّيّة المُكافئة لحمض الغاليك في 1 غ من الخلاصة الجافّة، حيث عُوّض متوسط المُكررات الثلاثة للامتصاص في معادلة الخط البياني الناتج عن خطية حمض الغاليك: y = 0.0113x + 0.0321.
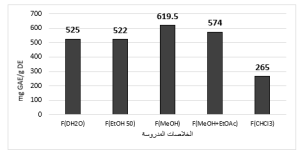
وقد احتوت الخلاصة الميثانولية على أعلى محتوى من الفينولات الكُلّيّة، والذي بلغ 619.5 mg GAE/g DE.
3.2. نتائج الانتقائيّة:
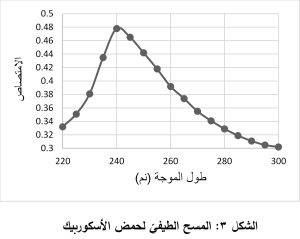
1.3.2. تحديد طول موجة الامتصاص الأعظميّ الخاصة بحمض الأسكوربيك:
أبدى محلول حمض الأسكوربيك في الماء المُقطّر امتصاصاً أعظميّاً عند طول الموجة 240 نم، والمُخطط البيانيّ (الشكل 3) التالي يوضح ذلك:
2.3.2. المسح الطيفيّ لخلاصة الرؤوس الزهريّة:
يُبيّن الخط البيانيّ التالي (الشكل 4) المسح الطيفي للعيّنة المائية للرؤوس الزهريّة لنوع E. polyceras Boiss في المجال 200 – 300 نم، حيث يظهر خُلوّها من حمض الأسكوربيك، لأنه لم تظهر أيّة قمّة عند طول موجة الامتصاص الأعظمي 240 نم.
3.3.2. الكشف عن وجود السكاكر المُرجعة:
لم يتشكّل أيّ راسب بلون أحمر آجرّي في كاشف فهلنغ، مما يدلّ على خلوّ الرؤوس الزهريّة من السكاكر المُرجعة.

- نتائج مُعايرة الفلافونوئيدات:
1.3. خطّيّة الكيرستين Quercetin linearity
يُبيّن الجدول التالي (الجدول 2) متوسط المُكررات الثلاثة لقيم الامتصاص الموافق لكلّ تركيز مع تراكيز السلسلة العياريّة المُحضّرة من حمض الكيرستين. وقد مُثّل ذلك بيانيّاً في (الشكل 5)، حيث نلاحظ أنّ الطريقة المُتبعة تتمتّع بخطّيّة ممتازة وبقيمة مُعامل ارتباط R2=0.9982.

2.3. تحديد محتوى الفلافونوئيدات في الخلاصات المدروسة
يُبيّن المُخطط البياني التالي (الشكل 6) محتوى الفلافونوئيدات في العينات المدروسة، حيث تمّ تعويض متوسط المُكررات الثلاثة للامتصاص في معادلة الخط البياني الناتج عن خطية الكيرستين:
y = 0.0074x + 0.0119. وقد احتوت الخلاصة الميثانولية على أعلى محتوى من الفلافونوئيدات، حيث بلغ تركيز الفلافونوئيدات في 1غ من الخلاصة الجافّة 156 mg GAE/g DE.

- نتائج تحرّي الفعاليّة الكاسحة للجذور الحُرّة:
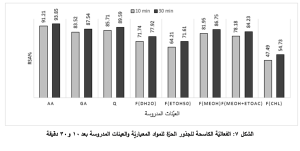
يُبيّن الجدول التالي (الجدول 3) قيم الفعاليّة الكاسحة للجذور الحرّة Radical scavenging activity (RSA) بالنسبة للمواد المعياريّة التالية: حمض الأسكوربيك AA وحمض الغاليك GA والكيرستين Q وأيضاً بالنسبة للعيّنات المدروسة، وذلك بعد 10 و30 دقيقة. وقد كانت الخلاصة الميثانوليّة الأكثر فعاليّة بين الخلاصات المدروسة حيث بلغت قيمة RSA بعد 10 دقائق %81.95 وبعد 30 دقيقة %86.75 وقد تمّ تمثيل ذلك بيانيّاً (الشكل 7).
الدراسة الإحصائية Statistical analysis
عولجت النتائج وفق اختبار Two-way ANOVA باستخدام برنامج Microsoft excel 2019، لتقييم علاقة الارتباط بين مُحتوى الخلاصات المدروسة من الفينولات الكُلّيّة والفلافونوئيدات والقدرة الكاسحة للجذور الحُرّة بعد 30 دقيقة. وقد أظهرت نتيجة الدراسة أن ثمة ارتباطاً ذا دلالة إحصائية؛ أي أنّ الفعالية الكاسحة للجذور الحُرّة تتأثر بالمحتوى الفينوليّ والفلافونوئيديّ (p < 0.05).
كما تمّ حساب نسبة الارتباط Correlation بين كلٍ من:
– التأثير الكاسح للجذور الحُرّة ومُحتوى الخلاصات من المُركبات الفينوليّة، حيث بلغت 97%.
– التأثير الكاسح للجذور الحُرّة ومُحتوى الخلاصات من المُركبات الفلافونوئيديّة، حيث بلغت 94%.
– المُحتوى الفينوليّ والمُحتوى الفلانوئيديّ، حيث بلغت 97.5%.
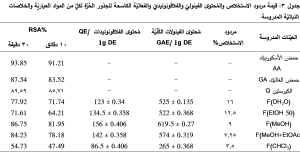
المُناقشة والاستنتاجات Discussion and Conclusions:
أظهرت الخلاصات الخمسة للرؤوس الزهرية لنوع Echinops polyceras Boiss. تدرّجاً في مردود الاستخلاص مع تدرُّج قطبية المُحلات المُستخدمة (H2O>EtOH 50%> MeOH 100% > MeOH+ EtOAc > CHCl3)، حيث تؤدي المُحلات الدور الرئيسيّ في تحديد نوعيّة المُركبات الفعّالة المُستخلصة، ونستنتج من ذلك أنّ المركبات التي تمّ استخلاصها في هذه الدراسة ذات صفات قطبيّة أو أنها توجد بشكلها الغليكوزيدي أكثر من الشكل الحُر. كذلك أظهرت هذه الخلاصات فعاليّة واضحة في كسح الجذور الحُرّة ويمكن أن يُعزى ذلك إلى احتوائها على تراكيز جيدة من المُركبات الفينوليّة عموماً والفلافونوئيدات خصوصاً، وهذه المُركبات تتميز بفعاليتها المضادة للأكسدة والكاسحة للجذور الحُرّة، وقد كانت الخلاصة الميثانوليّة الأكثر فعاليّة بسبب مُحتواها الأعلى من المُركبات الفينوليّة والفلافونوئيدات، حيث بلغت قيمة RSA للخلاصة الميثانوليّة بعد 30 دقيقة 87% مقارنةً مع حمض الأسكوربيك 94%، وبالمقابل فقد أظهرت الخلاصة الكلوروفورمية الفعاليّة الأضعف بين الخلاصات المدروسة (حيث تمّ كسح ما يقارب 55% من الجذر الحرّ) ويتوافق هذا مع محتواها الأقل من الفينولات والفلافونوئيدات. يُمكن أن يُعزى المُحتوى المُرتفع من كلٍّ من الفينولات والفلافونوئيدات في الخلاصة الميثانوليّة إلى انحلال المُركبات الفينوليّة بشكليها الحُر والغليكوزيدي في الميثانول، كما أنّ قطبيّة الفينولات مُتقاربة مع قطبية الميثانول. كما تُظهر العديد من الدراسات السابقة أنّ الفعاليّة المُضادة للأكسدة والكاسحة للجذور الحُرّة تكون أفضل في الخلاصات الميثانوليّة مُقارنةً بالخُلاصات المائيّة والكلوروفورميّة وخلاصات خلات الإيثيل [13]. وقد أظهرت دراسة الانتقائية خلوّ خلاصة الرؤوس الزهرية لنوع Echinops polyceras Boiss. من كلٍّ من حمض الأسكوربيك والسكاكر المُرجعة، حيث يمكن أن تتفاعل هذه المركبات مع الكاشف مسبّبةً زيادة في امتصاص العينات المدروسة ومن ثمّ زيادة في قيم الفينولات الكلّيّة أي إعطاء نتائج إيجابية كاذبة، لأن حمض الأسكوربيك والسكاكر المُرجعة يُعتبران من أكثر المركبات التي تؤثّر على مضبوطية طريقة الفولين – سيكالتو ومن ثمّ فإنّ الفعالية الكاسحة للجذور الحُرة ناتجة عن المُركبات الفينوليّة والفلافونوئيدات دون أيّ تأثيرٍ من المواد الأخرى ذات القدرة الإرجاعية والتي تمّ التحرّي عن وجودها في هذه الدراسة. أظهرت نتائج الدراسة الإحصائيّة أنّ نسبة الارتباط بين الفعاليّة ومُحتوى الخُلاصات من المُركبات الفينوليّة قد بلغت 97%، كما بلغت نسبة الارتباط بين الفعاليّة ومُحتوى الخُلاصات من المُركبات الفلافونوئيديّة 94% تقريباً، هذا يؤكِّد أنّ مُعظم الفعالية الكاسحة للجذور الحُرّة التي تمتّعت بها الخلاصات ناتجة عن المُركبات الفينوليّة عموماً والفلافونوئيدات خصوصاً، حيث بلغت نسبة الارتباط بين المُحتوى الفينوليّ والمُحتوى الفلافونوئيديّ 97.5% أي أنّ الجزء الأكبر من المُركبات الفينوليّة الموجودة في الخلاصة هي من زمرة الفلافونوئيدات. وفيما يتعلّق بالخلاصة المائية التي يُمكن أن يُستفاد منها في الطبّ الشعبيّ، فنلاحظ احتواءها على محتوى جيّد من المُركبات الفينوليّة عموماً والفلافونوئيدات خصوصاً بالإضافة إلى أنّ فعاليتها الكاسحة للجذور الحُرّة قد بلغت تقريباً 78% بعد 30 دقيقة، مما يجعل منها مصدراً جيّداً لمُضادات الأكسدة التي تتمتّع بفعاليّة جيّدة في حماية الجسم من التأثيرات الضارة التي تُسببها الجذور الحُرة. نستنتج مما سبق أنّ الرؤوس الزهرية لنبات Echinops polyceras Boiss. تحتوي مُضادات أكسدة وكاسحات جذور حرّة فعّالة من نمط الفينولات عموماً والفلافونوئيدات خصوصاً، ويُمكن استخدامها بعد دراسة التأثيرات السُميّة وتحديد الجرعة الأمثل منها. وقد تمتّعت طرائق المُعايرات المُتبعة باستخدام الطبق الميكرويّ بالسهولة وإمكانية إجراء المُعايرة لعدّة عينات مع إجراء عدّة مُكررات باستخدام ذات الطبق وبنفس الوقت، كما أنّ الكميّات الميكرويّة المُستخدمة في هذه الطرائق تُمكّن من توفير المُحلات والكواشف المُستخدمة.
المراجع :- Ramos‐Tovar E, Muriel P.Free radicals, antioxidants, nuclear factor‐E2‐related factor‐2 and liver damage, Journal of Applied Toxicology, 40, 151-168, 2020.
- Shon MY, Kim TH, Sung NJ.Antioxidants and free radical scavenging activity of Phellinus baumii (Phellinus of Hymenochaetaceae) extracts, Food chemistry, 82, 593-597, 2003. Granato D, Shahidi F, Wrolstad R, Kilmartin P, Melton LD, Hidalgo FJ, Miyashita K, van
- Camp J, Alasalvar C, Ismail AB, Elmore S. Antioxidant activity, total phenolics and flavonoids contents: Should we ban in vitro screening methods, Food Chemistry, 264, 471-475, 2018.
- Carocho M, Morales P, Ferreira IC. Antioxidants: Reviewing the chemistry, food applications, legislation and role as preservatives, Trends in Food Science & Technology, 71,107-120, 2018.
- Bouzabata A, Mahomoodally F, Tuberoso C. Ethnopharmacognosy of Echinops spinosus L. in North Africa: a mini review, Journal of Complementary Medicine Research, 8, 40-52, 2018.
- Mouterde P. Nouvelle flore du Liban et de la Syrie : tome 3. Texte : quatrieme livraison. Beyrouth, Dar El-Machreq SARL, 436 – 439, 1983.
- Darwish RM, Aburjai TA. Effect of ethnomedicinal plants used in folklore medicine in Jordan as antibiotic resistant inhibitors on Escherichia coli, BMC complementary and alternative medicine, 10, 1-8, 2010.
- Bitew H, Hymete A. The genus Echinops: Phytochemistry and biological activities: A review. Frontiers in Pharmacology,10, 2019.
- Ainsworth EA, Gillespie KM. Estimation of total phenolic content and other oxidation substrates in plant tissues using Folin–Ciocalteu reagent, Nature protocols, 4, 875-877, 2007.
- Davy MN, Favell D, Inze D, Vanmontagu M. Plant L-A scorbic acid: chemistry, function, metabolism, bioavailability and effect of processing, J Sci Food Agric, 80, 825-860, 2000.
- Zohra SF, Meriem B, Samira S, Muneer MA. Phytochemical screening and identification of some compounds from mallow, J Nat Prod Plant Resour, 2, 512-516, 2012.
- Mammen D, Daniel M. A critical evaluation on the reliability of two aluminum chloride chelation methods for quantification of flavonoids, Food chemistry, 135, 1365-1368, 2012.
- Choi Y, Jeong HS, Lee J. Antioxidant activity of methanolic extracts from some grains consumed in Korea, Food chemistry,103, 130-138, 2007.