مقارنة المحتوى الفينولي والفلافونوئيدي لخلاصات مختلفة محضرة من بذور الكتان Linum usitatissimum
2021-10-01 | المجلد السادس العدد الثامن - المجلد السادس | مقالات بحثيةرغد جندلي | محمد عصام حسن آغا
الملخص
تم تحضير خلاصات لعينات من بذور الكتان Linum usitatissimum باستخدام الطرق التالية: استخلاص مع التحريك المستمر بالايثانول %80، استخلاص بمزيج من خلات الايثيل ودي ايثيل ايثر (1:1) بعد الحلمهة الحامضية المباشرة، الحلمهة الحامضية لمستخلصات الايثانول %70، استخلاص بالايثانول 50% بعد الحلمهة القلوية وتمت مقارنة المحتوى الفينولي والفلافونوئيدي. حيث كان المحتوى الفينولي الأعلى للخلاصة المحضرة بالايثانول %80مع التحريك المستمر حيث بلغ المحتوى الفينولي (126.848 mg /g)، بينما كان المحتوى الفلافونوئيدي الأعلى للخلاصة المحضرة بمزيج من خلات الايثيل ودي ايثيل ايثر (1:1) بعد الحلمهة الحامضية المباشرة، حيث بلغ المحتوى الفلافونوئيدي (7.8 mg /g).
كلمات مفتاحية : مضادات أكسدة، بذور الكتان، المحتوى الفينولي، المحتوى الفلافونوئيدي.
المقدمة Introduction
تلعب الفينولات دوراً مهماً في النباتات لحمايتها من الأكسدة الضوئية ومقاومة الأمراض. وتمتلك المركبات الفينولية بشكل عام حلقة عطرية تحمل واحداً أو أكثر من جذور الهيدروكسيل ويمكن العثور عليها إما بشكل حر أو مرتبط، وهي لا توجد بالتساوي في أنسجة أو خلايا النباتات، ويمكن أن ترتبط بمكونات الجدار الخلوي مثل الكربوهيدرات والبروتينات(8). يوجد أكثر من 8000 مركبا فينوليا معروفاً، هذه المركبات الفينولية تتواجد ببنى كيميائية متنوعة ومختلفة. بشكل عام، يمكن تقسيم الفينولات النباتية على أساس تركيبها الكيميائي إلى: الفينولات البسيطة simple phenols، الأحماض الفينولية phenolic acids، الكومارينات coumarins، الايزوكومارين isocoumarins، والنافثوكينونات naphthoquinones، الزانثونات xanthones، الأنثراكينونات anthraquinones، والفلافونوئيدات flavonoids، التانينات tannins والليغنانات lignins. وتعتبر الأحماض الفينولية والفلافونوئيد الأكثر شيوعاً(8). بالإضافة إلى التأثير الوقائي، تعتبر الفينولات مسؤولة عن اللون والطعم والخصائص الحسية للأطعمة ذات الأصل النباتي(8). يعد نبات الكتان (الشكل 1) من أقدم المحاصيل وأكثرها فائدة ويعود تاريخ زراعته إلى أكثر من 6000 سنة قبل الميلاد. تمتلك مركبات الكتان استخدامات متنوعة، وقد تم التوجه حالياً إلى تطوير زراعة الكتان من أجل تحسين محتواه من المواد الدسمة لتلبية المتطلبات الغذائية كمصدر بديل لزيت السمك، الغني بالمركبات التالية: eicosapentaenoic acid (EPA, C20:5) وdocosahexaenoic acid (DHA, C22:6) بذور الكتان (الشكل 2) غنية أيضا بالألياف والليغنانات القابلة للذوبان وغير القابلة للذوبان مما يجعلها مفيدة كمتمم غذائي.


قد يقلل تناول بذور الكتان في النظام الغذائي اليومي من خطر الإصابة بأمراض القلب والأوعية الدموية مثل أمراض القلب التاجية والسكتة الدماغية، كما أنّ هناك أدلّة أيضاً على أن للكتان آثاراً مضادة لبعض السرطانات مثل سرطان الثدي والبروستات والقولون(1). ويعتقد أن السبب في ذلك يعود إلى نوع المكونات الكيميائية التي تدعى بالاستروجينات النباتية ومن المكونات الرئيسية فيها هناك ليغنانات الكتان مثل Secoisolariciresinol diglycoside (SDG) حيث أشارت الأبحاث السابقة إلى أن SDG يمكن أن يمنع بشكل ما كل من سرطان الثدي، سرطان القولون وسرطان البروستات، وكما أن لهذا المركب تأثير مفيد على الأورام وتصلب الشرايين وغيرها من الأمراض(11). منذ الثمانينات من القرن الماضي تم تطوير عدة طرق لتحديد كميات الليغنان في عينات الطعام اعتماداً على أنواع الليغنان والأطعمة التي تم تحليلها، ولكن في الغالب تم الاعتماد على بذور الكتان كغذاء معياري. تعرّف الليغنانات Lignans على أنها مجموعة من ثنائيات فينيل بروبان phenylpropa-noid dimers، حيث ترتبط وحدات phenylpropane بواسطة الكربون عبر سلاسل البروبيل الجانبية(6). ويتم تصنيف الليغنانات في ثماني مجموعات فرعية بالاعتماد على الطريقة التي يتم بها ارتباط الأكسجين بالهيكل الرئيسي skeleton ونمط الحلقنة cyclisation: furofuran, furan, dibenzylbutane, diben-zylbutyrolactol, dibenzylbutyrolactone, aryltetra-lin, arylnaphtalene, dibenzocyclooctadiene يتم تحويل الليغنان في الأمعاء إلى enterolactone + enterodiol والتي يعتقد أنها ذات آثار مفيدة على صحة الإنسان بسبب فعالياتها المختلفة: الفعالية الاستروجينية، المضادة للالتهابات والمضادة للأكسدة وكذلك القدرة على الحد من مخاطر السرطان والقلب والأوعية الدموية(6). بالنظر إلى العدد الكبير من الجزيئات التي يغطيها تعريف الليغنان، فإنه لا يزال هناك الكثير من العمل للعلماء المهتمين بهذا النوع من المركبات ويتضمن ذلك تطوير وتحسين طرق الاستخلاص والفصل وتحديد الهوية، وقد تم القيام بأعمال قليلة في هذا المجال ومعظمها على بذور الكتان كغذاء مرجعي، كونه الغذاء الأكثر وفرة بالليغنانات. وقد تم إثبات أن أكثر ليغنان تم التقصي عنه في بذور الكتان هو الـــ secoisolariciresinol (SECO)، وهو ذو بنية قليلة التماثر oligomeric مرتبطة بجزيئات الغلوكوز مشكّلة secoisolariciresinol diglucoside (SDG). كما يرتبط الــ SDG بشكل إضافي بواسطة روابط استرية بجزيئات حمض 3-ميثيل-3- هيدروكسي غلوتاريك(6). وتتضمن طرق استخلاص الليغنانات الخطوات الأساسية التالية:
1- استخلاص غليكوزيدات الليغنان؛
2- حلمهة الغليكوزيدات واستخلاص الأغليكون.
بالإضافة إلى العديد من الخطوات الإضافية وذلك بسبب بنية الليغنان Lignan المعقدة داخل نسيج النبات، فضلاً عن وجود بوليميرات الليغنان الأخرى غير المعروفة. يتم استخلاص الليغنان من القشور بمذيب كحولي أليفاتي، على سبيل المثال مزيج من الميثانول أو الإيثانول بالماء(6).
مواد وطرق البحث:
بذور الكتان Flax seeds:
أخذت بذور الكتان بنية اللون من أحد المزارع الموجودة في ريف دمشق، سوريا.
المذيبات والكواشف والمعياريات:
كاشف الفينولات Folin-Ciocalteu من شركة Merck الألمانية، كربونات الصوديوم اللامائية %20 وكلوريد الألمنيوم Aluminum trichloride (AlCl3) من شركة Riedel-de Hean الألمانية، عياري. كيرﺴﺘﻴﻥ Quercetine من شركة SIGMA-ALDRICH الأميركية، عياري ﺤﻤﺽ ﺍﻟﻐﺎﻟﻴﻙ Gallic acid من شركة AVONCHEM البريطانية ايثانول تحليلي، ايثر بترول، حمض الهيدروكلوريك 2N، هيدروكسيد الصوديوم 10 مول/ ل، دي ايثيل ايثر، ايثيل أسيتات من شركة SIGMA-ALDRICH الأميركية.
طرق الاستخلاص:
تحضير العينات:
* العينات منزوعة الدسم:
جففت عينات بذور الكتان في المحم بدرجة حرارة 60م ومن ثم طحنت، أخذ مقدار 20 غ من مطحون بذور الكتان المجففة واستخلص منها المواد الدسمة بمقدار 80 مل ايثر بترول وذلك بالغليان تحت مبرد صاعد مدة 3 ساعات (درجة حرارة 60م).
استخلاص الليغنانات بالحلمهة الحامضية المباشرة
أخذ مقدار 12 غ من مسحوق بذور الكتان المنزوعة الدسم وأُضيف اليها 90 مل حمض الهيدروكلوريك 2N، تم تعريض المجموع للغليان مع التحريك المستمر مدة 3 ساعات. بعد تبريد الخلاصة لدرجة حرارة الغرفة تم تعديل الحموضة إلى pH= 5-6 بإضافة بضع قطرات من هيدروكسيد الصوديوم NaOH10 مول/ل، ومن ثم تم الاستخلاص مدة ساعة واحدة بإضافة 72 مل دي ايثيل ايثر وايثيل أسيتات (1:1) حجم/ حجم وباستخدام حبابة الإبانة تم فصل الطبقة العضوية، تم تكرار الاستخلاص أربع مرات، ومن ثم تم تبخير الخلاصة العضوية باستعمال المبخر الدوار، حيث حُفظت الخلاصة الجافة في الثلاجة لحين الاستخدام(6).
استخلاص الليغنانات بالحلمهة الحامضية لمستخلصات الايثانول:
أخذ مقدار 6 غ من مسحوق بذور الكتان منزوعة الدسم واستخلصت بمقدار 60 مل ايثانول 70% بالتسخين مدة ساعة واحدة بدرجة حرارة 60ºم مع تحريك العينات كل 15 دقيقة وترشح الخلاصة حيث يكرر الاستخلاص 4 مرات بهذه الطريقة، جمعت الخلاصات وجففت بالمبخر الدوار. أخذت الخلاصة الجافة وأضيف لها 45 مل حمض الهيدروكلوريك 2N، حيث تم الاستخلاص بالغليان تحت مبرد صاعد مع التحريك المستمر بالمحرك المغناطيسي مدة 3 ساعات. تم التبريد الى درجة حرارة الغرفة ومن ثم تم تعديل الحموضة إلى درجة باهاء 5-6=pH بإضافة بضع قطرات من هيدروكسيد الصوديوم NaOH، 10 مول/ ل. تم الاستخلاص بعد ذلك مدة ساعة واحدة بإضافة 36 مل دي ايثيل ايثر وايثيل أسيتات (1:1) حجم/ حجم باستخدام حبابة الإبانة لفصل الطبقة العضوية، وتم تكرار الاستخلاص أربع مرات. حيث جمعت الخلاصات وجففت بالمبخر الدوار وحُفظت العينات الجافة في الثلاجة(6).
العينات غير منزوعة الدسم:
استخلاص الليغنانات بالحلمهة الحامضية المباشرة
أخذ مقدار 20 غ من مسحوق بذور الكتان منزوعة الدسم وإضيف اليها مقدار 150 مل حمض الهيدروكلوريك 2N. تم تسخين المزيج مع التحريك المستمر بالمحرك المغناطيسي عند الدرجة 100م مدة 3 ساعات. تم تبريد الخلاصة الى درجة حرارة الغرفة ومن ثم تم تعديل الحموضة إلى باهاء pH= 5-6 بإضافة بضع قطرات من هيدروكسيد الصوديوم NaOH، 10 مول/ ل، ومن ثم تم الاستخلاص مدة ساعة واحدة بإضافة 120 مل دي ايثيل ايثر وايثيل أسيتات (1:1) حجم / حجم وباستخدام حبابة الإبانة تم فصل الطبقة العضوية وتم تكرار الاستخلاص أربع مرات. جُمعت الخلاصات الناتجة وجُففت وحفظت الخلاصة الجافة بالثلاجة لحين الاستخدام(6).
الخلاصة Et 80%)) الايثانولية 80%:
أخذ مقدار 10غ من مسحوق بذور الكتان وأُضيف اليها 100 مل ايثانول 80% واستخلصت بدرجة حرارة الغرفة مع التحريك المستمر بالمحرك المغناطيسي، رُشحت الخلاصة وجُففت بالمبخر الدوار عند الدرجة 45م. وزنت الخلاصة وأذيبت بقليل من الايثانول وحفظت في الثلاجة لحين الاستخدام(4).
الحلمهة القلوية بعد الاستخلاص بالايثانول:
أخذ مقدار 10غ من مسحوق بذور الكتان وأضيف اليها مقدار 200 مل ايثانول %50، تم الاستخلاص بحرارة 60º مئوية مع التحريك المستمر بالمحرك المغناطيسي ثلاث ساعات، تمت إعادة عملية استخلاص المسحوق بالشروط السابقة ولمدة ساعتين. تم تثفيل الخلاصة الناتجة مدة 20 دقيقة (3000 دورة/د) وأخذ السائل الطافي، الذي تم تبخيره باستعمال المبخر الدوار وبحرارة 45ºم. أُجريت حلمهة قلوية للخلاصة في درجة حرارة الغرفة مدة أربع ساعات مع التحريك المستمر باستخدام قطرات من هيدروكسيد الصوديوم NaOH (0.25 M). تم تحميض الناتج حتى الوصول إلى درجة باهاء pH=4 باستخدام حمض الهيدروكلوريك (11)(6M).
معايرة محتوى الفينولات الكلية:
تم تحديد مقدار الفينولات الكلية بطريقة Folin-Ciocalteu (Slinkard &Singleton, 1997)، حيث يؤخذ 20 µl من العينة التي سبق تحضيرها، ويضاف إليها 1.58 مل من المـاء المقطـر، ومقدار 100 µl من كاشف Folin-Ciocalteu، تحضن العينات مدة عشر دقائق في درجة حرارة الغرفة. أضيف بعد ذلك مقدار 300 µl مـن كربونات ثنائية الصوديوم (Na2CO3 20%). تـرك المزيج مدة 40 دقيقة في درجة حرارة الغرفة، بعدها تم قياس الامتصاصية بمقياس الطيف الضوئي بطول موجة 765 نانو متر. تم تحديد العلاقة بين الامتصاص والتركيز باستعمال معياري حمض الغاليك 5) غ/ ل) كما هو موضح في (الشكل 3). حيث ﺘﻡ ﺍﻟﺘﻌﺒﻴﺭ ﻋﻥ ﺍﻟﻨﺘﺎﺌﺞ ﺒﻌﺩﺩ ﺍﻟﻤيليغرامات ﺍﻟﻤﻭﺍﻓﻘﺔ ﻟﺤﻤﺽ ﺍﻟﻐﺎﻟﻴﻙ ﻟﻜل واحد غرام ﻤﻥ ﻭﺯﻥ ﺍﻟﻤﺴﺘﺨﻠﺹ ﺍﻟﺠﺎﻑ(9).
معايرة المحتوى الفلافونوئيدي:
يتم تحديد محتوى الفلافونوئيدات بطريقة التفاعل مع AlCl3 ( Boharun وزملاؤه 1996). يضاف 1 مل من محلول AlCl3 %2 إلى 1 مل من التمديد المحدد للخلاصات ثم ترج الأنابيب وتحضن في درجة حرارة المختبر مدة 10 دقائق وبعد ذلك يتم قياس الامتصاص الضوئي عند موجة طولها 464 نانومتر. يتم تحديد العلاقة بين الامتصاص والتركيز باستعمال معياري الكيرستين كما هو موضح في الشكل 4، ويتم التعبير عن النتائج بعدد الميليغرامات المكافئة للكيرستين لكل غرام واحد من وزن المستخلص الجاف(2).
النتائج والمناقشة:
يظهر الشكل 3 منحنى عياري حمض الغاليك، وقد تم تحديد إجمالي الفينولات لخلاصات البذور كما هو وارد في الجدول 1. من هذه النتائج نلاحظ أن الخلاصات تحتوي على كميات معتبرة من عديدات الفينول غير أنه يلاحظ أن المحتوى الفينولي لخلاصة الليغنانات المُحضرة بطريقة الحلمهة الحامضية المباشرة أكبر بنسبة %30 من المحتوى الفينولي لخلاصة الليغنانات المُحضرة بطريقة لخلاصة الليغنانات المحضرة بطريقة الحلمهة الحامضية للمستخلصات الايثانولية. بينما شكّل المحتوى الفينولي لخلاصة الليغنانات المُحضرة بطريقة الحلمهة الحامضية المباشرة %68.77 من المحتوى الفينولي للخلاصة الايثانولية %80. في حين لم تعطِ الخلاصات منزوعة الدسم فارق يعتدّ به عن الخلاصات غير منزوعة الدسم. تظهر نتائجنا توافقاً مع نتائج Farooq Anwar وزملائه (4)(2012)، حيث أعطت الخلاصة الايثانولية 80% مردود فينولي مقارب جداً للمردود في دراستنا. في حين تفوق مردود الفينولات في دراستنا (32.6 ملغ/ غ) على مردود فينولات الخلاصة الايثانولية 70% (15.5 ملغ/ غ) في دراسة Hanaa وزملاؤها (5)(2017). كما توافقت الدراسة مع دراسة Sultana وزملاؤه (2007) والتي أوضحت أنّ الخلاصة الايثانولية %80 تعطي أفضل مردود لاستخلاص المركبات الفينولية من لحاء بعض النباتات(5). تتوافق بياناتنا مع دراسة Farooq Anwar وزملائه (2012) التي أثبتت أن استعمال الاغوال المائية كانت أكثر فعالية في عزل المركبات الفينولية من بذور الكتان(4). أعطت خلاصة البذور المُعرضة للحلمهة الحامضية المباشرة، والتي استخدم فيها مزيج من خلات الايثيل/ دي ايثيل ايثر بعد الاستخلاص بالايثانول المردود الفينولي الأعلى ويمكن أن نقول أن هذه النتيجة قريبة لنتيجة Sue-siang وزملاؤه والتي استخدم فيها نظام محلات (الميثانول: الأسيتون: الماء، 7: 7: 6 حجم/ حجم/ حجم) وقد أوضح فيها أن هذا المزيج هو الأفضل لاستخلاص المركبات الفينولية(10). لم تعطِ الخلاصة منزوعة الدسم تغيراً ملحوظاً في المحتوى الفينولي عن الخلاصة غير منزوعة الدسم، وقد توافق ذلك مع نتيجة Hrvoje وزملائه(2012) (6). أعطت الخلاصة المحضّرة بطريقة الحلمهة الحامضية المباشرة مردود فينولي أعلى من الخلاصة المحضّرة بطريقة الحلمهة بعد الاستخلاص الايثانولي، وقد توافق ذلك مع نتيجة Hrvoje وزملائه (2012) حيث وضّح في دراسته أن محتوى الليغنانات بطريقة الحلمهة الحامضية المباشرة كان الأعلى(6). يظهر الشكل 4 منحنى عياري الكيرستين وقد وجد أن هناك تناسب طردي بين زيادة الامتصاصية وارتفاع التركيز. وانطلاقاً من النتائج المدونة في الجدول 2 نلاحظ أن كمية الفلافونوئيدات المكافئة للكيرستين في خلاصة الليغنانات منزوعة الدسم المحضرة بطريقة الحلمهة الحامضية بعد الاستخلاص بالايثانول أقل بنسبة %27 من كمية الفلافونوئيدات في خلاصة الليغنانات منزوعة الدسم المحضرة بطريقة الحلمهة الحامضية المباشرة. في حين لم تعطِ الخلاصات الايثانولية وخلاصة الليغنانات المحضرة بطريقة الحلمهة القلوية كمية فلافونوئيدات كبيرة. بالمقارنة مع الأدبيات المنشورة يمكننا اعتبار المحتوى الفلافونوئيدي للخلاصة الايثانولية أكثر ارتفاعا بمعدل 80%، إلا أنه أقل من المحتوى الفلافونوئيدي في دراسة Farooq Anwar وزملاؤه (2012) (4) حيث كان المحتوى الفلافونوئيدي (3.9 ملغ/ غ)، حيث قام باستخدام الكاتشين بدلاً من الكيرستين. يتوافق المحتوى الفلافونوئيدي للخلاصة الايثانولية %80 مع المحتوى الفلافونوئيدي للخلاصة الايثانولية %70 في دراسة Hanaa وزملاؤها (5)(2017). أظهر Sue-siang وزملاؤه (2014) أن كميات الفلافونوئيد الكلية المستخرجة من بذور الكتان باستخدام مذيبات مختلفة تظهر اختلافات كبيرة بين المستخلصات المختلفة(10).
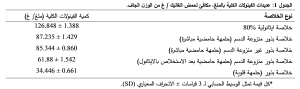


*كل نقطة من المنحنى تمثل الوسيط الحسابي لـ 3 قياسات ± الإنحراف المعياري (SD)

*كل نقطة من المنحنى تمثل المتوسط الحسابي لــ 3 قياسات ± الإنحراف المعياري (SD)
الخاتمة:
بينت دراستنا أن المحتوى الفينولي لخلاصة الليغنانات الغليكوزيدية المحضّرة بالاستخلاص بالايثانول %80 مع التحريك المستمر أفضل من المحتوى الفينولي لخلاصات الليغنانات الحرّة، بينما كان المحتوى الفلافونوئيدي في خلاصة الليغنانات الحرّة المحضّرة بالاستخلاص بمزيج من خلات الايثيل و دي ايثيل ايثر (1:1) بعد الحلمهة الحامضية المباشرة أفضل من المحتوى الفلافونوئيدي لخلاصة الليغنانات الحرّة المحضّرة بطريقة الحلمهة الحامضية بعد الاستخلاص بالايثانول وأفضل من الحتوى الفلافونوئيدي لخلاصة الليغنانات الغليكوزيدية المحضّرة بالاستخلاص بالايثانول %80 مع التحريك المستمر. وبذلك يمكننا القول أنّ بذور الكتان تمثل مصدراً قيماً لمضادات الأكسدة الفينولية والتي يمكن الاستفادة منها كمضادات أكسدة طبيعية بعد التأكد من مأمونية وفعالية هذه المركبات للاستفادة منها كبديل عن مضادات الأكسدة الاصطناعية، كما أنه من الضروري أيضاً إجراء مزيد من الأبحاث لدراسة الفعالية المضادة للأكسدة لفينولات بذور الكتان في المختبر وفي الجسم الحي مثل الفلافونوئيدات والحموض الفينولية والتانينات.
المراجع :1-Amit J.J. and Linda M.H. Flax (Linum usitatissimum.L.): Current uses and future applications. Australian Journal of Basic and Applied Sciences, 2010.
2-Bouharun T. et al. Oxygen species scavenging activity of phenolic extracts from Hawthorn fresh plant organs and pharmaceutical preparation. Arezneim-Forsh/Drug Res, 1-6, 1996.
3-Farah S.H. et al. Antioxidant capacity of flaxseed lignans in two model systems. Journal of the American Oil Chemists’ Society, 83, 835, 2006.
4-Farooq A. and Roman P. Effect of Solvents Extraction on Total Phenolics and Antioxidant Activity of Extracts from Flaxseed (Linum Usitatissimum L.). Acta Sci. Pol; Technol. Aliment; 11, 3, 293-301, 2012.
5-Hanaa M.H. et al. Antioxidant Activity and Phytochemical Analysis of Flaxseeds (Linum Usitatisimum. L). Minia J. of Agric. Res. & Develop, 37, 1, 129-140, 2017.
6-Hrvoje S. et al. Preparation of Flaxseed for Lignan Determination by Gas Chromato-graphy-Mass Spectrometry Method. Czech J. Food Sci, 30, 1, 45-52, 2012.
7-John A. and Grohmann K. Phenols in citrus peel byproducts, concentration of hydroxycinnamates and polymethoxylated flavones in citrus peel molasses. Journal of Agriculture Food Chemistry, 49, 3268-3273, 2002.
8-Kasote D.M. Flaxseed phenolics as natural antioxidants. International Food Research Journal 20, 1, 27-34, 2013.
9-Slinkard K. and Singleton VL. Total phenol analyses: Automation and comparison with manual methods. American Journal of Enology and Viticultue, 28, 49-55, 1977.
10-Sue-Siang B. and Birch. J. Antioxidant Polyphenols from Defatted Oilseed Cakes Effect of Solvents. Antioxidants, 3, 67-80, 2014.
11-Zhen-S.Z. and Dong L. et al. Optimization of ethanol-water extraction of lignans from flaxseed. Separation and Purification Technology, 57, 17-24, 20