تقييم الفعالية المضادة للأكسدة وتحديد محتوى الفينولات الكلَي لنبات القرصعنة المنتشر في سورية
2021-10-01 | المجلد السادس العدد الثامن - المجلد السادس | مقالات بحثيةالكساندرا نصر | ميس خازم
الملخص
ينتشر نبات القرصعنة بشكل واسع في سورية وله استعمالات شعبيّة متنوّعة، وبما أن العديد من الأمراض الحادة والمزمنة ترتبط بالشدة التأكسدية، هَدَفت دراستنا لتقييم الفعالية المضادة للأكسدة وتحديد محتوى الفينولات الكلي لنبات القرصعنة. تم استخلاص الأجزاء الهوائية للنبات بالاستعانة بالحرارة تحت مبرّد صاعد باستخدام كل من الماء والإيثانول 80% على حِدة. تم تقييم الفعالية المضادة للأكسدة بقياس القدرة الكاسحة للجذر الحر DPPH•، أظهرت كلا الخلاصتين فعالية عالية مضادة للأكسدة، وكانت القدرة المضادة للأكسدة أعلى في الخلاصة الإيثانولية (IC50 = 0.088 ملغ/مل) منها في الخلاصة المائية (IC50 = 0.096 ملغ/مل) مقارنة بحمض الغاليك كشاهد إيجابي (IC50 = 1.763 مكغ/مل). تم تحديد محتوى الفينولات باستخدام طريقة فولين سيوكالتو وكان 32.63 و30.91 ملغ من مكافئات حمض الغاليك لكل غرام من مسحوق النبات في الخلاصتين الإيثانولية والمائية على التوالي. تظهر هذه النتائج أن نبات القرصعنة مصدر جيد للمركبات المضادة للأكسدة ويمكن أن يُستخدم في الوقاية من الأمراض المرتبطة بالشدة التأكسدية.
كلمات مفتاحية : القرصعنة، الفينولات، الفعالية المضادة للأكسدة، القدرة الكاسحة للجذر الحر DPPH•، كاشف فولين سيوكالتو.
المقدمة Introduction
تتواسط الشدة التأكسدية بأنواع الأكسجين المتفاعلة التي تتشكّل خلال الاستقلاب الخلوي الطبيعي والشاذّ حيث يتم استخدام الأكسجين الجزيئي. إنّ خلل التوازن بين إنتاج أنواع الأكسجين المتفاعلة وإمكانيّة أنظمة إزالة السمية الطبيعية لصالح المؤكسدات يؤدي إلى الشدة التأكسدية، والتي تؤدي إلى الأذية الخلوية بسبب تفاعل أنواع الأكسجين المتفاعلة مع المكونات الخلوية. تلعب الشدة التأكسدية دوراً في العديد من الأمراض الحادة والمزمنة بما فيها السرطان cancer، المشاكل القلبية الوعائية cardiovascular troubles والأمراض العصبية التنكسيّة كباركنسون Parkinson’s disease وألزهايمر Alzheimer’sdisease، التهاب المفاصل Arthritis، السكري، الساد Cataract. Farhan et al, 2012، Li et al, 2014. تلعب مضادات الأكسدة دوراً هاماً في كسح الجذور الحرة والحفاظ على توازن الجسم، ويعدّ البحث عن مضادات أكسدة طبيعية لاستبدال مضادات الأكسدة الصنعيّة توجّهاً للصناعات الدوائية، Li et al, 2014. تُعدّ النباتات الطبية مصدراً للعديد من المنتجات الطبيعية المتنوعة، ومن بينها الحموض الفينولية والفلافونوئيدات المثيرة للاهتمام بسبب خصائصها المضادة للأكسدة. بالإضافة لقدرتها على العمل ككاسحات للجذور الحرّة، فإن مصدرها الطبيعي يجعلها مفضّلة للمستهلك على عكس مضادات الأكسدة الصنعيّة التي تكون استعمالاتها محدودة لأنها تزيد احتمال حدوث السرطان، Farhan et al, 2012. تعتمد القدرة الكاسحة للجذور الحرة للمركبات الفينولية على أن احتمالية إرجاع جذر الفينوكسيل أقل من احتمالية إرجاع أنواع الأكسجين المتفاعلة وأن جذر الفينوكسيل أكثر ثباتاً أو أقل تفاعلية من جذر الأكسجين. André et al, 2010. ينتمي جنس القرصعنة Eryngium إلى الفصيلة الخيمية Apiaceae / Umbelliferae ويحتوي ما يزيد على 230 نوع تتوزع بشكل واسع في أنحاء العالم. استُهلك الكثير من أنواع هذا الجنس للوقاية من العديد من المشاكل الصحية. Rjeibi et al, 2017. تُعدّ سوريا مركزاً للتنوع الحيوي، ويُقدّر بأن الفلوره السورية تحتوي حوالي 3150 نوعاً منظّمة في 919 جنساً وفي 133 فصيلة. وتوجد في سوريا 8 أنواع من القرصعنّة هي E. glomeratum، E. campestre، E. falcatum، E. desertorum، E. creticum، E. maritimum، E. pussilum، E. billardieri. Jawdat et al, 2010. ينتشر نوع E. creticum في شمال إفريقيا (مصر)، آسيا (العراق، فلسطين، لبنان، سوريا، الأردن وتركيا) وفي أوروبا (ألبانيا، بلغاريا، اليونان، مقدونيا، مونتينيغرو وسلوفينيا). ويُعرف عند العرب بعدّة أسماء شائعة مثل: شوك العقرباتي، قرصعنة، قرصعنة إكريتيّة. وله عدة أسماء انكليزية شائعة أيضا مثل: Eryngo، جذر الأفعى Snake root، Field Eryngo small-headed، Blue eryngo، Cretan eryngo، Al-Snafi, 2016. استُخدم E. creticum شعبياً كترياق للسعات الأفاعي والعقارب، حيث تناول العرب الأوراق أو بتحضير لُطاخة من الجذور الأرضيّة. إن الجذور والبذور المنقوعة في الماء تُشرب لعلاج حصيّات الكلية والإنتانات، الأمراض الجلديّة والأورام. استُعملت البذور لشفاء الآلام المَعديّة، الزَرَق في العين، ولطرد الديدان. استُعملت عُصارة الأوراق أيضاً لعلاج السكّري. في الطب الإسلامي، استُخدم النبات لعلاج العديد من الأمراض: استُخدمت الجذور بشكل خاصّ لعلاج الوذمة، التهاب الجيوب، الإنتانات البوليّة، والالتهاب. استُعمل أيضاً لعلاج الأمراض الكبدية، التسمّم، فقر الدم، والعقم، وذلك بتحضير منقوع من 50 غ من كامل النبات في 1 لتر من الماء، ويؤخذ فموياً ثلاث مرات يومياً. Kikowska, 2016. تشير نتائج عدد من الدراسات المنشورة إلى مجال واسع من الفعاليات البيولوجية والفارماكولوجية والتي تُعزى لأجزاء وخلاصات مختلفة من النبات، بما فيها التأثيرات المضادة لسمّ الأفاعي والعقارب anti-snake and anti-scorpion venom، المضادة للجراثيم antibacterial، المضادة للفطور antifungal، والمضادة للايشمانية antileishmanial، المضادة لارتفاع سكّر الدم antihyperglycemic، الخافضة لسكّر الدم hypoglycemic، والمضادة للأكسدة antioxidant، Kikowska, 2016، والمضادة للالتهاب Anti-inflammatory والمضادة للألم antinociceptive والمضادة للسرطان Anticancer. Al-Snafi, 2016. أظهر التحليل الكيميائي النباتي الأولي أن النبات يحتوي على الزمر الكيميائية التالية: قلويدات Alkaloids، تانينات Tannins، راتنج Resins، سابونينات Saponins، كومارينات Coumarin، فينولات Phenols، تربينات Terpenoids، فلافونوئيدات Flavonoids، كربوهيدرات Carbohydrates. يتراوح محتوى الفينولات الكلي بين 8.57 و 17.68 مكغ/ مل، ومحتوى الفلافونوئيدات الكلي بين 17.73 و 20.19 مكغ/ مل Al-Snafi, 2016، وكان مردود الزيت العطري للنبات 0.21% (حجم/ وزن) عند الباحث elik et al, 2011Ç، ومردود الزيت العطري للجذوع Stems 0.18% (وزن/ وزن) عند الباحث Mohammad hosseini, 2013. تهدف دراستنا لتقييم الفعالية المضادة للأكسدة وتحديد محتوى الفينولات الكلّي لنبات القرصعنة نظراً لانتشاره الواسع في سورية واستعمالاته الشعبية لدعم استعماله في الوقاية من الأمراض الناتجة عن الشدة التأكسدية.
المواد والطرق Materials and Methods:
المواد الكيميائية Chemicals:
إيثانول مطلق من شركة Merck، حمض الغاليك من شركة Prolabo، كربونات الصوديوم اللامائية من شركة Riedel-de Haën، كاشف فولين سيوكالتو من شركة Fluka، كاشف DPPH• (2,2-Diphenyl-1-picrylhydrazyl) من شركة Sigma-Aldrich.
الأجهزة المستخدمة Apparatus Used:
مقياس الطيف الضوئي UV-VIS من نوع: Jasco V-650 Spectrophotometer، ميزان حساس، مبرد صاعد.
جمع النبات والاستخلاص Plant Collection and Extraction:
تم جمع النبات من منطقة بانياس في محافظة طرطوس، بجانب قلعة المرقب على ارتفاع 370 م فوق سطح البحر، في بداية شهر حزيران. تم تجفيفه بدرجة حرارة الغرفة في الظل ثم حفظه في أكياس محكمة الإغلاق. تم سحق الأجزاء الهوائية للنبات وأخذ 25غ من المسحوق ثم الاستخلاص بالاستعانة بالحرارة تحت مبرَد صاعد Reflux Extraction لمدة ساعتين باستخدام كل من الماء والإيثانول 80% على حِدة، تم ترشيح العينة عبر ورقة ترشيح وحفظها في البراد.
تحديد محتوى الفينولات الكلّي Determination of Total Phenols:
تم تحديد محتوى الفينولات الكلي باستخدام كاشف فولين سيوكالتو وفق طريقة Dammous et al, 2014، مع تعديل الحجوم المستخدمة للحصول على قيم امتصاص مناسبة، وتعتمد هذه الطريقة على إرجاع الفينولات لحمض فوسفومولبيدات التنغستين في وسط قلوي فينتج لون أزرق يقاس امتصاصه عند موجة طولها 765 نانومتر. تم وضع 500 µL من العينة الممددة في أنبوب وأضيف لها 500 µL من كاشف فولين سيوكالتو الممدد بنسبة (1:10) و1500 µL من محلول كربونات الصوديوم 2% مُزجت جيداً ثم حُضن المزيج بدرجة حرارة الغرفة لمدة 15 دقيقة، بعدها تم قياس الامتصاص عند موجة طولها 765 نانومتر. تم استخدام حمض الغاليك كعياري مرجعي حيث تم تحضير سلسلة منه بالتراكيز 20، 30، 40، 60، 80 ميكروغرام/ مل. ثم تم تمثيل ذلك بيانياً ومن ثم حساب محتوى الفينولات كمكافئات من حمض الغاليك ﻠ 1 غ من مسحوق الأجزاء الهوائية للنبات.
تقييم الفعالية المضادة للأكسدة
Evaluation of Antioxidant Activity
تم تقييم الفعالية المضادة للأكسدة بقياس القدرة الكاسحة للجذر الحر DPPH• وفق طريقة Dammous et al, 2014 تعتمد هذه الطريقة على الجذر الحرّ DPPH• ذي اللون البنفسجي الذي يكتسب بوجود مادة مضادة للأكسدة الكتروناً أو أكثر ويتناقص الامتصاص. تم تحضير 4 تمديدات من كل من الخلاصتين المائية والإيثانولية ووُضع 1 مل من العينات السابقة في محفد، وأضيف لها 1 مل من كاشف DPPH• بتركيز (0.15 mM في الإيثانول)، مزجنا جيداً ثم حضننا المزيج بدرجة حرارة الغرفة لمدة 30 دقيقة، بعدها تم قياس الامتصاص عند موجة طولها 517 نانومتر مقابل الإيثانول كناصع، وباستخدام محلول DPPH• كشاهد Control. تم حساب نسبة كسح الجذور الحرة من العلاقة:

تم تمثيل النتائج بيانياّ وحساب (IC50) من معادلة الخط البياني الناتج.
النتائج والمناقشة Results and Discussion:
تحديد محتوى الفينولات الكلّي Determination of Total
Phenols:
يمثل الجدول 1 تراكيز سلسلة حمض الغاليك وقيم الامتصاص المقابلة لها.

تم تمثيل النتائج بيانياً وتحديد معادلة الخط البياني ورسمه، الشكل 1.
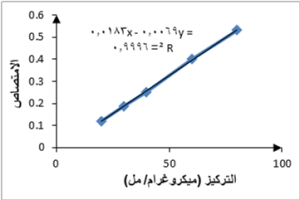
بعد تطبيق التفاعل اللوني على عينتين ممددتين من كل من الخلاصتين المائية والإيثانولية وبتعويض قيم الامتصاص في معادلة الخط البياني السابقة تم حساب محتوى الفينولات الكلي كمكافئات من حمض الغاليك ﻠ 1 غ من مسحوق الأجزاء الهوائية للنبات فكانت النتائج كما في الجدول 2. نلاحظ أن محتوى الخلاصة الإيثانولية من الفينولات أعلى من محتوى الخلاصة المائية، وتقاربت النتائج مع الدراسات السابقة، حيث كانت القيم قريبة من قيم دراسة Rammal et al. لكن كان محتوى الخلاصة المائية (33.88 ملغ GAE) للأوراق و (31.96 ملغ GAE) للجذوع أعلى من محتوى الخلاصة الإيثانولية (24.19 ملغ GAE) للأوراق و (21.85 ملغ GAE) للجذوع على عكس نتائج دراستنا.
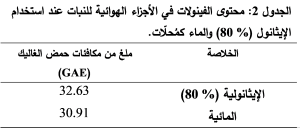
بينما في دراسة Dammous et al. كان محتوى الفينولات في الخلاصة الإيثانولية 253 ملغ GAE للأوراق و 230 ملغ GAE للجذوع أعلى من الخلاصة المائية ( 59.2ملغ GAE) للأوراق و (47.5 ملغ GAE) للجذوع وكانت القيم أعلى من قيم نتائج دراستنا.
تقييم الفعالية المضادة للأكسدة Evaluation of Antioxidant Activity:
يظهر الجدول 3 القدرة الكاسحة للجذور الحرة لتراكيز متزايدة من كل من الخلاصتين الإيثانولية والمائية للأجزاء الهوائية لنبات القرصعنة. أظهرت نتائج دراستنا قدرة كاسحة للجذور الحرة لكلا الخلاصتين الإيثانولية والمائية للأجزاء الهوائية للنبات، وكانت القدرة أعلى في الخلاصة الإيثانولية حيث تم حساب (IC50) من معادلة الخط البياني الممثل للتركيز مقابل قيمة القدرة الكاسحة للجذور الحرة (%) لكل من الخلاصتين الإيثانولية، الشكل 2، والمائية، الشكل 3، فكانت 0.088 ملغ/ مل، للخلاصة الإيثانولية و 0.096 ملغ/ مل للخلاصة المائية مقارنة بحمض الغاليك كشاهد إيجابي (IC50 = 1.763 مكغ/ مل). كانت قيم القدرة الكاسحة للجذور الحرة في دراستنا أعلى من القيم في الدراسات المرجعية، حيث كانت قيمة IC50 للخلاصة الإيثانولية للأوراق 0.18 ملغ/ مل وللجذوع 3 ملغ/ مل وللخلاصة المائية للأوراق 0.22 ملغ/ مل وللجذوع 3.2 ملغ/ مل في دراسة Dammous et al. و 0.481 ملغ/ مل للخلاصة الإيثانولية للأوراق والجذوع معاً في دراسة Damaj et al..
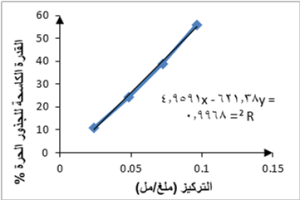
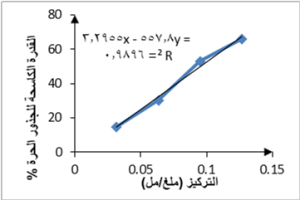
يمكن أن يعود اختلاف النتائج لاختلاف طرق الاستخلاص المتبعة حيث في دراسة Dammous et al. تمّ الاستخلاص بمساعدة الأمواج فوق الصوتية وفي دراسة Damaj et al. تمّ الاستخلاص بالاستعانة بالحرارة تحت مبرّد صاعد لمدّة 4 ساعات، بينما استخدمنا في دراستنا الاستخلاص بالاستعانة بالحرارة تحت مبرّد صاعد لمدّة ساعتين فقط.
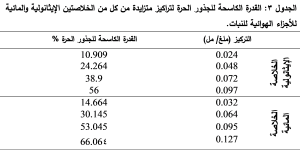
وقد يعود اختلاف القيم أيضاً لاختلاف فترة الجني حيث تم جني النبات في الشهر السادس بعد اكتمال فترة الإزهار بينما في دراسة Dammous et al. تم الجني في الشهر الثالث، فقد لوحظ في دراسات سابقة أن الفعالية المضادة للأكسدة تكون أعلى ما يمكن في فترة الإزهار بينما تكون أقلّ ما يمكن في الفترة التي تسبق فترة الإزهار Alizadeh et al. والذي قد يكون بسبب تعرض النبات للظروف المشمسة في فترة الإزهار Fernando et al. وقد يعزى الاختلاف أيضاً إلى اختلاف شروط الزراعة والمناخ والتربة.
الاستنتاجات Conclusion:
أظهرت نتائج الدراسة احتواء نبات القرصعنة على الفينولات وكان محتواها أعلى في الخلاصة الإيثانولية من المائية. ولقد تناسب محتوى الفينولات مع القدرة الكاسحة للجذور الحرة حيث كانت أعلى في الخلاصة الإيثانولية أيضاً مما يقترح أن المركبات الفينولية قد تكون مسؤولة عن الفعالية المضادة للأكسدة، وكانت القدرة عالية في كِلا الخلاصتين. نستنتج من ذلك أن النبات مصدر جيّد للمركبات المضادة للأكسدة وقد يستعمل للوقاية من الأمراض المرتبطة بالشدّة التأكسدية.
المراجع :1-Al-Snafi AE. Chemical constituents and pharmacological effects of Eryngium creticum– a review. Indo American Journal of Pharmaceutical Sciences, 4(01), 67-73, 2017.
2-Alizadeh A. et al. Essential Oil Composition, Total Phenolic Content, Antioxidant Activity and Antifungal Properties of Iranian Thymus daenensis subsp. Daenensis Celak as in influenced by Ontogenetical Variation. Journal of Essential Oil Bearing Plants, 16(1), 59-70, 2013.
3-André CM. et al. Dietary Antioxidants and Oxidative Stress from a Human and Plant Perspective. A Review, Current Nutrition & Food Science, 6, 2-16, 2010.
4-Çelik A. et al. Phytochemical Constituents and Inhibitory Activity towards Methicillin-Resistant Staphylococcus aureus Strains of Eryngium Species (Apiaceae). Chemistry & Biodiversity, 8, 454-459, 2011.
5-Damaj R. et al. Antioxidant Activity and Chemical Composition of the Ethanolic Extract from Leaves and stems of the Lebanese Eryngium Creticum. Journal of Multidisciplinary Engineering Science and Technology, 3(11). 5813-5823, 2016.
6-Dammous M. et al. Chemical Composition of Lebanese Eryngium Creticum L. International Journal of Sciences, 3, 40-53, 2014.
7-Farhan H. et al. Phytochemical screening and antioxidant activity of Lebanese Eryngium creticum L. Asian Pacific Journal of Tropical Biomedicine, 1217-1220, 2012.
8-Fernando I.D.N.S. et al. Determination of phenolic contents and antioxidant capacity of different parts of Withania somnifera (L.) Dunal. From three different growth stages. Industrial Corps and Products, 50, 537-539, 2013.
9-Jawdat D. et al. Molecular and ecological study of Eryngium species in Syria. Biologia, 65(5), 796-804, 2010.
10-Kikowska M. et al. Eryngium creticum – ethnopharmacology, phytochemistry and pharmacological activity. A review. Revista Brasileira de Farmacognosia, 26, 392-399, 2016.
11-Li S. et al. Research progress of natural antioxidants in food for the treatment of diseases. Food Science and Human Wellness, 3, 110-116, 2014.
12-Mohammad Hosseini M. Hydrodistilled Volatile Oil from Stems of Eryngium creticum Lam. in the Marginal Brackish Regions of Semnan Province by Using Gas Chromatography Combined with Mass Spectrometry. Asian Journal of Chemistry, 25(1). 390-392, 2013.
13-Rjeibi I. et al. Phenolic composition and antioxidant properties of Eryngium maritimum (sea holly). Journal of Coastal Life Medicine, 5(5), 212-215, 2017