دراسة مجهرية وكيميائية وتحديد كمية كل من الفينولات الكلية والفلافونوئيدات الكلية والفعالية المضادة للأكسدة للأجزاء الهوائية لنبات القرقاص
2021-10-01 | المجلد السادس العدد الثامن - المجلد السادس | مقالات بحثيةرشا الخطيب | جمانة العاقل
الملخص
هدف البحث إلى دراسة الأجزاء الهوائية لنبات القرقاص Tripleurospermum auriculatum (Boiss.) Rech. f. من الفصيلة النجمية Asteraceae. حيث تم فحص مسحوق النبات مجهرياً وتحري المكونات الفعالة، كما تم تحديد المحتوى الكلي من الفينولات والفلافونوئيدات والفعالية المضادة للأكسدة للخلاصة الميثانولية للأجزاء الهوائية للنبات. أظهرت نتائج الدراسة المجهرية احتواء الأجزاء الهوائية للنبات على: أوبار لامسة وحيدة الخلية بكثرة – أوبار لامسة متشعبة – أوبار غدية متعددة الخلايا إضافة إلى الأجزاء الزهرية: الأزهار الأنبوبية – رأس البتلة – القلم والميسم – حبات الطلع – الطبقة الشبكية الليفية المبطنة للكيس الطلعي. كما أظهرت تفاعلات الكشف عن المجموعات الكيميائية احتواء مسحوق النبات على: الفينولات– الفلافونوئيدات إضافة ً إلى المواد التانينية. حددت الكمية الكلية من الفينولات في الخلاصة الميثانولية بطريقة الفولين – سيوكالتو وبلغ متوسط محتوى الفينولات الكلية 86.66 مقدرة بالميليغرام مكافئ حمض غاليك/ غرام. وحددت الكمية الكلية من الفلافونوئيدات في الخلاصة الميثانولية بالطريقة الطيفية الضوئية في المجال المرئي عن طريق تشكيل معقد مع كلوريد الألمنيوم وقياس الامتصاصية عند موجة طولها 425 نانومتر وبلغ متوسط محتوى الفلافونوئيدات 53.26 مقدرة بالميليغرام مكافئ كيرستين/ غرام. وحددت الفعالية المضادة للأكسدة للخلاصة الميثانولية بتطبيق اختبار DPPH حيث بلغ تركيز الخلاصة المثبط النصفي لمحلول DPPH 1.11 ملغ/ مل.
كلمات مفتاحية : القرقاص، فينولات، فلافونوئيدات، فعالية مضادة للأكسدة.
المقدمة Introduction
تعتبر الفصيلة النجمية Asteraceae من أكبر الفصائل النباتية والأكثر انتشاراً، وقد زادت البحوث الكيميائية في السنوات الحديثة الأهمية الطبية لهذه الفصيلة فلدينا الآن معرفة عن الكثير من العلاجات الشعبية شبه المهملة، وكذلك حول النباتات التي لم يتم استقصاؤها حتى الآن وتتضمن بعض النباتات التي تملك فعالية مضادة للأورام antitumor أو المضادة للجراثيم antibacterial وغيرها من النباتات التي تشكل مصدراً تجارياً للاتكس المطاط. حيث تتضمن العديد من الأجناس منها: Calendula, Centaurea, Tripleurospermum (السعيد م. وآخرون ;2003). ينتمي جنس Tripleurospermum (الفصيلة النجمية Asteraceae) إلى قبيلة Anthemideaeالمتضمنة حوالي 38نوع منتشرة في نصف الكرة الشمالي، بشكل رئيسي في حوض البحر الأبيض المتوسط بما في ذلك أوروبا، آسيا المعتدلة إضافة ً إلى عدة أنواع في شمال إفريقيا وأمريكا الشمالية. (Inceer H. et al. 2018) يُعرف نبات Tripleurospermum auriculatum (Boiss.) Rech. f. باسم القرقاص، القريص أو الزفيرة، وهو نبات عشبي أجرد، يرتفع 20-10 سم، السيقان متفرعة كل فرع ينتهي برأس زهري، الأوراق غالباً في أسفل السيقان، الأوراق طولها 3.5 سم مضاعفة التفصص إلى فصوص شريطية قد تكون معنقة أيضاً، الرؤوس الزهرية عرضها 1.5 سم قرصية إلى نصف كروية صفراء عديدة الأزهار، تحيطها القلافات والثمرة فقيرة. الشكل 1. ينمو في التربة الرملية الطميّة في الشعاب والمنحدرات الصخرية، يزهر في شهري شباط وآذار، غير رعوي. (الحسن ح 2007).

تستخدم نباتات جنس Tripleurospermum في إيران كأعشاب مهدئة ومساعدة على الاسترخاء، ولمعالجة التوتر والإرهاق. كما تستخدم الرؤوس الزهرية كطارد للريح carminative ومضاد للحمى febrifuge. كما بينت الدراسات أن هذه النباتات تمتلك طيف واسع من الفعالية البيولوجية: كمضادات أكسدة antioxidant، مضادات التهاب anti-inflammatory، مسكنة للألم analgesic ومضادة للفطور (Erdogan T F. et al; 2013) antifungal. اهتمت الدراسات السابقة بدراسة الزيت الطيار المستحصل من نباتات جنس Tripleurospermum، حيث بينت دراسة أجراها Albalaw M. et al; 2016، أن الزيت الطيار لأزهار نبات القرقاص Tripleurospermum auriculatum يتكون بشكل أساسي من المركبات التالية: (23.27%) α-pinene, (17.92%) linalylisobtyrate, (14.17%) 4-Carene boreniol (11.90%). كما أظهرت الدراسة أن الزيت الطيار يملك تأثير مضادة لنمو الجراثيم سلبية الغرام وخاصة الايشرشيا المعوية Escherichia coli والتي كانت أكثر حساسية للزيت الطيار بالمقارنة مع الجراثيم إيجابية الغرام بينما لم يبدِ الزيت الطيار أي تأثير مثبط على فطور المبيضة البيضاء Candida albicans. كما بينت دراسة أجراها Al-Saleem M. et al. 2018 أن الخلاصة الإيثانولية المائية 95% تملك تأثير مضاد لنمو العديد من السلالات الجرثومية سلبية الغرام، إيجابية الغرام والعديد من الفطور، بالإضافة لفعاليتها المثبطة للعديد من الخطوط الخلوية السرطانية، دون أن تظهر تأثيرات سمية. يهدف البحث إلى دراسة الأجزاء الهوائية لنبات القرقاص Tripleurospermum auriculatum النامي بشكل عفوي في مناطق ريف دمشق من الناحية الدراسة المجهرية والكيميائية وتحديد محتوى الفينولات الكلية والفلافونوئيدات الكلية والفعالية المضادة للأكسدة للخلاصة الميثانولية.
أهمية البحث Importance of the study:
تتميز سورية بحياة نباتية غنية ومتنوعة جداً وخاصة النباتات الطبية، وذلك بحكم موقعها الجغرافي الفريد ومناخها المتنوع. تحتوي هذه النباتات على مركبات كيميائية ذات أهمية علاجية، إلا أن معرفة هذه المواد الفعالة ذات التأثير البيولوجي لايزال يشغل علماء الصيدلة والكيمياء وعلوم الحياة، Chouma F. et al. 2017. كما أصبح تطوير واستخدام المزيد من مضادات الأكسدة الفعالة ذات الأصل النباتي أمراً في غاية الأهمية لدورها في كنس الجذور الحرة، وبالتالي الحد من تأثيراتها الضارة على الخلايا، من بين هذه المركبات النباتية تحظى المركبات الفينولية باهتمام كبير كعوامل محتملة لمنع وعلاج العديد من الأمراض المرتبطة بالإجهاد التأكسدي Konan Y. et al. 2014. يعتبر نبات القرقاص Tripleurospermum auriculatum من النباتات البرية المنتشرة على نطاق واسع في مدينة ريف دمشق، وعلى الرغم من ذلك قلما تناولته الأبحاث بالدراسة وتسليط الضوء على مكوناته الفعالة ومعايرتها وفصلها ودراسة تأثيراتها البيولوجية. تعتبر دراستنا الحالية خطوة أولى من الدراسات المطلوب إجراؤها على هذا النبات لتقييم محتواه من المكونات الفعالة وتأثيراتها وإمكانية الاستفادة منها.
الهدف من البحث Aim of the study:
- دراسة مجهرية للأجزاء الهوائية لنبات القرقاص Tripleurospermum auriculatum وتحديد البنى النسيجية الخاصة بمسحوق العقار.
- دراسة كيميائية لمسحوق العقار بهدف تحري لبعض المكونات الفعالة من خلال تطبيق التفاعلات الكيميائية الوصفية لها.
- تحضير خلاصة ميثانولية لمسحوق العقار وتحديد مردود الاستخلاص.
- تحديد الفينولات الكلية في النبات المدروس.
- تحديد الفلافونوئيدات الكلية في النبات المدروس.
- تقدير النشاط المضاد للأكسدة في النبات المدروس.
المواد وطرق التحليل Materials and Methods:
-1 المواد النباتية: تم جمع الأجزاء الهوائية لنبات القرقاص Tripleurospermum auriculatum الشكل 2، من ريف دمشق ثم جففت في الهواء في مكان ظليل في درجة حرارة الغرفة حتى تمام الجفاف من ثم طحنت للحصول على مسحوق ناعم.
-2 المواد الكيميائية Chemicals Materials:
كاشف DPPH (2,2 Diphenyl-1- picrylhydrazyl) إنتاج شركةTCI (Tokoy chemical industry ) Japan كاشف فولين سيوكالتو Folin-Ciocalteu إنتاج شركة Merck, Germany، غاليك أسيد Gallic acid، فيتامين C إنتاج شركة Prolabo. كلوريد الألمنيوم Aluminum chloride إنتاج شركة Honey well, Germany، كحول ميثيلي مطلق – كحول إيثيلي مطلق إنتاج شركة Honey well Germany، جهاز الامتصاص اللوني spectrophotometerمصنع من قبل شركة Phylo مجهر ضوئي مصنع من قبل شركة Optika, Italy، ميزان حساس مصنع من قبل شركة Sartorius، Germany.

-3الدراسة المجهرية Microscopical study:
دُرس مسحوق الأجزاء الهوائية للنبات باستخدام المجهر الضوئي في وسط الكلورال هيدرات الغليسيريني مع التسخين.
-4فحوص الكشف عن المكونات الفعالة Determination of chemical constituents:
أجريت التفاعلات اللونية للكشف عن الزمر الكيميائية الأساسية على مسحوق النبات حسب الطريقة المعتمدة في كتاب كيمياء العقاقير والاستخلاص )النوري أ. س، حسن آغا م.ع. وآخرون. 2008) وكتابtext book of pharmacognosy and phytochemistry (Shah B. et al; 2010) تم الكشف على كل من: الفلافونويدات، الصابونينات، الأنتراكينونات، التانينات، القلويدات.
-5 تحضير الخلاصة الميثانولية:
وزن 2 غرام من مسحوق الأجزاء الهوائية لنبات القرقاص (المجفف بالظل والمطحون)، وتم استخلاصها مرتين بـ 20 مل ميثانول ولمدة ربع ساعة في كل مرة بجهاز الآلتراسونيك بدرجة حرارة40 م، رشحت الخلاصات ثم جمعت وجففت وتم وزنها بعد التجفيف.
-6 تعيين الفينولات الكلية Determination of total phenols: (Kitaz; A 2017)
المبدأ: تستعمل طريقة فولين- سيوكالتو لتعيين الفينولات الكلية، حيث تُرجع الفينولات حمض فسفوموليبدات التنغستين في وسط قلوي فينتج عنه محلول أزرق اللون يقاس امتصاصه عند طول موجة 765 نانومتر، حيث تحدث سلسلة من تفاعلات الإرجاع بانتقال إلكترون أو اثنين من الفينولات تؤدي إلى تكوين معقدات زرقاء اللون تضم الأنيون (PMoW11O40)4-.
طريقة العمل:
أولاً: تحضير المحاليل Solution preparation
محلول كربونات الصوديوم %20: أذيب 20 غرام من كربونات الصوديوم اللامائية في 80 مل من الماء في بيشر، سخن حتى الغليان وبرد، أضيف إليه بضع بلورات من كربونات الصوديوم، رشح بعد 24 ساعة ونقل إلى بالون معايرة سعة100 مل ثم تمم الحجم بالماء المقطر حتى الإشارة.
تحضير محاليل عيارية لحمض الغاليك في الماء:
تم تحضير سلسلة عيارية لحمض الغاليك بالتراكيز التالية: (500, 250, 200, 150, 100, 50, 0) ملغ/ لتر وفق ما يلي:
تحضير محلول عياري أمّ ذي التركيز 5000 ملغ/ لتر: وذلك بإذابة 0.25 غ من حمض الغاليك الجاف في 5 مل ايثانول ويكمل الحجم بالماء المقطر حتى 50 مل في بالون معايرة.
تحضير السلسلة العيارية: بأخذ حجوم متزايدة من المحلول العياري السابق وهي (0، 0.5، 1، 1.5، 2، 2.5، 5) مل ونقلها إلى بالون معايرة سعة 50 مل والتمديد حتى الإشارة بالماء المقطر.
تحضير الخلاصة النباتية:
تم تحضير محلول الخلاصة النباتية بتركيز 1 ملغ/ لتر وذلك بحل 5ملغ من الخلاصة النباتية الجافة في 5 مل ميثانول.
ثانياً: خطوات العمل:
وضع 20 مكرولتر من العينة مع 1.58 مل ماء مقطر و300 مكرولتر كربونات الصوديوم %20) وزن/ حجم) مزجت جيداً ثم تركت مدة 8 دقائق و 30 ثانية ثم أضيف 100 مكرولتر كاشف فولين سيوكالتو، مزجت جيداً ثم تركت في مكان مظلم في درجة حرارة الغرفة مدة 45 دقيقة. قيست الامتصاصية عند موجة طولها 765 نانومتر مقارنةً بعينة شاهدة (ماء مقطر) باستعمال مقياس الطيف الضوئي spectrophotometer عُينت الفينولات الكلية بدلالة منحنى عياري خطي لحمض الغاليك Gallic acid في الميثانول بتراكيز من 0 إلى 500 ملغ/ لتر، وقدرت النتائج بمكافئات من حمض الغاليك لكل 1 غ من النبات الجاف. تم تعيين القيمة الوسطية للامتصاصية لثلاثة مكرارات.
-7تحديد الفلافونوئيدات الكلية: Determination of total flavonoids (Abdeltaif S. et al; 2018)
المبدأ: تستعمل طريقة ثلاثي كلوريد الألمنيوم (AlCl3)، حيث تتشكل معقدات ثابتة ناتجة عن تفاعل ثلاثي كلوريد الألمنيوم مع المجموعة الكيتونية في الموقع 4 ومجموعة هيدروكسيل في الموقع 3 و 5 للفلافونات والفلافونولات، وتتشكل أيضاً معقدات غير ثابتة مع مجموعتي اورثو هيدروكسيل الموجودة على الحلقة A- أو الحلقة B- للفلافونوئيدات. (Kumar P. et al; 2013)
طريقة العمل:
أولاً: تحضير المحاليل Solution preparation
محلول كلوريد الألمنيوم: %2 أذيب 2 غ من كلوريد الألمنيوم في قليل من الميثانول في بيشر، ونُقل إلى بالون معايرة سعة 100 مل ثم تمم الحجم بالميثانول حتى الإشارة.
محاليل عيارية للكيرستين في الميثانول:
تم تحضير سلسلة عيارية للكيرستين بتراكيز (0، 5، 10، 20، 30، 40) ملغ/ لتر وفق ما يلي: تحضير محلول عياري أمّ ذي التركيز 5000 ملغ/ لتر: وذلك بإذابة 0.25 غ من الكيرستين الجاف في 5مل ميثانول ويكمل الحجم حتى 50 مل في بالون معايرة. تحضير السلسلة العيارية: بأخذ حجوم متزايدة من المحلول العياري السابق وهي (0، 0.05، 0.1، 0.2، 0.3، 0.4) مل ونقلها إلى بالون معايرة سعة 50 مل والتمديد حتى الإشارة بالميثانول.
الشاهد: الميثانول.
تحضير الخلاصة النباتية:
تم تحضير محلول الخلاصة النباتية بتركيز 1 ملغ/ مل وذلك بحل 5 ملغ من الخلاصة النباتية الجافة في 5مل ميثانول.
ثانياً: خطوات العمل:
وُضع 1 مل من العينة مع 1 مل ثلاثي كلوريد الألمنيوم 2% في الميثانول، مزجت جيداً ثم تركت في مكان مظلم درجة حرارة الغرفة مدة 30 دقيقة، قيست الامتصاصية عند طول موجة 425 نانومتر عُينت الفلافونوئيدات الكلية بدلالة منحنى عياري خطي للكيرستين Quercetin في الميثانول بتراكيز عديدة من (0 إلى 40) ملغ/ لتر، وقدرت النتائج بمكافئات من الكيرستين لكل1 غ من النبات الجاف، تم تعيين القيمة الوسطية للامتصاصية لثلاثة مكرارات.
-8 تحديد الفعالية المضادة للأكسدة Determination of antioxidant activity:
(Kadaikunnan S. et al; 2015)
المبدأ: تم قياس قدرة الخلاصات النباتية المضادة للأكسدة بقياس قدرتها على إزالة الجذور الحرة للجذر الثابت DPPH اعتماداً على طريقة يو وزملائه. يتم تقييم القدرة المضادة للأكسدة عبر معيار IC50: وهو تركيز الخلاصة الذي يحقق تثبيط للجذور الحرة بنسبة%50 ويتم حسابه بيانياً من المخطط البياني لسلسلة تراكيز الخلاصة. إن القيم المنخفضة للـ 50 % تدل على القدرة العالية للخلاصة على تثبيط الجذور الحرة للـ DPPH.
طريقة العمل:
تحضير المحاليل Solution preparation
تحضير محلول DPPH بتركيز 4.5) غ100 / مل(:
يحضر حديثاً حين إجراء الاختبار في الظلام: يحضر بإذابة 4.5 ملغ من كاشف للـ DPPH بقليل من الايثانول، ونقله إلى بالون معايرة سعة 100 مل ثم إكمال الحجم بالايثانول حتى الإشارة.
تحضير محاليل معيارية لفيتامين سي في الايثانول:
تم تحضير سلسلة عيارية لفيتامين سي بتراكيز (0.0093، 0.0186، 0.035، 0.0536، 0.07، 0.175) ملغ/ مل وفق ما يلي: تحضير محلول عياري أمّ ذي التركيز 0.7 ملغ/ مل: وذلك بإذابة 35 ملغ من فيتامين سي الجاف في 5 مل ايثانول ويكمل الحجم بالايثانول حتى 50 مل في بالون معايرة. تحضير السلسلة العيارية: بأخذ حجوم متزايدة من المحلول العياري السابق وهي: (4، 8، 15، 23، 30، 75) مكرولتر ونقلها إلى الأنبوب المحضر للقياس والتمديد حتى 300 مكرولتر بالايثانول. تحضير أنبوب الشاهد بإضافة 300 مكرولتر من الايثانول.
تحضير الخلاصة النباتية:
تم تحضير سلسلة تراكيز من الخلاصة الميثانولية لنبات القرقاص بتراكيز: (0.187، 0.375، 0.75، 1.5) ملغ/ مل. تحضير الأنبوب الأول في السلسلة: وذلك بحل 0.003 غ من الخلاصة الميثانولية الجافة في 2 مل ايثانول. تحضير أنابيب السلسلة: وبالتمديد بنسبة %50 نحصل على بقية تراكيز السلسلة حيث: نضع في كل أنبوب 1 مل ايثانول، نأخذ من الأنبوب الأول 1 مل ونضيفها للأنبوب الثاني، ثم نأخذ 1 مل من الأنبوب الثاني ونضيفها للأنبوب الثالث ونكرر نفس العملية حتى الأنبوب الأخير.
ثانيا ً: خطوات العمل:
وضع 300مكرولتر من المحاليل المحضرة (أنابيب سلسلة فيتامين C، وأنابيب سلسلة الخلاصة النباتية) في أنبوب اختبار، ثم أُضيف إلى كل أنبوب 3 مل من محلول DPPH ) 2,2-diphenyl-1-picrylhydrazyl في الايثانول) 45 مكروغرام/ مل، وُضعت الأنابيب بعد التحريك في مكان مظلم في درجة حرارة الغرفة مدة 30 دقيقة، ثم قيست الامتصاصية باستعمال جهاز مقياس الطيف الضوئي spectrophotometer عند طول الموجة 517 نانومتر. عرضت النتائج مقارنة بالسلسلة العيارية للفيتامين C بتراكيز بين 0.009 و 0.175 ملغ/ مل كمركب مرجعي لاختبار كنس الجذور الحرة بسبب قدرته الإرجاعية الكبيرة، واستُعمل القانون التالي لحساب قدرة الخلاصات على تثبيط الجذور الحرة:
x 100 [(Ab-Aa) / Ab] = DPPH %
حيث: Aa امتصاصية العينة، Ab امتصاصية العينة الشاهدة (الايثانول+ DPPH)
النتائج Results:
الدراسة المجهرية:
يحتوي مسحوق الأجزاء الهوائية لنبات القرقاص Tripleurospermum auriculatum العناصر المجهرية التالية:
* نسيج يخضوري مع أوبار لامسة طويلة وحيدة الخلية ومنحنية الشكل 3.
* وبرة لامسة طويلة متشعبة الشكل 4.
* وبرة مفرزة الشكل 5.
* الزهرة الأنبوبية الكاملة الشكل 6.
* رأس البتلة الشكل 7.
* قلم وميسم ذو فرعين ينتهي بحليمات رأسية تشبه أصابع اليد الشكل 8.
* حبات طلع صغيرة كروية تمتاز بجدارها المشوك وذات ثلاثة ثقوب انتاش الشكل 9.
* قطعة من بشرة القنابة الخارجية مع أوعية خشبية حلزونية الشكل 10.
* الطبقة الليفية الشبكية المبطنة للكيس الطلعي الشكل 11.
فحوص الكشف عن المكونات الفعالة Detection of the chemical constituents:
-1 الكشف عن القلويدات بتفاعلات الترسيب:
أعطت تفاعلات الترسيب نتائج سلبية: حيث لم يتشكل رواسب باللون المحدد مع كلٍ من الكواشف: دراجندروف – ماير- فاغنر- حمض المر.
-2 الكشف عن الفلافونوئيدات:
* تفاعل لوني حسب شينودا Shinoda: نتيجة التفاعل إيجابية، حيث تشكل لون أحمر ثابت بعد إضافة مسحوق المغنزيوم وحمض الهيدروكلوريك الكثيف.
* التفاعل مع محلول كلوريد الألمنيوم: نتيجة التفاعل إيجابية، ظهر لون أصفر عند إضافة محلول كلوريد الألمنيوم للخلاصة.
* تفاعل لوني حسب ويلسون – تابوك Wilson-Taubock: نتيجة التفاعل إيجابية، تألق الراسب بعد حله بمحلول الإيثر بلون أخضر مصفر بالأشعة فوق البنفسجية 365 نانومتر.
-3الكشف عن المواد العفصية:
* التفاعل مع فوق كلور الحديد: نتيجة التفاعل إيجابية، تشكل لون أخضر غامق انقلب إلى الأسود.
* التفاعل مع خلات الرصاص: نتيجة التفاعل إيجابية، تشكل راسب بلون بني برتقالي.
-4 الكشف عن الانتراكينونات:
تفاعل بورنتريغر Borntrager:
* كشف المشتقات الأنتراكينونية الحرة: نتيجة التفاعل سلبية، لم تتلون طبقة البنزن باللون الوردي (حتى بعد التسخين لم يظهر لون وردي أو أحمر).
* كشف المشتقات الأنتراكينونية بشكل غليكوزيدي: نتيجة التفاعل سلبية، لم تتلون طبقة البنزن باللون الوردي.
-5 الكشف عن الصابونينات:
تجربة حدوث الرغوة: نتيجة التفاعل سلبية، لم يتشكل عمود من الرغوة بعد الرج بشدة لمدة عشر ثوان.
ويبين الجدول 1، التفاعلات المطبقة لتحري المكونات الفعالة في المسحوق المدروس ونتائجها.
تحديد الفينولات الكلية Determination of total phenols:
يبين الجدول 2 متوسط قيم الامتصاصية لمحاليل السلسلة لحمض الغاليك. رسمت قيم الامتصاص مقابل تراكيز السلسلة العيارية لحمض الغاليك.


يوضح الشكل 12 منحنى المعايرة القياسي لمحاليل حمض الغاليك مقدراً بوحدة ملغ/ لتر مقابل الامتصاص عند موجة طولها 765 نانومتر ومثلت خطاً مستقيماً.
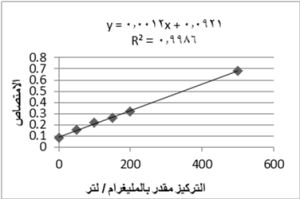
استنتجت منه المعادلة التي تربط الامتصاصية بالتركيز. يحسب التركيز من المعادلة التي تربط الامتصاص بالتركيز
Y = 0.001X + 0.092
حيث: Y: الامتصاص.
X: التركيز مقدراً بالمليغرام/ لتر
يبين الجدول 3 قراءات الامتصاصية للأنابيب الثلاثة للخلاصة الميتانولية للأجزاء الهوائية لنبات القرقاص وبالاعتماد على المعادلة السابقة التي تربط الامتصاص بالتركيز تم حساب التراكيز في الأنابيب الثلاثة مقدراً بوحدة ملغ/ لتر، ومن ثم حساب تركيز الفينولات في الخلاصة الميثانولية الجافة مقدرة بالمليغرامات المكافئة لحمض الغاليك في 1 غ من الخلاصة الجافة بتطبيق القانون:
Y = C × V /W
حيث: Y: تركيز الفينولات في الخلاصة الجافة (مقدرة بالمليغرامات المكافئة لحمض الغاليك في 1 غ من الخلاصة الجافة).
C: تركيز المستخلصات من الإسقاط على المنحنى المعياري مقدراً بوحدة ملغ/ مل.
V: حجم المستخلص مقدراً بالمليلتر (حجم المستخلص المستعمل في المعايرة 5 مل)
W: وزن العينة المأخوذة بالغرام (0.005 غ)
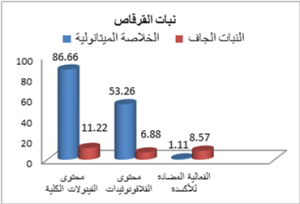
وبضرب تركيز الفينولات في الخلاصة الجافة بمردود الاستخلاص (حيث كان وزن الخلاصة الميثانولية الجافة 0.259 غرام حصلنا عليها من استخلاص 2 غ من مسحوق النبات وبالتالي بلغت قيمة مردود الاستخلاص %12.95) نحصل على محتوى الفينولات الكلي في 1 غ من النبات الجاف مقدرة بالمليغرام مكافئ حمض الغاليك. وبالتالي يكون متوسط محتوى نبات القرقاص Tripleurospermum auriculatum من الفينولات الكلية مقدرة بوحدة ملغ مكافئ حمض الغاليك في غرام من النبات الجاف 11.22 ملغ/ غ بانحراف معياري 0.84.
تحديد الفلافونوئيدات الكلية Determination of total flavonoids:
يبين الجدول رقم (4) قيم الامتصاصية للمحلول العياري المحضر من الكيرستين. يوضح الشكل 13 منحنى المعايرة القياسي لمحاليل الكيرسيتين مقدراً بوحدة ملغ/ لتر مقابل الامتصاص عند الطول الموجة 425 نانومتر ومثلت خطاً مستقيماً. استنتجت منه المعادلة التي تربط الامتصاصية بالتركيز، واعتمد عليها في حساب المحتوى الفلافونوئيدي الكلي في العينة النباتية.
Y = 0.035X + 0.017
حيث: Y: الامتصاص.
X: التركيز مقدراً بالمليغرام/ لتر.


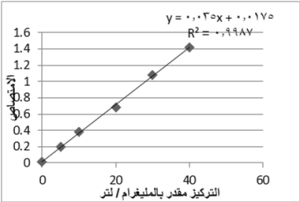
الشكل 13: منحنى المعايرة القياسي لمحاليل الكيرستين
يبين الجدول 5 قراءات الامتصاصية للأنابيب الثلاثة للخلاصة الميثانولية للأجزاء الهوائية لنبات القرقاص وبالاعتماد على المعادلة السابقة التي تربط الامتصاص بالتركيز تم حساب التراكيز في الأنابيب الثلاثة مقدراً بوحدة ملغ/ لتر، ومن ثم حساب المحتوى الفلافونوئيدي الكلي في الخلاصة الميتانولية الجافة مقدرة بالميليغرامات المكافئة لحمض الغاليك في 1 غ من
الخلاصة الجافة بتطبيق القانون:
Y = C × V /W
حيث: Y: تركيز الفلافونوئيدات في الخلاصة الجافة (مقدرة بالميليغرامات المكافئة للكيرستين في 1 غ من الخلاصة الجافة).
C: تركيز المستخلصات من الإسقاط على المنحنى المعياري مقدراً بوحدة ملغ/ مل.
V: حجم المستخلص مقدراً بالمليلتر (حجم المستخلص المستعمل في المعايرة 5 مل)
W: وزن العينة المأخوذة ب غ (0.005 غ)
وبضرب تركيز الفلافونوئيدات في الخلاصة الجافة بمردود الاستخلاص نحصل على محتوى الفلافونوئيدات الكلية في 1غ من النبات الجاف مقدرة بوحدة ملغ مكافئ كيرستين. وبالتالي يكون متوسط محتوى نبات القرقاص من الفلافونوئيدات الكلية مقدرة بالمليغرام مكافئ كيرستين في غرام من النبات الجاف 6.88 ملغ/غ بانحراف معياري 0.10.
دراسة الفعالية المضادة للأكسدة بتطبيق اختبار DPPH:
يبين الجدول 6 نتائج اختبار القدرة المضادة للأكسدة من خلال تثبيط DPPH باستخدام فيتامين سي كمركب عياري. كما يوضح الشكل 14 أن النسبة المئوية للتثبيط تزداد بزيادة التركيز. استنتجت منه المعادلة التي تربط النسبة المئوية % لتثبيط DPPH بالتركيز مقدراً بوحدة ملغ/ مل، واعتمد عليها في حساب التركيز من فيتامين C المثبط النصفي لمحلول (IC50) DPPH Y = 1338X + 2.655
حيث: Y: النسبة المئوية لتثبيط DPPH %.
X: التركيز مقدراً بوحدة ملغ/ مل.
وبالتالي يكون تركيز فيتامين C المثبط النصفي لمحلول 0.035 (IC50) DPPH ملغ/ مل أي 35.3 مكروغرام/ مل.

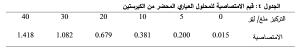
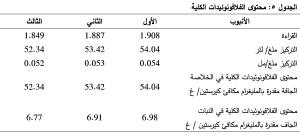
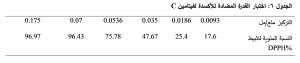
القدرة المضادة للأكسدة لنبات القرقاص auriculatum Tripleurospermum:
يبين الجدول 7 نتائج اختبار القدرة المضادة للأكسدة لسلسلة التراكيز المحضرة من الخلاصة الميتانولية لنبات القرقاص من خلال تثبيط DPPH. كما يوضح الشكل 15 أن النسبة المئوية للتثبيط تزداد بزيادة التركيز. وبالتالي يكون تركيز الخلاصة الميثانولية لنبات القرقاصauriculatum Tripleurospermum المثبط النصفي لمحلول (IC50) DPPH 1.11 ملغ/ مل أي 8.57 ملغ/ مل من النبات الجاف.
المناقشة Discussion
-1 الدراسة المجهرية: تبين احتواء مسحوق الأجزاء الهوائية لنبات القرقاص auriculatum Tripleurospermum على عناصر مجهرية مميزة لمساحيق الأزهار المنتمية للفصيلة النجمية Asteraceae مثل: الزهرة الأنبوبية الكاملة – رأس البتلة – قلم وميسم ذو فرعين ينتهي بحليمات رأسية تشبه أصابع اليد – حبات طلع صغيرة كروية تمتاز بجدارها المشوك وذات ثلاثة ثقوب انتاش – قطعة من بشرة القنابة الخارجية مع أوعية خشبية حلزونية – الطبقة الليفية الشبكية المبطنة للكيس الطلعي. وتمييز المسحوق باحتوائه على عناصر مميزة من أوبار لامسة طويلة وحيدة الخلية ومنحنية إضافة ً للأوبار اللامسة الطويلة المتشعبة.
2- فحوص الكشف عن المكونات الفعالة: تبين من نتائج التفاعلات الكيميائية المطبقة على خلاصات المسحوق احتوائه على الزمر الكيميائية التالية: الفلافونوئيدات والمواد العفصية، في حين كانت نتائج تفاعلات الكشف عن الأنتراكينونات، الصابونينات والقلويدات سلبية.
-3 مردود الاستخلاص: بلغت قيمة مردود الاستخلاص %12.95 والذي يعتمد بصورة رئيسة على نوع السائل الاستخلاصي وطريقة الاستخلاص.
4- تحديد الفينولات الكلية: بلغ متوسط تركيز الفينولات في الخلاصة الميثانولية الجافة مقدراً بالمليغرامات المكافئة لحمض الغاليك في 1 غ من الخلاصة الجافة 86.66 ملغ/ غ بانحراف
معياري 6.5. في حين بلغ متوسط تركيز الفينولات في مسحوق النبات الجاف مقدراً بالمليغرامات المكافئة لحمض الغاليك في 1 غ من النبات الجاف 11.22 ملغ/ غ بانحراف معياري 0.84.
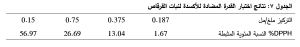

-5 تحديد الفلافونوئيدات الكلية: بلغ متوسط محتوى الفلافونوئيدات الكلية في الخلاصة الميثانولية الجافة مقدرة بالمليغرام مكافئ كيرستين/ غ 53.26 ملغ/ غ بانحراف معياري 0.86. في حين بلغ متوسط محتوى الفلافونوئيدات الكلية في مسحوق النبات الجاف مقدراً بالمليغرام مكافئ كيرستين/ غ 6.88 ملغ/ غ بانحراف معياري 0.10. وبالتالي تشكل الفلافونوئيات حوالي %61.3 من مجمل الفينولات الكلية الموجودة في الأجزاء الهوائية لنبات القرقاص Tripleuro-spermum auriculatum المستخلصة بمحل الميثانول.
6- دراسة الفعالية المضادة للأكسدة بتطبيق اختبار DPPH:
بلغ تركيز فيتامين C المثبط النصفي لمحلول 0.035 (IC50)DPPH ملغ/ مل بينما بلغ تركيز الخلاصة الميثانولية لنبات القرقاص auriculatum Tripleurospermum المثبط النصفي لمحلول (IC50) DPPH 1.11 ملغ/ مل أي 8.57 ملغ/ مل من النبات الجاف وبالتالي تكون قيمة التركيز المثبط النصفي للخلاصة الميثانولية للنبات أكبر بحوالي 31 مرة بالمقارنة مع قيمة التركيز المثبط النصفي لفيتامين C. وبمقارنة التركيز المثبط النصفي للخلاصة الميثانولية للنبات مع التركيز المثبط النصفي لمسحوق النبات الجاف تبين أن التركيز المثبط النصفي لمسحوق العقار الجاف أكبر بحوالي 7.7 من التركيز المثبط النصفي للخلاصة الميثانولية. ويبين الجدول 8 النتائج التي حصلنا عليها من مردود الاستخلاص للنبات المدروس ومقارنة بين الخلاصة الميثانولية ومسحوق العقار الجاف من حيث: متوسط محتوى الفينولات، متوسط محتوى الفلافونوئيدات الكلية والتركيز المثبط النصفي. وقد مثلت النتائج السابقة في الشكل 16.
الاستنتاجات Conclusions
يعتبر نبات القرقاص Tripleurospermum auriculatum من النباتات المحلية النامية بصورة عفوية في مناطق من ريف دمشق، وقد أظهرت الدراسة تميز مسحوق الأجزاء الهوائية باحتوائه على أوبار لامسة طويلة وحيدة الخلية وأوبار لامسة طويلة متشعبة إضافةً إلى الأجزاء الزهرية المختلفة. كما احتوى النبات على مركبات فينولية تشكل الفلافونوئيدات نسبة كبيرة منها إضافة ً إلى احتوائه على مركبات عفصية. وأوضحت المعايرات احتواء الخلاصة الميثانولية للنبات على محتوى متوسط من المركبات الفينولية والفلافونوئيدية وامتلاكها لقدرة مضادة للأكسدة وبالتالي تأثير مثبط نصفي لمحلول (IC50) DPPHمتوسط بالمقارنة مع فيتامين C. كما نلاحظ انخفاض تركيز الفينولات في مسحوق النبات الجاف بشكل ملحوظ بالمقارنة مع تركيزها في الخلاصة الميثانولية ويعود ذلك إلى مردود الاستخلاص المتعلق بنوعية المذيب وطريقة الاستخلاص.
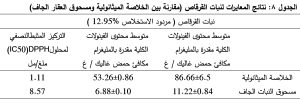
التوصيات Recommendation
- إجراء خلاصات نباتية لنبات القرقاص Tripleurospermum auriculatumبمحاليل كيمائية مختلفة والمقارنة فيما بينها لمعرفة المحلول ذو المردود الأعلى من المركبات الفينولية.
- دراسة مسحوق الأوراق والأزهار كل ٍعلى حدة والمقارنة بمحتواها من المركبات الفينولية والفلافونوئيدية والقدرة المضادة للأكسدة.
- دراسة لعينات نباتية لنبات القرقاص Tripleurospermum auriculatum مجموعة من مناطق مختلفة ودراسة تأثير الظروف البيئية على محتواها من المواد الفعالة.
- دراسة إمكانية فصل المركبات الفلافونوئيدية الموجودة في النبات باستخدام طرائق الكروماتوغرافية ومقارنتها بعينات قياسية للتعرف على أنواع الفلافونوئيدات الموجودة في النبات وتحديد نسبها.
– الحسن ح. النباتات البرية في مراعي شمال المملكة العربية السعودية – دليل حقلي مصور، مركز أبحاث الإبل والمراعي في الجوف التابع لوزارة الزراعة 2007.
2- السعيد م؛ حسن آغا م.ع؛ اليحيى م؛ وعمرين ع. ن. علم العقاقير ل تريز وإيفانز، ص: 76، المركز العربي للتعريب والترجمة والتأليف والنشر بدمشق 2003.
3- النوري أ. س؛ حسن آغا م.ع؛ وحواصلي ه. علم العقاقير كيمياء العقاقير 2، الجزء العملي، ص:68-67-58-5773-74-75-94-95-130-131-، منشورات جامعة دمشق 2008-2009 1-Abdeltaif S; SirElkhatim K. and Hassan A. Estimation of Phenolic and Flavonoid Compounds and Antioxidant Activity of Spent Coffee and Black Tea (Processing) Waste for Potential Recovery and Reuse in Sudan. Multidisciplinary Digital Publishing Institue. p: 3, 2018.
2-Albalaw M. and Eldiasty J. Chemical and Biological Characteristics of Essential Oil Isolated from Fresh Flower of Tripleurospermum auriculatum Indian journal of research. septemper, 5, 91, 171, 2016.
3-Al-Saleem M; Awaad A; Alothman M. and Alqasoumi S. Phytochemical standardization and biological activities of certain desert plants growing in Saudi Arabia. Saudi Pharmaceutical Journal. 26, 198, 2018.
4-Chouma F. and Hussam Aldeen S. Determination of total content of flavonoids in dried and fresh hawthorn leaves and flowers. Tishreen University Journal for Research and Scientific Studies. 39, 6, 140, 2017.
5-Erdogan TF; Gonenc TM. and Oskay M. Antimicrobial and cytotoxic activities of tripleurospermum parviflorum (willd.) pobed. Mamara Pharmaceutical journal, volume 17, 1, 2013.
6-Inceer H; Garnatje T; Hayõrlõoğlu-Ayaz S; Pascual-DõÂaz J; Vallès J. and Garcia S. A genome size and phylogenetic survey of Mediterranean Tripleurospermum and Matricaria (Anthemideae, Asteraceae). PLOS ONE, Journal. Pone, P: 1, 2018.
7-Kadaikunnan S; Rejiniemon T; Alharbi1 N; Khaled J. and Agastian P. Identification and Quantification Ofphenolic Compounds from Trigonella Foenum Graecum L. and its In-Vitro Antioxidant. Anticancer and Antimicrobial Activities. Fresenius Environmental Bulletin. 24, 2643. 2015.
8-Kitaz A. Comparison of the Total Phenol, Flavonoid Contents and Antioxidant Activity of Methanolic Roots Extracts of Asphodelusmicrocarpus and Asphodelinelutea Growing in Syria. International Journal of Pharmacognosy and Phytochemical Research. 160. 2017.
9-Konan Y; Witabouna K; Bassirou B. and Kagoyire K. Antioxidant activity and total phenolic content of nine plants from Côte d’Ivoire (West Africa). Journal of Applied Pharmaceutical Science. 4, 08, 36-41, 2014.
10-Kumar P.T; Kalita P; Barman TK; Chatterjee TK. and Maity S. Quantification of Total Flavonoid Content and antioxidant activity in comparison to a reference flavonoid as in vitro quality evaluation parameter for assessing bioactivity of biomarkers in herbal extracts or formulations JPR. Bio. Med. Rx: An International Journal 1, 8, 759, 2013.
11-Shah B. and Seth A.K. Textbook of Pharmacognosy and Phytochemistry First Edition 2010, ELSEVIER A divison of Reed Elsevier India Private Limited.