تعيين محتوى حمض الحماض في السبانخ والبقدونس باستخدام تقنية الاشتقاق الكيميائي المطورة حديثاً
2021-10-01 | المجلد السادس العدد الثامن - المجلد السادس | Uncategorizedآلاء الشيخ محمد | جمعة الزهوري
الملخص
تم تطبيق طريقة طيفية جديدة مطورة تتميز بالبساطة، الحساسية، المضبوطية، والنوعية في مقايسة حمض الحماض على عينات من السبانخ والبقدونس، اعتمدت هذه الطريقة على الاشتقاق الكيميائي وتتضمن هذه العملية تفاعل الوظيفة الكربوكسيلية في حمض الحماض مع نتريت الصوديوم لتشكيل حمض النتروز الضروري لعملية الديأزة والذي بدوره يعطي بوجود السلفاناميد والألفا نفتيل أمين صباغاً دي آزوياً يملك امتصاصاً أعظمياً في المجال المرئي لمقياس الطيف الضوئي عند موجة طولها 482 نم. تم تحديد تأثير زمن التفاعل وحجم وتركيز الكاشف على امتصاص الصباغ المتشكل وأمكن تطبيق قانون لامبير-بيير للتراكيز (2-48) مكغ/ مل وكان معامل الارتباط قدره R2= 0.9972، وتم تحديد الدقة فكان RSD 2% والمضبوطية حيث بلغت قيمة الاستعادة 99.66%. وقد تمت مقايسة محتوى حمض الحماض الكلي للسبانخ والبقدونس حجمياً بواسطة برمنغنات البوتاسيوم من أجل المقارنة والتأكد من تحديد الكمية لحمض الحماض، وقد كان التركيز في كل من السبانخ والبقدونس على التوالي: 477.3 ملغ/ 100 غ، 1360.6 ملغ/ 100 غ.
كلمات مفتاحية : حمض الحماض oxalic acid، الاشتقاق الكيميائي chemical derivatization، مقياس الطيف الضوئي spectrophotometr، ألفا نفتيل أمين α-naphthylamine.
المقدمة Introduction
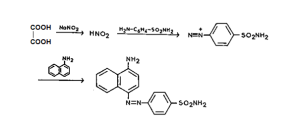
حمض الحماض C2H2O4 هو أحد الأحماض العضوية التي تعمل كمضاد للمغذيات الموجودة في معظم الخضروات بكميات مختلفة، الشكل 1 (1)، تم العثور عليه كأملاح غير قابلة للذوبان مع الكاتيونات ثنائية التكافؤ والمعادن والعناصر النادرة (2). يتفاعل حمض الحماض مع الكالسيوم لترسيب حماضات الكالسيوم (3)، كما أن تراكمه في الجسم يمنع امتصاص الكالسيوم والاستفادة منه؛ مما يؤدي بدوره إلى اختلال توازن الكالسيوم والكساح وتلين العظام (4). كما أن وجود مستويات عالية من حمض الحماض في النظام الغذائي يمكن أن يؤدي إلى تهيج الجهاز الهضمي وتساهم في تشكيل حصيات الكلى، لذلك فإن الكشف عن محتوى حمض الحماض في الغذاء له أهمية كبيرة في الممارسة (5). هناك العديد من الطرق لتحديد محتوى حمض الحماض في الغذاء، وعلى الرغم من أن تعيين محتواه حجمياً بواسطة برمنغنات البوتاسيوم وهي أرخص طريقة، لكن هذه الطريقة التحليلية الكيميائية تستغرق وقتا طويلا (6). يوجد العديد من التقنيات التحليلية الأخرى مفيدة مثل الكروماتوغرافيا الغازية، الكروماتوغرافيا السائلة (7)، القياس الطيفي والتحفيزي للحقن بالتدفق)8) ،الكروماتوغرافيا بالاستبعاد (9)، والطرق الإنزيمية (10)، كل هذه الطرق تم تطويرها لمقايسة حمض الحماض أو الحماضات. ومع ذلك، هذه الطرق لا تخلو من بعض العيوب مثل التكلفة العالية وعدم توفر معداتها في معظم المخابر (11). يعد التحلیل الطیفي الضوئي في مجال الأشعة فوق البنفسجیة والمرئیة واحداً من أكثر الطرق شيوعاّ وأقدم طرق التحلیل، حیث أن معظم المواد یتم تحلیلھا بشكل مباشر أو بعد اشتقاقھا كیمیائیاً (12). فالاشتقاق الكیمیائي يلعب دوراً ھاماً في مجال التحالیل الصیدلانیة والطبیة الحیویة وھو یطبق في التحالیل الكمیة والكیفیة, ومن خلال ضبط الشروط المثلى لعملیة الاشتقاق الكیمیائي یمكن تطویر نواتج ملونة یمكن قیاس امتصاصھا في مجال الأشعة المرئیة باستخدام مقیاس الطیف الضوئيSpectrophotometer الذي یتمتع بمزایا عدیدة من أھمھا سھولة العمل، البساطة، الدقة والمضبوطیة، انخفاض التكلفة مقارنة بالطرق التحلیلیة الأخرى (12). يقدم هذا البحث دراسة حول إمكانية تحديد محتوى حمض الحماض في كل من السبانخ والبقدونس وذلك باستخدام طريقة الاشتقاق الكيميائي التي تتضمن تفاعل الوظيفة الكربوكسيلية في حمض الحماض مع نتريت الصوديوم لتشكيل حمض النتروز الضروري لعملية الديأزة والذي بدوره يعطي بوجود السلفاناميد والألفا نفتيل أمين صباغاً دي آزوياً الشكل 2، يمكن قراءة امتصاصه في المجال المرئي لمقياس الطيف الضوئي عند موجة 482 نانومتر، ومقارنة النتائج مع طرق سابقة (المقايسة الحجمية بواسطة برمنغنات البوتاسيوم) (13).
هدف الدراسة Aim of study:
تطبيق طريقة تحليلية جديدة، بسيطة وحساسة واستخدامها لتحديد محتوى حمض الحماض في العينات النباتية المتوافر فيها (السبانخ والبقدونس)، وذلك بعد اشتقاقه كيميائياً بواسطة عدة كواشف, خاصة وأن هذه الكواشف متوافرة وهي غير مكلفة ولا تحتاج الطريقة إلى إجراءات معقدة مثل التسخين أو إضافة وقاء أو وجود كوادر مختصة، كما أن الطريقة المقترحة تتم بواسطة مقياس الطيف الضوئي Spectrophotometer الأكثر تواجداً بين الأجهزة التحليلية، وبالتالي فإننا نستطيع اعتمادها كطريقة معدّة للاستخدام الروتيني لمقايسة حمض الحماض في العينات المتوافرة فيها ومقارنة هذه النتائج مع طريقة برمنغنات البوتاسيوم (AOAC1999) (14).
المواد والطرق Materials and Methods:
1-الأجهزة:
- مقياس الطيف الضوئي Spectrophotometer ثنائي الحزمة من نوع UV-VIS Cecil, Ce7200 إنتاج شركة CECIL intruments limited , Cambridge , UK
- ميزان حساس Analytical balance من نوع AX200 SHIMADZU (0001) غ.
- محافد كوارتز Quartz Cuvettes
- حمام مائي water bath (GFL labortechnik mbh type 1008)
- حوض أمواج فوق صوتية Ultrasonic bath من نوع Branson 200.
- مثفلة (Centrifugation machine) نوع (Heraeus chris) بسرعة قصوى 6000
- دورة/ دقيقة ونصف قطر 15 سم.
2- المواد:
- أوراق السبانخ: تم جمع أوراق السبانخ، ومن ثم تم تجفيفها، وحفظت في أوعية محكمة الإغلاق بعيدا عن الرطوبة.
- أوراق البقدونس: تم جمع أوراق البقدونس، ومن ثم تم تجفيفها، وحفظت في أوعية محكمة الإغلاق بعيداً عن الرطوبة.
- حمض الأكزاليك العياري: نقي بنسبة 99% (Sigma-Aldrich. Germany).
- أسيتون: نقي بنسبة 9% (Sigma-Aldrich. Germany).
- سلفاناميد: نقي بنسبة 99% (Sigma-Aldrich. Germany).
- ألفانفتالامين: نقي بنسبة 99% (Sigma-Aldrich. Germany).
- ماء مقطر Distilled water.
- حمض كلور الماء HCl (Needhammark,Sufflok England) التركيز 37%، الكثافة 18 غ/ سم3.
- هيدروكسيد الصوديوم NaOH (Pancreac, PRS) الوزن الجزيئي 40 غ/ مول.
- حمض الكبريت H2SO4 (Pancreac, SPAIN) النقاوة 99 %.
- برمنغنات البوتاسيوم KMnO4 (Pancreac, SPAIN).
- كلور الكالسيوم CaCl2 (EDEL-DE-HAEN).
- نتريت الصوديوم NaNo2 (Pancreac, PRS).
- هيدروكسيد الأمونيوم NH4OH (Pancreac, PRS).
3- طرق البحث:
3-1- تحضير العينة النباتية:
جمعت أوراق السبانخ والبقدونس من السوق المحلية, ثم تم تجفيفها في الظل بمكان جاف وجيد التهوية بدرجة حرارة 23-25م⁰ ولمدة شهر. ومن ثم حضر مسحوق أوراق السبانخ والبقدونس بطحنها في مطحنة كهربائية، وحفظ المساحيق في زجاجات محكمة الإغلاق، بعيدة عن الضوء وبحرارة المخبر إلى حين استعمالها.
3-2- تحضير المحلول العياري والكواشف:
- المحلول العياري من حمض الحماض: يتم وزن 100 ملغ من حمض الحماض بدقة، ثم تحل بقليل من الماء المقطر في بالون عياري سعة 100 مل ثم تمدد بنفس المحل حتى خط العيار، حيث نحصل على محلول تركيزه 1 ملغ/ مل.
- كاشف A 2% (سلفاناميد بالأسيتون 2%): يتم وزن 2 غ من السلفاناميد بدقة، ثم تحل بقليل من الأسيتون في بالون عياري سعة 100 مل، ثم تمدد بنفس المحل حتى خط العيار للحصول على محلول تركيزه 2 غ/ 100 مل.
- كاشف B 2% (نتريت الصوديوم بالماء 2%): يتم وزن 2 غ من نتريت الصوديوم بدقة، ثم تحل بقليل من الماء المقطر في بالون عياري سعة 100 مل ثم تمدد بنفس المحل حتى خط العيار للحصول على محلول تركيزه 2 غ/ 100 مل.
- كاشف C 2% (ألفا نفتيل أمين بالأسيتون 2%): يتم وزن 2 غ من الألفا نفتيل أمين بدقة، ثم تحل بقليل من الأسيتون في بالون عياري سعة 100مل، ثم تمدد بنفس المحل حتى خط العيار للحصول على محلول تركيزه 2 غ/ 100 مل.
3-3- تحضير السلسلة العيارية:
تم تحضير سلسلة عيارية من حمض الحماض بالتراكيز التالية: 2- 12 – 18 -24 – 28 – 32 – 40 -44 -48 مكغ/ مل بأخذ الحجوم الملائمة من محلول العمل ذو التركيز 1 ملغ/ مل، وتوضع في بوالين عيارية سعة كل منها 50 مل، ويضاف 100 µl من كاشف A و100 µl من كاشف B و 50 µl من كاشف C. يتم المزج بشكل جيد حيث يظهر اللون الأحمر البرتقالي, ثم يترك التفاعل لمدة 5 دقيقة ويكمل الحجم بواسطة الماء المقطر حتى خط العيار، ثم ترسم العلاقة بيانياً بين التركيز والامتصاص عند موجة طولها 482 نانومتر لتحديد معادلة المستقيم حيث تم الحصول على طول موجة الامتصاص الأعظمي للمركب المشتق بعد إجراء مسح طيفي له.
3-4- استخلاص ومعايرة حمض الحماض باستخدام برمنغنات البوتاسيوم (KMnO4) (14):
تم تحديد محتوى حمض الحماض في جميع العينات باتباع طريقة المعايرة باستخدام KMnO4 الموصوفة في AOAC، 1999. يوزن 1 غ من السبانخ (S4) ويضاف لها 20 مل من محلول حمض كلور الماء 0.1 M وتوضع في أنبوب ذي غطاء وتترك لمدة 30 دقيقة في حمام مائي بدرجة حرارة 80م مع التحريك من فترة لأخرى، ثم يرشح باستخدام ورق الترشيح، تتم إضافة 0.5 مل من محلول 5٪ كلور الكالسيوم إلى الرشاحة لترسيب حماضات الكالسيوم، ويتم فصل الراسب بالطرد المركزي عند 3500 دورة في الدقيقة لمدة 15 دقيقة، ويتم التخلص من المادة الطافية. يغسل راسب حماضات الكالسيوم باستخدام 2 مل من محلول 0.35 M من هيدروكسيد الأمونيوم ثم تذاب في محلول 0.5 M من حمض الكبريت. ثم تمت معايرة المحلول المذاب باستخدام برمنغنات البوتاسيوم 0.1 N عند درجة حرارة 60 م حتى يستمر اللون الوردي الباهت لمدة 30 ثانية على الأقل.
النتائج والمناقشة Results and Discussion
1- الاستخلاص Extraction:
تم استخدام حمض كلور الماء ذو التركيز 0.1 M نظامي الأكثر استخداما في العديد من الدراسات السابقة لذلك تم اختياره. كما تم ضبط العديد من العوامل التي تؤثر في الاستخلاص منها: زمن الاستخلاص وعدد مرات الاستخلاص وكمية المحل الاستخلاصي.
1-1 نتائج ضبط شروط الاستخلاص:
1-1-1- تحديد زمن الاستخلاص المناسب
لم يُعط الاستخلاص بزمن يتجاوز 30 دقيقة اختلافا يذكر في محتوى حمض الحماض، فقد أعطى الاستخلاص لمدة 30 دقيقة أعلى تركيز لحمض الحماض، لذلك اعتمد زمن الاستخلاص 30 دقيقة. تم إعادة عملية الاستخلاص على عينات البقدونس وكانت النتائج متوائمة مع النتائج التي حصلنا عليها مع السبانخ.

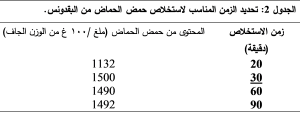
1-1-2- تحديد الحجم المناسب من (حمض كلور الماء 0.1 M) المستخدم في الاستخلاص:
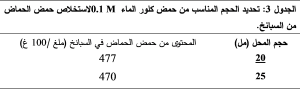
نستنتج مما سبق أن 20 مل من المحل كافية لإعطاء أعلى تركيز من حمض الحماض، لذلك اعتمدت الكمية المناسبة من المحل الاستخلاصي وهي 20 مل. تم إعادة عملية الاستخلاص على عينات البقدونس وكانت النتائج متوائمة مع النتائج التي حصلنا عليها مع السبانخ كما هو موضح في الجدول 4.
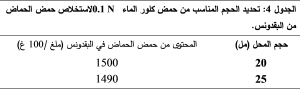
1-1-3- تحديد عدد مرات الاستخلاص:
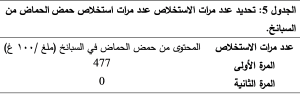
نستنتج أن عملية الاستخلاص لمرة واحدة كافية لاستخلاص كامل كمية حمض الحماض، لذلك تم الاعتماد على الاستخلاص مرة واحدة. تعاد عملية الاستخلاص على عينات البقدونس وكانت النتائج متوائمة مع النتائج التي حصلنا عليها مع السبانخ كما هو موضح في الجدول 6:
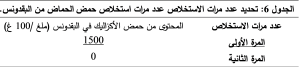
1-2- ضبط طريقة الاستخلاص:
لضبط طريقة الاستخلاص نراعي أمرين أساسيين: مردود الطريقة Recovery وتکرارية الطريقة Repeatability
1-2-1- دراسة مردود عملية الاستخلاص:
مردود الاستخلاص= x 100
استنادا إلى نتيجة المقايسة السابقة تبين احتواء عينات السبانخ المدروسة على وسطي تركيز من حمض الحماض 477 ملغ/ 100غ ثم حسب المردود عند كل مقايسة وسجلت النتائج في الجدول 7.
مما سبق تبين أن متوسط مردود الاستخلاص 99.5%، وهذا يعني أن مردود طريقة الاستخلاص ممتاز.
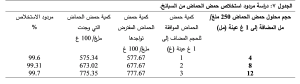
1-2-2- دراسة تكرارية عملية الاستخلاص:
ويتم التعبير عن التكرارية بالانحراف المعياري SD Standard Deviation والانحراف المعياري النسبي RSD % Relative Standard Deviation.
المتوسط الحسابي = 466.8
الانحراف المعياري SD = 0.0866
الانحراف المعياري النسبي: 1.855 = %RSD

من الجدول السابق نجد أن الطريقة تتمتع بانحراف معیاري نسبي أقل من 2% وبالتالي يمكن القول أن الطريقة ذات تکرارية جيدة.
2- نتائج طريقة الاشتقاق الكيميائي:
2-1- طيف الامتصاص Absorption Spectra:
يبين الشكل 3، المسح الطيفي الذي حصلنا عليه لمحلول حمض الحماض في الماء ضمن المجال 200-300 نم والذي يظهر بوضوح خلوه من أي موجة امتصاص أعظمي.
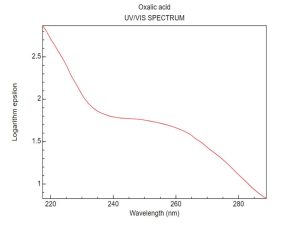
2-2- تحديد طول موجة الامتصاص الأعظمي:
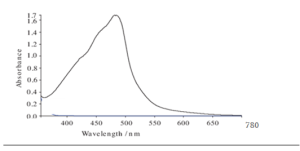
تم تحديد طول موجة الامتصاص الأعظمي للمركب الناتج عن الاشتقاق بعد إضافة حمض الحماض بتراكيزه المختلفة لـ 100 µl من كاشف A و100 µl من كاشف B و50 µl من كاشف C، وقد تشكل معقد بلون أحمر برتقالي ناتج عن تأثير الوظيفة الكربوكسيلية في حمض الحماض، حيث يحرر نتريت الصوديوم بوجود الوظيفة الكربوكسيلة حمض النتروز الذي يساهم في عملية ديأزة السلفاناميد والذي يعطي ملح ديازونيوم أحمر اللون بوجود الألفانفتيل امين والذي يمتلك طيف امتصاص في المجال المرئي. طول موجة الامتصاص الأعظمي كان عند: 482 نانومتر. الشكل 4.
2-3- تحديد تركيز الكاشف الأمثل للتفاعل:
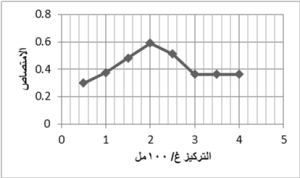
تبين أن الامتصاص يكون أعظمياً باستخدام محلول ألفا نفتيل أمين بتركيز 2% وبعدها يحصل انخفاض في قيمة الامتصاص كما في الشكل 5.
2-4- تحديد حجم الكاشف الأمثل للتفاعل:
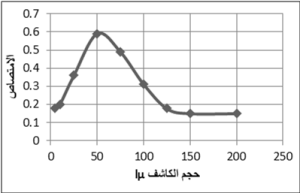
تبين أن الامتصاص يكون أعظميا باستخدام محلول ألفا نفتيل أمين 2% بحجم 50lµ وبعدها يحصل انخفاض في قيمة الامتصاص. الشكل 6.
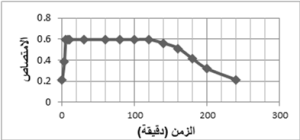
2-5- تحديد زمن التفاعل الأمثل للتفاعل:
تبين أن الامتصاص يحتاج 5 دقائق حتى يأخذ قيمته العظمى ثم يحافظ على هذه القيمة ثابتة لمدة ساعتين ثم يحدث بعدها انخفاض في قيمة الامتصاص، والشكل 7، يوضح تحديد زمن التفاعل.
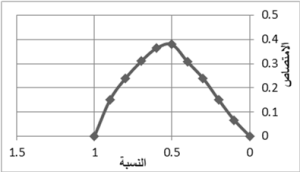
2-6- العلاقة المولية:
لتحديد العلاقة المولية بين الكاشف c وحمض الحماض تم تطبيق طريقة JOB للتغير المستمر Continues variation.
تم تحضير التركيز المولي نفسه لكل من حمض الحماض والكاشف c (2×10-3 مول/ ل) ثم إعداد سلسلة من حمض الحماض والكاشف c بحيث يكون الحجم النهائي لهما مساوياُ 500 مكل، جرى الانتظار 5 دقائق حتى اكتمال الاشتقاق الكيميائي, وقرأ الامتصاص عند موجة طولها 482 نانومتر مقابل الناصع الموافق, تم تمثيل العلاقة بيانياً بين الامتصاص ونسبة حمض الحماض + كاشف c مع المحافظة على نفس النسبة من كل من كاشفي A و B، ويوضح هذا في الشكل 8.
3- التحقق من مصدوقية الطريقة:
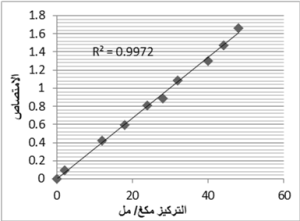
3-1- الخطية Linearity:
كانت الخطية ضمن المجال (2-48 مكغ/ مل) ومعامل الارتباط R2 = 0.9972، ويوضح الشكل 9 هذه الخطية.
3-2- حد الكشف Limit of detection:
تم تطبيق القانون LOD= 3.3 Ϭ /S حيث Ϭ الانحراف المعياري لنقطة تقاطع الخط المستقيم مع محور العينات و S ميل الخط المستقيم, ومنه LOD =0.54 مكغ/ مل.
3-3- حد المقايسة الكمية Limit of quantification:
تم تطبيق القانون LOQ=10Ϭ /S ومنه LOQ= 1.63 مكغ/ مل.
3-4- تحديد المضبوطية Accuracy:
تم تحضير 3 تراكيز (2.18.24)مكغ /مل مع إجراء 5 مكررات لكل تركيز ثم حساب الاستعادة المئوية التي بلغت99.66 % الجدول 9.
4-3-5- تحديد الدقة precision:
تم تحضير 3 تراكيز (2-18-24) مكغ/ مل مع إجراء 5 مكررات لكل تركيز في نفس اليوم وفي أيام متتالية وحساب RSD على مستوى التكرارية within-day والدقة الوسطى between-day فكان RSD˃ 2 %، ويوضح الجدول 10 هذا.

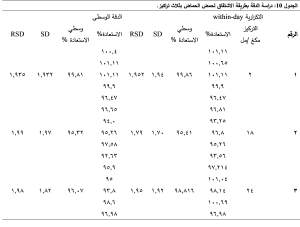 3-6- تحديد النوعية:
3-6- تحديد النوعية:
3-6-1 السبانخ:
تمت مقارنة نتائج الطريقة المقترحة مع نتائج طريقة سابقة للمعايرة بواسطة برمنغنات البوتاسيوم حيث تمت مقارنة النتائج المدرجة بالجدول 11 ثم تم حساب قيمة اختبار F-Test وكذلك اختبار t-Test. أما اختبار F-Test فقد حصلنا على قيمة F=2.7 وهي أصغر من القيمة الجدولية F=6.26و بهذا نحكم بدقة مقدارها 95% أي أن الطريقة الجديدة لا تختلف من حيث الدقة مع الطريقة القياسية وأن الحيود القياسي لكلا الطريقتين ناتج عن أخطاء عشوائية. وبالنسبة لاختبار t-Test كانت قيمة t=0.39 وهي أصغر من القيمة الجدولية t=2.306 وبهذا تكون الطريقتين من حيث المصداقية غير مختلفتين.


3-6-2 البقدونس:
تمت مقارنة نتائج الطريقة المقترحة مع نتائج الطريقة القياسية للمعايرة بواسطة برمنغنات البوتاسيوم حيث قارنا بين النتائج المدرجة بالجدول 12، ثم حسبنا قيمة اختبار F-Test وكذلك اختبار t-Test أما اختبار F-Test فقد حصلنا على قيمة F=0.67 وهي أصغر من القيمة الجدولية F=6.26 وبهذا نحكم بدقة مقدارها 95% أي أن الطريقة الجديدة لا تختلف من حيث الدقة مع الطريقة القياسية وأن الحيود القياسي لكلا الطريقتين ناتج عن أخطاء عشوائية. وبالنسبة لاختبار t-Test كانت قيمة t=0.506 وهي أصغر من القيمة الجدولية t=2.306 وبهذا تكون الطريقتين من حيث المصداقية غير مختلفتين.


الاستنتاجات:
* بعد ضبط شروط استخلاص حمض الحماض بحمض كلور الماء من السبانخ والبقدونس كانت أفضل النتائج عند استخدام 20 مل من محلول الاستخلاص لمدة نصف ساعة لمرة واحدة وكانت هذه الطريقة ذات مردودية وتكرارية ممتازين بالإضافة لسهولة استخدامها.
* تم تطوير طريقة تحليلية جديدة، بسيطة، دقيقة، وحساسة لمقايسة حمض الحماض وذلك باشتقاقه كيميائيا، وقد تم تحديد طيف الامتصاص وطول موجة الامتصاص الأعظمي لحمض الحماض مع تحديد تركيز وحجم الكاشف مع ضبط للدقة والمصدوقية، كما أن الطريقة المقترحة تمت بواسطة مقياس الطيف الضوئي Spectrophotometer لتكون معدّة للاستخدام الروتيني لمقايسة حمض الحماض في العينات المتواجد فيها.
* بعد المقارنة بين الطريقتين التحليليتين المستخدمتين في دراستنا لمقايسة حمض الحماض تبين أن الطريقة المعتمدة على الاشتقاق الكيميائي هي الأفضل وقد تميزت بأنها ذات صحة وتكرارية جيدة، وذات حساسية أكبر بالإضافة إلى السرعة في العمل وتوفير الوقت.
المراجع :1-Popova A. and Mihaylova D. Antinutrients in Plant-based Foods: A Review the Open Biotechnology Journal, 2019, 13, 68-76
2-Kasimala BM; Tedros B; Weldeyesus M; Imru H. and Tsighe N. Determination of oxalates and investigation of effect of boiling on oxalate content from selected vegetables commonly grow in Eritrea. Atoms and Molecules, 2018, 8(4),1175–1180
3-Wilson Joseph Maple. The system: calcium oxalate-sulphuric acid. Masters Theses. 1927, 4743.
4-Sahay M. and Sahay R. Rickets-vitamin D deficiency and dependency. Indian J Endocrinol Metab. 2012, 16(2):164-76
5-Han H; Segal AM; Seifter JL. and Dwyer JT. Nutritional Management of Kidney Stones (Nephrolithiasis). Clin Nutr Res. 4, 52-137, 2015.
6-Yan, Ze-Yi, Xing, Geng-Mei and Jiao Cheng-Jin. Quantitative Determination of Oxalic Acid Using Victoria Blue B Based on a Catalytic Kinetic Spectrophotometric Method. Microchimica Acta. 144, 199-205, 2004.
7-Lao YM; Jiang JG. and Yan L. Application of metabonomic analytical techniques in the modernization and toxicology research of traditional Chinese medicine.
Br J Pharmacol. 157(7):1128-41, 2009.
8-Ensafi Ali A. and Kazemzadeh, A. Flow injection spectrophotometric determination of ultra-trace amounts of oxalic acid. Fresenius journal of analytical chemistry. 2000, 367, 590-2.
9-Zheng Y; Yang CH; Pu W. and Zhang J. Determination of oxalic acid in spinach with carbon nanotubes-modified electrode. Food Chemistry. 114, 1523-1528, 2008.
10-Asadollahzadeh H. and Ranjbar, M. Modified Carbon Paste Electrode In2S3 /CPE Nanoparticles for Electrochemical Determination of Oxalic Acid by Cyclic Voltammetry. J Clust Sci; 2017, 28, 1273-1283
11-Bitossi G; Giorgi R; Mauro M; Salvadori B. and Dei L. Spectroscopic Techniques in Cultural Heritage Conservation: A Survey. Applied Spectroscopy Reviews, 2005, 40,187-228.
12-Adegoke AO. Chemical derivatization methodologies for UV-visible spectrophotometric determination of pharmaceuticals. International Journal of Pharmaceutical Sciences Review and Research. 14,6-24, 2012.
13-Ozmen H; Polat F. and Cukurovali A. Spectrophotometric Determination of Nitrite in Water Samples with 4‐(1‐Methyl‐1‐Mesitylcyclobutane‐3‐yl)‐2‐Aminothiazole, Analytical Letters, 39, 823-833, 2006,
14-AOAC. Official method of analysis, 5th edition, Sidney Williams (ed.), Association of Official Analytical Chemists Inc, Arlington. 1999.