تعيين خصائص ثبات الغلوبولينات المناعية IgGs لجمل مُمَنَّع تجاه سم العقرب وتنقيتها وكشفها
2023-01-01 | المجلد السابع العدد الأول - المجلد السابع | مقالات بحثيةمحمد كرم قصاص | أ.د. عبد القادر عبادي | أ.م.د. عبد الحكيم نتوف
الملخص
تدخل الغلوبولينات المناعية في صلب الكثير من التطبيقات الحيوية، بما فيها معالجة الأمراض. فقد أنتجت واستخدمت لاستقصاء العديد من المستضدات والممرضات المدروسة عالمياً ومحلياً. حالياً وباستخدام البيولوجيا الجزيئية والهندسة الوراثية الحديثة يُسعى لاستثمار نوع معين من الأضداد الخاصة بالجمال لإنتاج مصول فعالة ضد ممرضات لاستخدامها ترياقاً مضاداً لسموم الكائنات الخطرة، خاصةً سم العقرب. في هذا العمل، عزلت صفوف الأضداد من مصل جمل ممنع بالترسيب بسلفات الأمونيوم، من ثم الكروماتوغرافيا السائلة السريعة للبروتين (FPLC). ومن أجل التخلص من ثمالات سلفات الأمونيوم استخدم إزالة الاستملاح بالعمود. ومن ثم نقيت IgGs باستخدام عمود بروتين A وعزلت أنماط IgGs باستخدام عمود Superdex. اختبرت IgGs الجمل المنقاة وحددت خصائصها بمقايسة الممتز المناعي المرتبط بالإنزيم ELISA الذي أثبت بدوره فعالية ونوعية أنماط IgGs ضد سم العقرب. شكلت هذه الموجودات خطوة مهمة باتجاه دراسات الصياغة الصيدلانية لهذه الأضداد الواعدة.
كلمات مفتاحية : أضداد الجمل، سم العقرب، ترياق، سلفات الأمونيوم، FPLC، ثبات الأضداد.
المقدمة Introduction:
يعد التسمم بلدغة العقرب من مشاكل الصحة العامة الخطيرة في العديد من بلدان العالم. يفصح سنويا عمّا يقارب 100000 حادثة في شمال إفريقيا، كما يتعرض 30000-45000 شخص سنوياً في تونس للدغة العقرب، يعاني نحو 1000 من المصابين أعراضاً حادة، ويصل عدد الوفيات إلى 70 شخصاً، ويكون الأطفال أكثر عرضة للتأثر بالسم من البالغين [1, 2]. تنتشر العقارب من جنس Leiurus في المناطق الجنوبية من سوريا في الأراضي الصخرية غير المأهولة بالسكان، كما تم اكتشاف نوع جديد من هذا الجنس من العقارب السامة في محافظتي حمص والحسكة [3]. تعد المعالجة المناعية هي الخيار النوعي الوحيد لمعالجة حالات التسمم، وعادة ما تكون هذه العلاجات مكونة من أضداد عديدة النسيلة F(ab)2 محضرة ومنقاه بطرائق معيارية مطورة. طورت طريقة جديدة حديثاً لتنقية شدف F(ab)2 من الأضداد دون استخدام كروماتوغرافيا التنقية ودون وجود ربيطة نوعية، وذلك باستخدام مذيلات العوامل الفعالة على السطح [4]، إلا أن تلك الطريقة بحاجة للمزيد من الأبحاث لإثبات كفاءتها، حيث إن الأضداد وحيدة النسيلة وعديدتها التي استخدمت في تلك الدراسة لا تمتلك أي فعالية دوائية ما أعاق التأكد من فعالية الأضداد بعد التنقية باستخدام تقانة تبرهن ثبات الإلفة بين الضد والمستضد مثل ELISA. اتجهت أنظار الباحثين في علم المناعة مؤخراً نحو عائلة الجمليَات لتمنع ضد سموم خطيرة مثل سم العقرب ودراسة مدى ارتباط الغلوبولينات المناعية بالسم وقدرتها على تعديل السم في المختبر، تتميز الجمال بأن مصلها يحتوي على الأضداد التقليدية فضلاً عن احتوائه على أضداد ثقيلة السلسلة مجردة من السلسلة الخفيفة، تمتلك ميزات الأضداد التقليدية ذاتها إلى جانب ميزات أخرى متعلقة بإمكانية تحضير أضداد نانوية من القسم المتغاير variable الموجود على السلاسل الثقيلة بوزن جزيئي منخفض (حوالي 15 كيلودالتون) [1, 5]. وللحصول على الفائدة المرجوة من هذه الأضداد كان لا بد من فصلها وتنقيتها، إذ طورت طريقة لفصل تحت صفوف الأضداد المختلفة من فريق البحث المكتشف للأضداد ثقيلة السلسلة بالاعتماد على أعمدة فصل protein A و protein G [6]. هدف هذا البحث هو الوصول إلى طريقة تنقية للغوبولينات المناعية للجمل الممنع بسم العقرب وفصلها للوصول إلى مردود عالٍ من هذه الغلوبولينات بشكلها المطوي الفعال بعد التخلص من بروتينات المصل الأخرى، بما يخدم أهداف الصياغة الصيدلانية، ومن ثم فصل الأضداد ثقيلة السلسلة عن الأضداد التقليدية ومقارنة ثبات الأنماط المختلفة من الأضداد تجاه شروط التخريب القسري.
المواد والطّرائق Materials and Methods
سم العقرب
استخدم سم العقرب المحضر بالطريقة الكيميائية، إذ تطبق سلسلة من التيارات الكهربائية لصدم العقرب وإخراج السم. يغمر جسم العقرب في محلول ملحي من أجل توصيل كهربائي أفضل وصدمه بالقطب، وذلك باستعمال بطارية بسيطة 12 فولت [7, 8].
اختبار ترسيب الأضداد من المصل الدموي باستخدام التركيز الأمثل من سلفات الأمونيوم:
يزداد ذوبان البروتين بشكله الكروي عند إضافة ملح بتراكيز أقل من 0.15 M، وتسمى هذه العملية بالتمليح Salting-in، في حين أن التراكيز الأعلى من الأملاح تؤدي إلى تناقص ذوبان البروتين بعملية تسمى الترسيب بالتمليح Salting-out وتؤدي إلى ترسبه [9]. تحفز الأملاح التي رسبت البروتين ثباته من الناحية الشكلية، على عكس الأملاح التي أسهمت في زيادة ذوبانه الذي يكون عادة ممسخاً Denaturants للبروتين [10]. رسبت الأضداد باستخدام تراكيز متزايدة من سلفات الأمونيوم تحت خيمة أمان حيوي نظيفة ومعقمة، إذ بدئ في كل خطوة بحجم 10 مل ضمن أنبوب 50 مل ويضاف ملح سلفات الأمونيوم شيئاً فشيئاً مع التحريك، حسبت كمية سلفات الأمونيوم الواجب إضافتها للحصول على درجة الإشباع المطلوبة بالاعتماد على برنامج Ammonium sulfate calculator by ©EnCor Biotechnology Inc. بإدخال الحجم البدئي للمصل ونسبة إشباع سلفات الأمونيوم البدئية، والنهائية، ودرجة حرارة الترسيب للحصول على كمية سلفات الأمونيوم الواجب إضافتها مقدرة بالغرام، والحجم النهائي الذي سنحصل عليه بعد ذوبان كامل كمية سلفات الأمونيوم المضافة، يعتمد البرنامج لحساب عدد غرامات سلفات الأمونيوم الواجب إضافتها على المعادلة التالية:
G = Sat(M2-M1)/(SatM-(SpecVol/1000*132.14*SatM*M2))
G: كمية سلفات الأمونيوم لواجب إضافتها لكل 1 لتر
Sat: عدد الغرامات لكل لتر الموجودة في محلول مشبع لسلفات الأمونيوم
M2: المولارية المراد الحصول عليها
M1: المولارية البدئية
SatM: المولارية لمحلول مشبع من سلفات الأمونيوم
SpecVol: حجم نوعي الذي تسبب إضافة 1 غ من سلفات الأمونيوم زيادته لمحلول ≈ 0.54 مل
يأخذ البرنامج ضمن حساباته تغير كل من Sat، SatM وSpecVol بتغير درجة حرارة الحضن. يحضن الأنبوب لمدة ساعة في الدرجة 10 ° Cمع الرج ثم ينبذ بسرعة 10000×g لمدة 20 دقيقة في درجة حرارة 4 °C. توزن الرسابة في كل خطوة من خلال طرح وزن الأنبوب الفارغ من وزن الأنبوب المحتوي على الرسابة وتحل باستخدام دارئة PBS pH=7.4 بمقدار 1-2 مل لكل 1غ راسب، ويسحب الطافي لينقل 10 مل منه إلى أنبوب جديد ويعاد ترسيب البروتينات المتبقية في المصل وفق تدرج إشباع سلفات الأمونيوم [11].
مقايسة تراكيز العينات البروتينية بطريقة برادفورد
استخدمت طريقة برادفورد المميزة بالسرعة والحساسية العالية لمقايسة البروتينات بتراكيز من رتبة مكروغرام/مل بعد كل عملية تنقية [12]، بهدف معرفة المردود الكامل من البروتينات وحساب الحجم المناسب الواجب ترحيله على هلامة الأكريلاميد لمعرفة مكونات كل عينة، بعد كل عملية تنقية، حيث حضر كاشف برادفورد Roti®-quant من تمديد حجم من المحلول المركز بأربعة أمثال هذا الحجم من الماء المقطر، حُضرت سلسلة معيارية من خمسة محاليل من الألبومين البقري BSA معلومة التراكيز (0، 0.2، 0.4، 0.6، 0.8 مغ/مل) ، وضع 5 مكرولتر من كل من هذه المحاليل في بئرين متجاورين ضمن صفيحة 96 بئراً، من التركيز الأقل حتى التركيز الأعلى، صفر القياس على محلول تمديد العينات البروتينية PBS، استخدم أيضاً 5 مكل من محلول كل عينة مجهولة التركيز في بئرين متجاورين وبتمديدات مختلفة يمكن أن تصل حتى 1/100 بهدف الوصول إلى مجال الخطية لطريقة المقايسة المعتمدة، ثم أضيف 160 مكل من الكاشف في كل بئر ويمزج بنقر الصفيحة وتركها لمدة 5 دقائق بدرجة حرارة المخبر وقرئت الامتصاصية بجهاز thermos-scientific multiskan go على موجة طولها 595 نم.
الرحلان الكهربائي للبروتينات
حضرت العينات البروتينية بما يكافئ 5 مكغ من كل عينة للترحيل، من إضافة سدس حجم العينة من دارئة تحضير العينة (Sample Loading buffer 6X) المحتوي على الملح الصودي لأزرق البروموفينول وبيتا-مركابتو إيتانول الذي يسهم في تمسخ البروتينات لتسهيل ترحيلها، سخنت أنابيب العينات في حوض من الماء المغلي لمدة 10 دقائق. حقن 20 مكرولتر من كل عينة في آبار الهلامة، مع استعمال واسم بروتيني معياري معروف الوزن الجزيئي في أول بئر للمقارنة. حيث حضرت الهلامات باستخدام هلامة عليا بتركيز 4% لتكديس العينات وهلامة سفلى بتركيز 12 % لترحيل العينات. رحلت العينات عبر الهلامة بتطبيق حقل كهربائي بفولـطية 90 V، حتى دخول العينات في هلامة الفصل، بعدها رفعت الفولطية إلى 120 V باستخدام نظام BioRad mini-Protein II system وفق تعليمات الشركة المنتجة حتى نهاية الرحلان. بعد الانتهاء من الرحلان الكهربائي صبغت الهلامة staining بالطريقة السريعة، بزيادة الحساسية، برفع درجة الحرارة في أثناء الصبغ وإزالة الصباغ [13]. غمرت الهلامة في الصباغ مدة 5 دقائق باستخدام 50 مل أزرق الكومازي coomassie blue بعد التسخين لمدة 30 ثانية في المايكرويف ومن ثم أزيل الصباغ destaining بغمر الهلامة في حوض يحوي 100 مل محلول إزالة الصباغ الحاوي على حمض الخل 5% وميتانول 10% والتسخين في المايكرويف لمدة دقيقة، ثم تترك ساعة مع الرج إلى حين ظهور العصابات بعد زوال اللون عن باقي الهلامة.
الكشف عن الأضداد بتقنية لطخة ويسترن western blot للعينات البروتينية بعد ترحيلها
تعد لطخة ويسترن طريقة مفيدة جداً للكشف النوعي عن البروتينات بعد فصلها على هلامة الأكريلاميد تبعاً لأوزانها الجزيئية، فضلاً عن إمكانية الكشف الكمي اعتمادأ على سماكة العصابة التي تعبر عن كمية البروتين [14]. رٌحلت العينات في اختبار لطخة ويسترن على هلامة الأكريلاميد، وقصت أطراف الهلامة بعد نهاية الترحيل، ومن ثم وضعت على غشاء لطخة ويسترن بين طبقات من أوراق الترشيح المشبعة بدارئة النقل transfer buffer (25 mM tris − base, 200 mM glycine, 0.1% SDS and 20% methanol)، وضع القالب بين صفيحتي جهاز النقل الكهربائي TE 77 PWR semi-dry transter unit (GE lifescience) بهدف نقل العصابات من الهلامة إلى غشاء نتروسلولوز 0.45 مكم (Bio-Rad) باستخدام تيار كهربائي، طبق حقل كهربائي 100أمبير لمدة ساعة لضمان تمام الانتقال، بعد انتهاء الوقت حرر الغشاء من القالب وغسل بدارئة الغسل. حضن الغشاء في محلول الإحصار Blocking (حليب منزوع الدسم 5%) لمدة ساعتين ثم غسل مرات عدة بمحلول الغسل (PBS pH=7.4 المحتوي على توين 20 بتركيز 0.05%). اختبرت ثلاثة أضداد مختلفة بالتمديدات المناسبة للكشف عن الغلوبولينات المناعية على الغشاء وهي أضداد الأرنب الممنع بمصل الجمل R-a-camel (Bethyl Laboratories Inc.)، وأضداد الأرنب الممنع بمزيج أضداد الجمل النانوية محضر في المخبر Home-made R-a-Nb وأضداد الأرنب الممنع بالغلوبولينات ثقيلة السلسلة من مصل الجمل محضر في المخبر (R-a-IgG2,3)، إذ حٌضن غشاء النتروسلولوز في خطوة لاحقة بأضداد الماعز الممنع بمصل الأرنب والمدمجة مع إنزيم البيروكسيداز G-a-R-HRP (Bethyl Laboratories Inc.) ومن ثم أضيفت ركازة البيروكسيداز 3-أمينو-9-إيتيل كاربازول (AEC) المحضرة ضمن دارئة سيترات الفسفات pH=5 مع الماء الأكسجيني بتركيز نهائي 0.015% لإظهار العصابات.
المبادلة الدارئية باستخدام كروماتوغرافيا مبادلة دارئية Buffer exchange chromatography
تستخدم المبادلة الدارئية بهدف التخلص من بقايا سلفات الأمونيوم في البروتين الذي رسب وغيرت الدارئة المحتوية على الغلوبولينات المناعية [10]، استخدم جهاز AKTATM Pure 150 بعد تركيب عمود HiPrep 26/10 Desalting محشو بحبيات السيفادكس sephadex G-25 fine ذات القدرة على فصل البروتينات بخاصية الاستبعاد الحجمي عن الشوارد والمكونات غير المرغوب بها التي قد تؤثر سلباً عفي طي البروتين وثباته وكفاءة الفصل في الخطوات التالية. حيث غسل العمود بالماء المقطر والمفلتر كما هو الحال بالنسبة إلى جميع الدوارئ المستخدمة في تقنيات كروماتوغرافيا التنقية للبروتينات، فلترت الدوارئ والمحاليل المستخدمة بما في ذلك العينات الحاوية على البروتين عبر غشاء نتروسلولوز 0.45 مكرومتر. وهيئ العمود بدارئة المبادلة (دارئة فسفات 20mM pH=7.4 + كلوريد الصوديوم (150 mM، مررت العينة بحجم 5 مل عبر العمود بواسطة الجهاز بسرعة تدفق 20 مل\دقيقة وتُتبع مرور الأضداد عبر النظام وعمود المبادلة من قياس الامتصاصية في موجة طولها 280 نم، جمعت الأضداد بعد عملية المبادلة وركزت باستخدام أنابيب التركيز vivaspin 10000 kDa.
تنقية الغلوبولينات المناعية باستخدام كروماتوغرافيا الألفة Affinity chromatography
استخدم عمود الفصل 5 ml HiTrap Protein A column (Pharmacia) بغية التخلص من البروتينات الأخرى التي رُسِّبت بسلفات الأمونيوم مع الغلوبولينات المناعية لكون العمود مميزاً بإلفته للغوبولينات المناعية IgG، إذ إنها ترتبط مع البروتين A من خلال ثلم كاره للماء بين المنطقتين الثانية CH2 والثالثة CH3 على الجزء الثابت من السلسلة الثقيلة [15]، غسل العمود بداية بالماء المقطر والمعقم، ومن ثم مرر 25 مل من دارئة الارتباط وحقن 5 مل من العينة بوجود دارئة الارتباط Binding buffer (20 mM sodium phosphate pH = 7.0) بحيث أتاح ارتباط الغلوبولينات المناعية ذات الألفة للبروتين A بالعمود وسمح لباقي البروتينات بالتدفق لتجمع في أنبوب للترحيل في خطوة لاحقة، ومن ثم استخدمت دارئة الشطف elution buffer (0.15 M NaCl, 0.58 % acetic acid pH = 4) التي تضمن فك ارتباط الغلوبولينات المناعية بالعمود. أخذت عينات للترحيل من كل عينة جٌمعت عند ظهور قمة على كروماتوغرام الامتصاصية (280 نم) بهدف كشف محتوى هذه العينات من بروتينات مصل الجمل وكشف كفاءة التنقية لأضداد الجمل.
فصل أنماط الغلوبولينات المناعية للجمل بتقنية كروماتوغرافيا الاستبعاد الحجمي Size exclusion chromatography (SEC)
استخدم عمود Superdex 200 لفصل أضداد الجمل ذات السلسلة الثقيلة عن الأضداد التقليدية، إذ جرى اعتماد دارئة غسل washing buffer (20 mM sodium phosphate + 150 mM sodium chloride pH = 7.4) بعد أن غُسل العمود بضعفي حجمه بالماء المقطر بمعدل تدفق 1 مل/دقيقة ومن ثم مررت دارئة الغسل لمدة ساعتين بمعدل التدفق ذاته، ثم مُررت عينة الغلوبولينات المناعية النقية الناتجة عن عملية التنقية السابقة بعد أن ركزت باستخدام أنبوب vivaspin 10000 kDa إلى حين وصول العينة إلى حجم 500 مكل وبتركيز لا يزيد عن 10 مغ/500 مكل، حقنت العينة بعد تمريرها على فلتر 0.22 مكرومتر وجمعت عينات عند كل قمة امتصاصية تظهر على كروماتوغرام الامتصاصية لترحيلها في خطوة لاحقة. استخدم لهذه التقانة AKTA explorer FPLC system. رُحِّل 5 مكروغرام من كل عينة جمعت باالتزامن مع ظهور قمة على كروماتوغرام الفصل بعمود Superdex 200 على هلامة الأكريل أميد، وذلك بعد أن حضرت العينات كما هو موضح سابقاً ومن ثم صبغت باستخدام أزرق الكومازي وأزيل الصباغ لتظهر العصابات الدالة على الأضداد.
اختبار ثبات أنماط أضداد الجمل IgG تجاه الحرارة والأكسدة
تعد دراسات الثبات ذات أهمية خاصة للأضداد ذات الفعالية الدوائية ضمن مدة التخزين، كما أن لها دوراً في تعرف الطرائق التي يسلكها الضد في تخربه، فضلاً عن المعلومات التي قد تجمع عن المواد الناتجة عن التخريب [16]، حُضرت عينات بتركيز 1/100 من كل من العينات التي جمعت عند ظهور كل قمة على الكروماتوغرام في أثناء تجربة فصل أنماط غلوبولينات الجمل المناعية باستخدام تقنية الاستبعاد الحجمي بهدف مقارنة أنماط أضداد الجمل ثقيلة السلسلة بالتقليدية. عرضت هذه العينات لشروط تخريب قسري باستخدام درجات مختلفة من الحرارة (60, 75, 90) °C لمدة ساعة، واستخدم الماء الأوكسجيني بتراكيز (0.1، 0.3، 1%) لمدة ساعة أيضاً بوصفه شرطاً آخر للتخريب القسري ومقارنة ثبات الأضداد تجاه الأكسدة. قورنت فعالية الاضداد بعد التعرض لشروط التخريب بتقانة المقايسة المناعية واستخدمت الأضداد غير المعرضة لشروط التخريب القسري بوصفه شاهداً مرجعياً للمقارنة بالعينات المخربة.
المقايسة المناعية الإنزيمية:
ثُبت سم العقرب في آبار صفيحة إليزا (BRANDplates®-immunogradTM) بتركيز 2 مكغ/بئر باستخدام دارئة كربونات الصوديوم لليوم التالي، إذ غسلت الصفيحة ثلاث مرات بدارئة PBS باستخدام جهاز Thermo Scientific, Wellwash وكررت عملية الغسل بعد كل خطوة حضن. في حين غطيت مواقع ارتباط البروتينات الأخرى على سطح الآبار بمحلول الإحصار المكون من حليب مقشود 5% في دارئة فسفات ملحية (5 % skimmed milk in PBS pH=7.4) مع الحضن لمدة ساعة بدرجة حرارة المختبر. بعد غسل الآبار من بقايا محلول الإحصار أضيفت ثلاث مكررات بتركيز (1:10000) من كل من العينات المراد اختبارها مع الشواهد وحُضنت لمدة ساعة في درجة حرارة المختبر. كشف عن ارتباط المستضدات بالأضداد باستخدام المصل الموافق وهو مصل الأرنب الحاوي على أضداد نوعية للأضداد ثقيلة السلسلة Rabbit anti-IgG2,3 بتركيز (1:200) التي أثبتت نوعيتها في اختبار التبصيم المناعي. أضيفت أمصال محتوية على أضداد ماعز ممنع بمصل الأرنب موسومة بالبيروكسيداز بتمديد (1:3000) Gout anti rabbit-HRB (Bethyl Laboratories Inc.) مع الحضن مدة ساعة في درجة حرارة المختبر. في الخطوة الأخيرة أضيف المداد الخاص بالبيروكسيداز 3,3′,5,5′-Tetramethylbenzidine (TMB) (Sigma) بعدها أوقف التفاعل باستعمال حمض الكبريت 0.5 M ثم قيست المطيافية الناتجة وذلك في موجة طولها 450 نانومتر باستخدام قارئ صفائح Thermo Scientific, Multiskan Go. اعتمد اختبار one-way ANOVA لمقارنة ثبات أنماط أضداد الجمل IgG باستخدام Prism v7.0 software (GraphPad Statistics, USA)، *p<0.05.
النتائج Results
ترسيب أضداد الجمل بملح سلفات الأمونيوم
انطلقنا في هذه الدراسة من عينة مصل دم من جمل ممنع بسم العقرب، إذ اختبرت الشروط المثلى من درجة إشباع بملح سلفات الأمونيوم الضرورية لترسيب أضداد الجمل بنوعيها التقليدية والثقيلة السلسلة، وقد استخدمت لهذه الغاية عدة نسب من الإشباع. رُسم الخط المستقيم لقراءات السلسلة المعيارية لألبومين مصل البقر BSA ضمن مجال خطي من التراكيز بواحدة مغ/مل الذي عبر عنه بمعادلة يمكن منها معرفة التركيز المجهول للأضداد لكل عينة بعد معرفة وسطي قراءات الامتصاصية للمكررين وضرب الناتج بمعامل التمديد الخاص بالعينة (كما هو موضح في الشكل 1، a)، كما حسب وزن الراسب الناتج في كل مرحلة وحله باستخدام PBS، ومن ثم حسب تركيز البروتين عن طريق المعادلة آنفة الذكر (كما هو موضح في الشكل 1، b)

(a) يظهر الشكل خطية ضمن مجال تراكيز من ألبومين المصل البقري BSA مع معامل تصحيح R2= 0.996، حيث استخدمت صفيحة زراعة خلوية 96 بئراً ووضع 5 مكل ضمن بئرين متجاورين من كل من تراكيز السلسلة (0، 0.2، 0.4، 0.6، 0.8 مغ/مل) مع استخدام دارئة الفوسفات الملحي PBS المستخدم لتمديد العينات البروتينية كشاهد، أضيف 160مكل من كاشف برادفورد وقرئت الامتصاصية بجهاز thermos-scientific multiskan go في موجة طولها 595 نم ورُسم الخط المستقيم المعبر عن خطية الطريقة بواسطة يرنامج Skanlt software 4.1 for microplate readers، (b) جدول مراحل إضافة سلفات الأمونيوم للمصل للوصول إلى درجات الإشباع المراد اختبارها بوصفها مراحل ترسيب لمصل الجمل في درجة حرارة 10 °C، ووزن الراسب الناتج في كل مرحلة، فضلاً عن التركيز النهائي بعد حل الرسابة باستخدام PBS والمحسوب باستخدام معادلة الخطية لسلسلة تراكيز الألبومين باستخدام كاشف برادفورد.
الرحلان الكهربائي للبروتينات والتبصيم المناعي
ظهرت على هلامة الأكريلاميد بعد صبغها بأزرق الكومازي العصابات الخاصة بكل من الأضداد التقليدية وثقيلة السلسلة بما يتوافق أكثر مع الشاهد الإيجابي الأول المحتوي على مزيج من الغلوبولينات المناعية المنقاة من مصل الجمل عند الترسيب بتركيز إشباعي 20% من سلفات الأمونيوم، وعصابات خاصة بالأضداد ثقيلة السلسلة فقط للعينة التي خضعت لرفع التركيز الإشباعي من سلفات الأمونيوم من 20% إلى 40%، بما يتوافق مع الشاهد الإيجابي الثاني المحتوي على الأضداد ثقيلة السلسلة IgG2,3 النقية المحضرة في دراسات سابقة[17]، كما لوحظ ظهور العصابة الخاصة بألبومين مصل الجمل بطول ≈ 90 كيلو دالتون عند كل التراكيز الإشباعية المجربة مع ملاحظة زيادة كثافة العصابة بالتراكيز الإشباعية العالية (60-80-100%) مقارنة بالتركيزين (20-40%) (الشكل 2، a).
بينت الأضداد الثانوية المختلفة والتي استخدمت في اختبار التبصيم المناعي قدرات متفاوتة على كشف العصابات الخاصة بكل مكون لمصل الجمل الممنع بسم العقرب، إذ أبدت أضداد الأرنب الممنع بأضداد الجمل ثقيلة السلسلة R-a-IgG 2,3 نوعية لكشف السلاسل الثقيلة من الأضداد التقليدية أو الأضداد ثقيلة السلسلة، دون أن تكشف عن الأضداد خفيفة السلسلة في الأضداد التقليدية، كذلك الأمر أبدت أضداد الأرنب الممنع بالأضداد النانوية التي تمثل المنطقة المتغايرة من الأضداد ثقيلة السلسلة نوعية للكشف عن ذات السلاسل الثقيلة مع حساسية أقل. من ناحية أخرى أبدت أضداد الأرنب الممنع بمصل الجمل الكامل نوعية وحساسية عالية لألبومين الجمل المصلي دون أن تبدي أية الفة لغلوبولينات الجمل المناعية. تؤكد هذه النتيجة نوعية أضداد الأرنب الممنع بالأضداد ثقيلة السلسلة R-a-IgG 2,3 تجاه غلوبولينات الجمل IgG (الشكل 2 b، c، d)، ما يوجه نحو استخدامها في اختبارات المقايسة المناعية الإنزيمية للمقايسة النوعية لهذه الأضداد.

(a) صبغة كومازي بعد ترحيل العينات المرسبة بنسب إشباع متزايدة من سلفات الأمونيوم بعد الواسم العياري (M) مع شاهد إيجابي يحوي مزيج أضداد الجمل كاملة (C1) و شاهد إيجابي ثان يحوي أضداد الجمل ثقيلة السلسلة IgG2,3 (C2). يمكن تمييز 3 عصابات لأضداد الجمل في العينة المرسبة بتركيز إشباعي 20% وتمثل كل من السلسلة الثقيلة للضد التقليدي (HC) والسلسلة الثقيلة للضد ثقيل السلسلة (HHC) والسلسة الخفيفة للضد التقليدي (LC) بشكل متوافق مع الشاهد C1. عند رفع التركيز الإشباعي إلى 40% تظهر عصابة دالة على ترسب المزيد من الأضداد ثقيلة السلسلة بشكل متوافق مع الشاهد الثاني C2. (b), (c) و(d) صور غشاء نترات السليلوز بعد التبصيم المناعي العينات الخاضعة لرحلان كهربائي نفسها كما في a وبدلاً عن الصبغ بكومازي تم نقل العينات إلى الغشاء والكشف عن العصابات بـإضافة 3-amino-9-ethylcarbazole (AEC) بوصفها ركازة لإنزيم البيروكسيدز المدمج مع الضد المضافي في الخطوة الأخيرة (1/3000) G-a-R-HRP. إذ اختبر في (b) R-a-Camel (1/3000) للكشف عن أضداد الجمل غير أن العصابات التي ظهرت تمثل ألأبومين مصل الجمل في جميع مراحل الترسيب دون ظهور أي عصابة على الشواهد الإيجابية، في (c) اختبر R-a-Nb (1/500) الذي أظهر العصابات الخاصة بالسلاسل الثقيلة لأضداد الجمل التقليدية وثقيلة السلسلة. في (d) R-a-IgG 2,3 (1/200) أظهر العصابات الخاصة بالسلاسل الثقيلة لكامل أضداد الجمل.
المبادلة الدارئية باستخدام كروماتوغرافيا المبادلة الدارئية Buffer exchange chromatography
اعتُمد تركيز الإشباع 40% للحصول على أكبر مردود ممكن من أضداد IgG للجمل دون ترسيب البروتينات الأخرى المرافقة كالألبومين بكميات كبيرة. بعد ترسيب أضداد الجمل كان لا بد من التخلص من بقايا سلفات الأمونيوم والشوارد والأملاح التي قد تؤثر في طي البروتين وذوبانه، كما أنها قد تؤثر تأثيراً سلبياً في أعمدة التنقية المراد استخدامها في خطوات تالية. استخدم عمود HiPrep 26/10 Desalting، حيث جمعت العينة المحتوية على البروتينات والمرافقة لظهور القمة الأولى المتعلقة بالامتصاصية absorbance في موجة طولها 280 نم وهو طول موجة القياس الخاص بالبروتينات مع الدارئة الجديدة المستخدمة للمبادلة، في حين لوحظ ظهور القمة الخاصة بالمكونات المرافقة للعينة من شوارد وأملاح استدل عليها بتبدل في الناقلية الكهربائية ما يؤكد التخلص من هذه المكونات الحاوية على العديد من الشوارد الخاصة بدارئة PBS المستخدم في حل العينات فضلاً عن بقايا سلفات الأمونيوم الشكل (3، a).
تنقية غلوبولينات الجمل المناعية باستخدام كروماتوغرافيا الالفة
أظهرت نتائج الرحلان الكهربائي وجود أضداد الجمل المناعية عند الترسيب بسلفات الأمونيوم بتركيز إشباعي حتى 40% كما أظهرت وجود ألبومين مصل الجمل في العينات التي رُسِّبت بهذا التركيز. وبهدف الحصول على الغلوبولينات المناعية IgG نقياً استخدم عمود Protein A ذو الألفة لهذا النوع من الأضداد، إذ ارتبط الجزء الأكبر من الأضداد بالعمود في أثناء تمرير محلول الارتباط في حين تدفقت باقي البروتينات وظهرت القمة الأولى المعبرة عن هذا التدفق Flow throw (Ft)، بعد مراحل مستفيضة من الغسل شُطف الأضداد Pure المرتبطة بالعمود باستخدام محلول الشطف وجمعت العينات المرافقة لظهور كل قمة على الكروماتوغرام. قويس مردود الأضداد بعد تنقيتها بطريقة برادفورد، ليُرحَّل ما يعادل 5 مكغ من كل عينة على هلامة الأكريلاميد وصبغت بعد ذلك بملون كومازي، ظهرت العصابات الخاصة بالسلاسل الثقيلة HC والخفيفة LC الخاصة بأضداد الجمل التقليدية وكذلك ظهرت عصابة ثخينة للأضداد ثقيلة السلسلة HHC تشير إلى مردود أعلى من الأضداد التقليدية بشكل نقي في العينة Pure مع اختفاء تام للعصابة الخاصة بألبومين مصل الجمل Alb، في حين لوحظ هروب جزء كبير من مردود الأضداد إلى جانب الألبومين مع التدفق الخاص بالقمة الأولى FT ما قد يفسر بالتركيز العالي للأضداد في العينة المراد تنقيتها الشكل (3، b).
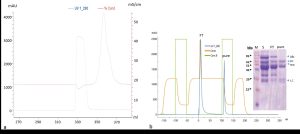
المسح الطيفي وتغيرات الناقلية خلال المبادلة الدارئية باستخدام جهاز تنقية البروتينات (AKTA pure 150 ) المجهز بعمود HiPrep 26/10 Desalting، ضبط الحد الأعلى للضغط قبل وبعد العمود عند 0.5 و0.15 ميلي باسكال على الترتيب، حقنت عينة بحجم 5 مل وضبط معدل التدفق في أثناء عملية التنقية عند 10 مل/د. تمثل القمة الأولى الامتصاصية عند 280 نم مشيرة إلى خروج البروتين مع دارئة الفسفات المستخدمة بوصفها دارئة مبادلة عند ناقلية 18 ميلي سيمينز/سم. تمثل القمة الثانية تغير الناقلية عند مرور مكونات الدارئة الخاصة بالعينة المحقونة والمحتوية على بقايا سلفات الأمونيوم مع بقايا المكونات الملحية المرافقة عند ناقلية 54 ميلي سيمينز/سم، (b) يظهر المسح الطيفي للبروتينات عند طول موجة 280 نم خلال التنقية باستخدام جهاز AKTA Pure 150 protein purification system المزود بعمود protein A. حيث استخدم دارئة الفوسفات كدارئة ارتباط binding واستخدم محلول حمض الليمون 0.1 M، pH= 3 بوصفه محلول شطف elution، وضبط الحد الأعلى للضغط قبل العمود وبعده على 0.7 و0.5 على الترتيب، ومعدل التدفق خلال التدفق عبر العمود على 10 مل/د. حقنت عينة بحجم 5 مل في أثناء تمرير دارئة الارتباط حيث ظهرت القمة الأولى التي تمثل خروج البروتينات غير المرتبطة، ومن ثم مرر محلول الشطف لتظهر القمة الثانية التي تمثل خروج البروتينات ذات الالفة للعمود. (inset) توضح الصورة المدخلة هلامة الأكريل أميد نتيجة الصبغ بكومازي بعد ترحيل كل من العينة الأساسية المحقونة قبل التنقية (S)، والبروتينات المتدفقة دون أن ترتبط بالعمود flow throw (FT) خلال تمرير دارئة الارتباط حيث تظهر عصابة الألبومين Alb بشكل أساسي، والغلوبولينات المناعية النقية التي خرجت مع دارئة الشطف (Pure) حيث ظهرت العصابات الدالة على السلسلة الثقيلة للأضداد التقليدية HC والعصابة الدالة على السلسلة الثقيلة للأضداد ثقيلة السلسلة HHC، والعصابة الدالة على السلسلة الخفيفة للأضداد التقليدية LC دون أي أثر لعصابة الألبومين. يظهر في الخط الأول الواسم العياري (M) من (Vivantis).
فصل أنماط الغلوبولينات المناعية IgG للجمل باستخدام تقنية الاستبعاد الحجمي Size exclusion chromatography (SEC)
استخدم عمود Superdex 200 لفصل مكونات أضداد الجمل ذات الأوزان الجزيئية المختلفة بتقنية الاستبعاد الحجمي، لوحظ في الكروماتوغرام ظهور ثلاث قمم متتالية، بعد ترحيل 5 مكغ من كل من العينات المجموعة عند كل قمة وصبغ هلامة الأكريلاميد بأزرق الكومازي تبين أن القمة الأولى تمثل فائض من العينة يحوي مزيج مكونات مماثلة للعينة الأساسية المحقونة ضمن العمود، في حين كان مردود الأضداد التقليدية أكبر من مردود الأضداد ثقيلة السلسلة في القمة الثانية، وظهرت الأضداد ثقيلة السلسلة نقيةً في القمة الثالثة ما يؤكد كفاءة عملية الفصل بتقنية الاستبعاد الحجمي التي أسهمت في تنقية هذا النوع المميز من أضداد الجمل (الشكل 4).
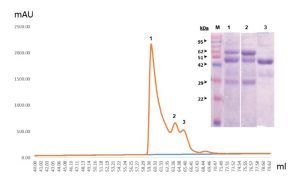
جرى حقن 0.5 مل من العينة الناتجة عن التنقية بعمود بروتين A بعد أن جرى تركيزها باستخدام vivaspin 10000 kDa ليصبح تركيزها ≈ 20 مغ/مل، حيث مررت قبل الحقن على فلتر 0.22 مكم، مرر الماء بمدة ساعتين بتدفق 1 مل/د، ومن ثم مررت دارئة الغسل washing buffer أيضا لمدة ساعتين ومن ثم حقنت العينة وجمعت العينات المرافقة لظهور كل قمة. (inset) تبين الصورة المدخلة نتيجة الصبغ بكومازي بعد ترحيل ما يعادل 5 مكغ من كل عينة ناتجة عن القمم (1، 2، 3) إلى جانب الواسم العياري، إذ تمثل القمة الأولى (1) مكونات العينة الأساسية التي ظهرت معبرة عن فائض في تركيز العينة، إذ تحتوي العصابات الدالة على كافة أنماط أضداد الجمل، في حين يلاحظ في القمة الثانية (2) ظهور العصابتين الدالتين على السلسلة الثقيلة والخفيفة لأضداد الجمل التقليدية تقريباً عند 60 و27 كيلودالتون على الترتيب بشكل أوضح من عصابة الاضداد ثقيلة السلسلة، في حين ظهرت عند القمة الثالثة (3) العصابة الدالة على السلسلة الوحيدة المميزة للأضداد ثقيلة السلسلة بشكل نقي عند تقريباً 45 كيلودالتون.
اختبار ثباتية أنماط أضداد الجمل تجاه الحرارة والأكسدة
أبدت أنماط أضداد الجمل المختلفة قدرة كل منها على تعرف المستضد النوعي (سم العقرب) المثبت على صفيحة الإليزا دون وجود فوارق يعتد بها بين كل من النمطين والمزيج الكامل بينهما، ما يؤكد نتائج دراسات سابقة [18, 19]. لدى مقارنة أنماط أضداد الجمل التقليدية وثقيلة السلسلة والمزيج الكامل للأضداد والناتجة عن التنقية بالاستبعاد الحجمي بعمود Superdex 200 من حيث ثباتها تجاه درجات حرارة مختلفة وتراكيز متفاوتة من H2O2 تبين انعدام فوارق يعتد بها إحصائياً بين الأنماط الثلاثة بالمجمل. حافظت الأضداد التقليدية على ثبات أعلى في درجة الحرارة 60 °C، في حين أبدت الأضداد ثقيلة السلسلة ثباتاً أعلى في درجات الحرارة 75 و90 °C، وكذلك الأمر كان ثبات الأضداد ثقيلة السلسلة أفضل من ثبات الأضداد التقليدية عند التراكيز الأعلى من الماء الأكسجيني 1%، في حين كانت الأفضلية للأضداد التقليدية في التركيز 0.3%. تشير النتائج إلى مقاومة أعلى لشروط التخريب للأضداد ثقيلة السلسلة في الشروط الأكثر قساوة في حين كان ثبات الأضداد التقليدية أعلى في الشروط الأقل قساوة، وتبقى اختبارات الثبات طويلة الأمد في شروط الحفظ الأمثل هي المحدد الأكثر دقة لثبات أنماط الأضداد المختلفة في أثناء الزمن (الشكل.5).
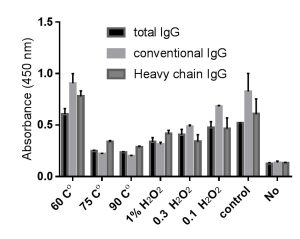
يوضح الشكل نتائج المقايسة المناعية الإنزيمية لأضداد الجمل IgG الكاملة والتقيدية وثقيلة السلسلة قبل وبعد تطبيق ستة شروط تخريب قسري باستخدام ثلاث درجات حرارة مرتفعة وثلاث تراكيز مختلفة من الماء الأكسجيني، حيث ثبت في الصفيحة 2 مكغ/بئر سم العقرب (3 مكررات لكل شرط) مع وجود شاهد سلبي دون تثبيت أي مستضد. في الخطوة اللاحقة لإضافة أضداد الجمل بتمديد (1/10000) تم استخدام R-a-IgG 2,3 بوصفه ضداً نوعي للكشف عن أضداد الجمل، ومن ثم أضيف الضد النهائي المدمج مع إنزيم البيروكسيدازG-a-R-HRP ، واستخدمت ركازة TMP الخاصة بإنزيم البيروكسيداز في الخطوة الأخيرة ثم أضيف حمض الكبريت 0.5 مول/لتر لإنهاء التفاعل وقرئت الامتصاصية في موجة طولها 450 نم.
المناقشة Discussion:
تختلف نسبة إشباع سلفات الأمونيوم المستخدمة في أثناء فصل المصل إلى مكوناته Fractionation لترسيب الأضداد بين نوع حيوان تجربة وآخر، وعادة ما يتم تحديد نسبة الإشباع الأمثل المناسبة تجريبياً [20, 21]. هدف هذا العمل إلى تحديد نسبة إشباع سلفات الأمونيوم الأمثل لترسيب كامل أضداد IgG متعددة النسيلة بمختلف الأنماط للجمل الممنع بسم العقرب للحصول على أكبر مردود ممكن من الأضداد الفعالة وصياغتها صيدلانياً علاجاً مضاداً لسم العقرب، لم يلاحظ أي وجود للغلوبولينات المناعية بعد النسبة 40%، في حين ظهرت العصابات الدالة عليها في التراكيز حتى 40%، لم تكن هذه النتائج مطابقة لنتائج الدراسة التي هدفت إلى عزل أضداد الجمل الممنع بسم أفعى من نوع Naja Naja Oxiana لغايات علاجية أيضاً، حيث وجد الباحثون في هذه الدراسة أن نسبة إشباع سلفات الأمونيوم 55% هي الأمثل للحصول على أعلى مردود من الأضداد IgG في مصل الجمل. حيث تابعت هذه الدراسة تنقية الأضداد باستخدام كروماتوغرافيا المبادلة الشاردية باستخدام عمود DEAE-Sepharose CL-6B وفقا لنقطة التعادل الكهربائي للبروتين لهذه الأضداد وأثبتت بعد المقارنة بأضداد الحصان F(Ab)2 تفوٌق أضداد الجمل بما يعادل أربعة أضعاف بفعالية الارتباط بالمستضد ضمن صفيحة المقايسة المناعية الإنزيمية [22]، في حين جرى الاعتماد اعتمادأ أساسياً في هذا العمل على عمود بروتين A نظراً إلى نوعيته ولألفة الأضداد له وسهولة شطفها بعد ارتباطها بالعمود. فصلت نُميطات أضداد الجمل IgG في دراسات سابقة بواسطة التنقية التفاضلية باستخدام عمودي بروتين A وبروتين G بعدة خطوات [6, 17]. بعد الحصول على مردود عال من أضداد الجمل فُصلت أنماط أضداد الجمل التقليدية وثقيلة السلسلة بخطوة واحدة من خلال حقن كمية محددة من أضداد الجمل التي نقيت مسبقاً بعمود بروتين A باستخدام عمود Superdex 200 ذات القدرة العالية على فصل البروتينات تبعاً لوزنها الجزيئي، وقورنت من حيث فعالية الارتباط بالمستضد وثباتها تجاه شروط التخريب بالحرارة والأكسدة، حيث أن وجود أو عدم وجود فوارق من حيث الفعالية والثبات يجب أن يؤخذ بالحسبان في الصياغة الصيدلانية لهذه الأضداد، لا سيما أن فعالية البروتينات عموماً متعلقة بوجودها بشكلها المطوي محافظة على المستوى الرابع من بنيتها، ورغم أن الأضداد تعد من أكثر البروتينات ثباتاً إلا أن فعاليتها مرتبطة بالجزء المتغاير variable وبشكل أكثر تحديداً بالعرى في المناطق المحددة للمتممة Complementarity determining regions (CDRs)، حيث إن أي تغير في تسلسل الأحماض الأمينية على هذه المناطق سيؤثر تأثيراً مباشراً شكل السطح في المنطقة المتغايرة وما يليه من نقص في النوعية والقدرة على الارتباط وتعرف المستضد [23]. أكدت هذه المقارنة انعدام فوارق يعتد بها بين الأضداد ثقيلة السلسلة والأضداد التقليدية والمزيج الكامل لهذه الأضداد، ما يتيح الاستفادة من المردود الكامل للأضداد في تحضير منتج صيدلاني ترياقاً لعلاج لدغة العقرب.
الاستنتاجات Conclusions:
طورت طريقة لترسيب كافة أضداد اسم العقرب باستخدام محلول سلفات الأمونيوم ذو تركيز إشباعي نهائي 40%، ومن ثم حُلَّ البروتين والتخلص من بقايا سلفات الأمونيوم بالمبادلة الدارئية ليتخلص في خطوة لاحقة من جميع البروتينات المصلية غير المرغوبة من خلال تنقية أضداد سم العقرب، باستخدام عمود بروتين A ذات الألفة لهذه الأضداد، وبذلك حصلنا على مردود عال من أضداد الجمل النوعي لسم العقرب بما يخدم أهداف دراسة الصياغة الصيدلانية. أثبتت أنماط الأضداد فعاليتها في الارتباط بالمستضد على صفيحة المقايسة المناعية الإنزيمية، كما أظهرت صفات ثبات متشابهة تجاه شروط التخريب القسري بالحرارة والأكسدة، وهذا يؤكد أهمية الاستفادة من كامل مردود الأضداد في الدراسات الصيدلانية
المراجع :1. Meddeb-Mouelhi, F., et al. Immunized camel sera and derived immunoglobulin subclasses neutralizing Androctonus australis hector scorpion toxins, Toxicon, 42(7),785-91, 2003.
2. Goyffon, M., M. Vachon, and N. Broglio, Epidemiological and clinical characteristics of the scorpion envenomation in Tunisia, Toxicon, 20(1), 337-44,1982.
3. Khalil, N.Y., E. A., Leiurus abdullahbayrami. (Scorpiones: Buthidae),a new species for the scorpion fauna of Syria. Journal of Animal Diversity, 12(1), 1-6, 2010.
4. Dhandapani, G., et al., Purification of antibody fragments via interaction with detergent micellar aggregates. Sci Rep,11(1), 11697, 2021.
5. Krifi, M.N., et al. Improvement and standardization of antivenoms sera, Arch Inst Pasteur Tunis, 69(3-4), 253-61, 1992.
6. Hamers-Casterman, C., et al. Naturally occurring antibodies devoid of light chains. Nature, 363(6428), 446-8, 1993.
7. Oukkache, N., et al. Comparison between two methods of scorpion venom milking in Morocco. J Venom Anim Toxins Incl Trop Dis,. 19(1), ,.
8. Tobassum, S., et al. Effect of Milking Method, Diet, and Temperature on Venom Production in Scorpions. J Insect Sci, 18(4), 2018.
9. Green, A. and W. Hughes, [10] Protein fractionation on the basis of solubility in aqueous solutions of salts and organic solvents. Methods in Enzymology, 1, 67-90, 1955.
10. Wingfield, P., Protein precipitation using ammonium Curr Protoc Protein Sci, Appendix 3: p. Appendix 3F,. , 2001
11. Ammonium Sulfate Calculator.; Available from: https://www.encorbio.com/protocols/AM-SO4.htm, 2021.
12. Bradford, M., A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72(1–2), 248-254, 1976.
13. Simpson, R.J., Rapid coomassie blue staining of protein gels. Cold Spring Harb Protoc,(4), 5413, 2010.
14. Mahmood, T. and P.C. Yang, Western blot: technique, theory, and trouble shooting. N Am J Med Sci, 4(9), 429-34, 2012.
15. Gagnon, P. and R. Nian, Conformational plasticity of IgG during protein A affinity chromatography. J Chromatogr A, 1433, 98-105, 2016.
16. Christine Nowak, J.K.C., Shara M. Dellatore,Amit Katiyar,Ram Bhat,Joanne Sun,Gomathinayagam Ponniah,Alyssa Neill,Bruce Mason,Alain Beck &Hongcheng Liu, Forced degradation of recombinant monoclonal antibodies: A practical guide. Taylor & Francis Online, 9(8), 1217-1230, 2017.
17. Muhammad Haddad, C.S., Houssam Eddin Khalaf and Abdul Qader Abbady, Purification of polyclonal IgG specific for Camelid’s antibodies and their recombinant nanobodies. Open Life Sciences, 2(1), 1-9, 2016.
18. Van der Linden, R., et al., Induction of immune responses and molecular cloning of the heavy chain antibody repertoire of Lama glama. J Immunol Methods, 240(1-2), 185-95, 2000.
19. Arbabi Ghahroudi, M., et al., Selection and identification of single domain antibody fragments from camel heavy-chain antibodies. FEBS Lett, 414(3), 521-6, 1997.
20. Hebert, G.A., P. Pelham, and B. Pittman, Determination of the optimal ammonium sulfate concentration for the fractionation of rabbit, sheep, horse, and goat antisera. Appl Microbiol, 25(1), 26-36, 1973.
21. Hebert, G.A., Ammonium sulfate fractionation of sera: mouse, hamster, guinea pig, monkey, chimpanzee, swine, chicken, and cattle. Appl Microbiol, 27(2), 389-93, 1974.
22. Khamehchian, S., et al., Study on camel IgG purification: a new approach to prepare Naja Naja Oxiana antivenom as passive immunization for Hum Vaccin Immunother, 10(6), 1633-8, 2014.
23. Laptos, T. and J. Omersel, The importance of handling high-value biologicals: Physico-chemical instability and immunogenicity of monoclonal antibodies. Exp Ther Med, 15(4), 3161-3168, 2018.